1-Secondo la teoria VSEPR la geometria della molecola AsCl3 è:
- trigonale planare
- a T
- trigonale piramidale
- Nessuna delle precedenti opzioni e corretta
Soluzione
La teoria VSEPR ( dall’inglese Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche del guscio di valenza) è un metodo proposto da Gillespie per individuare la disposizione geometrica degli atomi in una molecola considerando che i doppietti elettronici siano essi impegnati o non impegnati (lone pairs) in un legame, tendono a disporsi il più lontano possibile fra loro in conseguenza della legge di Coulomb, secondo la quale cariche elettriche di segno uguale si respingono. Il metodo comunemente usato per stabilire la geometria molecolare nella teoria VESPR è il cosiddetto metodo AXE. La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1. La X rappresenta quanti legami sigma si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti nell’atomo centrale. La somma di X ed E, definita come numero sterico, è associata anche al numero totale di orbitali ibridati considerati dalla teoria del legame di valenza.Quì di seguito puoi trovare alcuni esempi:
![]()
![]()
![]()
![]()










Naturalmente la molecola AsCl3 è del tipo AX3E poiché As possiede un doppietto elettronico solitario (lone pair) ne consegue che la struttura è piramidale

Risposta corretta C
2-Indicare, in base alla teoria VSEPR quale delle seguenti affermazioni è errata:
- gli angoli di legame in BF3 sono maggiori di quelli in PF3
- la geometria di ClF5 è a bipiramide trigonale
- la geometria assunta da una molecola con due coppie elettroniche di legame e due coppie libere è angolare
- SF6 e una molecola apolare
Soluzione
BF3 e PF3 hanno la seguente struttura :


ovviamente gli angoli di BF3 120° sono maggiori di quelli di PF3.
ClF5 ha una struttura AX5E per cui questa struttura piramidale quadrata e non bipiramide trigonale

La risposta C è corretta in quanto AX2E2 è angolare infatti

Per quanto riguarda SF6 sappiamo che un dipolo si forma quando due cariche di uguale intensità ma di segno opposto sono collocate a una certa distanza r. Al dipolo è associato un certo momento dipolare ( μ ) dato dal prodotto tra l’intensità di carica Q e la distanza r: μ = Q x r
I dipoli di ogni singolo legame covalente polare possono essere rappresentati con dei vettori.La somma dei vettori determina il dipolo associato alla molecola. La geometria della molecola è la seguente :

Da tale struttura si può dedurre che i vettori SF sono uguali in modulo(cioè nel loro valore) ma la loro somma risulta essere zero essendo diretti verso direzioni opposte.Si deduce che la risposta D è corretta mentre la risposta errata è B.
3-Aggiungendo una mole di sodio metallico a un recipiente contenente svariati litri d’acqua, si otterrà:
- una mole di O2
- una mole di ioni H+
- 0,5 moli di ioni Na+
- una mole di ioni OH-
soluzione
la reazione che avviene è:
2Na + 2H2O → 2NaOH + H2
Il sodio è un metallo soffice che non può esistere in natura come sodio metallico Na, in quanto si ossida a contatto con l’aria e reagisce violentemente con l’acqua. Per questi motivi viene conservato in laboratorio in un barattolo contenente petrolio raffinato.
Se si fa reagire il sodio con acqua a una temperatura di 38°C la reazione produce una piccola esplosione ed una scintilla causata dalla rottura dei legami non appena gli atomi vengono a contatto con H2O. Nel video potrai vedere come si comporta il metallo…
La risposta corretta è la D
4-Le energie di ionizzazione di un elemento sono riportate di seguito:
1°: 1251 kJ/mol, 2°: 2298 kJ/mol;
3°: 3822 kJ/mol; 4°: 5159 kj/mol;
5°: 6542 kJ/mol; 6°: 9362 kJ/mol;
7°: 11018 kJ/mol; 8°: 33604 kj/mol;
9°: 38600 kj/mol; 10°: 43961 kJ/mol.
Dedurre il gruppo di appartenenza dell’elemento:
- 14
- 15
- 16
- 17
Soluzione
L’energia di ionizzazione di un atomo è la quantità minima richiesta per allontanare un elettrone e portarlo a distanza infinita, a 0 gradi K e in condizioni di energia cinetica nulla.
X(g) → X+(g) + e− I1
l’energia di ionizzazione è la differenza di energia tra la specie X+(g) e X(g) questa è anche detta energia di prima ionizzazione.Le successive energie necessarie per allontanare ulteriori elettroni sono così definite
-
- X+(g) → X2+(g) + e− I2 energia di seconda ionizzazione
-
- X2+(g) → X3+(g) + e− I3 energia di terza ionizzazione
e così via. Quanto più un catione è carico positivamente, tanto più difficile è strappare un ulteriore elettrone, di conseguenza I1 << I2 << I3 ecc. Per gli atomi il numero delle energie di ionizzazione è uguale a quello dei loro elettroni, L’unità di misura con cui vengono espresse le E.I. è quasi sempre elettronvolt (eV), più raramente si usano i kJ/mol.
Dai dati del quesito, confrontando le Energie di ionizzazione , si può vedere un leggero aumento (come prevedibile) nelle energie di ionizzazione sino al valore dell’ E7 (settimo elettrone ) ma quando si giunge all0ottavo elettrone dal valore di E8 si ha un notevole aumento nell’E.I. il che significa che negli orbitali esterni vi sono 7 elettroni ma l’ottavo elettrone che viene staccato deve essere un elettrone che si trova su un orbitale più interno rispetto ai 7 esterni tant’è vero che occorre un’energia circa 300 volte maggiore rispetto a quella necessaria per staccare il settimo elettrone. Ciò ci permette di dire che l’atomo ha 7 elettroni esterni quindi appartiene al gruppo 17 e dai valori forniti confrontati con quelli tabulati si evince che si tratti del Cloro .
La risposta esatta è D
5-Indicare la risposta che elenca, in ordine sparso, i coefficienti stechiometrici necessari a bilanciare la seguente reazione:
HIO3 + HI –>I2+ H2O
A)1,1,2,3
B)1,5,5,7
C)1,3,3,5
D)2,3,3,5
soluzione
In questa reazione, lo Iodio dell’ HIO3 si riduce da +5 a zero mentre lo iodio di HI si ossida da -1 a zero, pertanto si ha una reazione di dismutazione (uno stesso atomo si ossida e si riduce contemporaneamente).
1 2[2IO3- + 10 e (5 per ogni atomo) + 12 H+ –> I2 + 6 H2O
510[2I- –> I2 + 2 e
__________________________________________
2IO3- + 10 I- + 12 H+ —> I2 + 5 I2 + 6 H2O
la reazione globale è pertanto:
2HIO3 + 10 HI –> 6I2 + 6 H2O
HIO3 +5HI –> 3I2 + 3H2O
i coefficienti sono
1,5,3,3
risposta corretta C
6- Qual è la formula minima di un composto binario di azoto e ossigeno costituito dal 63,65% іп peso di azoto?
- NO
- NO2
- N2O
- N2O3
soluzione
dividiamo la % dei costituenti per il peso atomico ed otteniamo i grammoatomi
63,65 /14= 4,54 per N
36,35 /16 = 2,27 per O
dividiamo per il numero più piccolo che è 2,27 ed otteniamo la formula minima del composto. Nel caso in esame si ha 4,54/2,27 =2 per N e 2,27/2,27 =1 Per O quindi la formula minima è:
N2O
Risposta esatta C
7- Indicare la risposta che elenca, in ordine sparso i coefficienti stechiometrici necessari a bilanciare la seguente reazione
NH3 + O2 <=> NO2 + H20
- 3,4,6,7
- 3,3,6,7
- 4,4,6,7
- 4,4,7,7
soluzione
Si tratta di una reazione redox: infatti l’azoto dell’NH3 (N-3) si ossida ad N+4 in NO2 mentre l’ossigeno da n.o. zero (O2) passa a n.o. -2 (O=).
4[N+3 –> N+4 + 7e
7[O2 + 4 e –> 2 O-2
______________________
4N-3 + 7O2 –> 2N+4 + 14 O-2
la reazione è pertanto
4NH3 +7 O2 –> 4NO2 + 6H2O
I coefficienti sono pertanto 4,7,4,6
risposta corretta C
8) Determinare la formula minima di un composto che all’analisi elementare ha dato un valore di composizione percentuale di ossigeno pari al 21,10% in massa e di zolfo pari al 10,57% in massa
- MnSO3
- MnSO4
- PbSO3
- PbSO4
soluzione
Per risolvere il problema si deve calcolare la % del metallo (Mn oppure Pb) che è data da 100- 21,10 + 10,57=68,33.
la formula minima si ottiene dividendo inizialmente ciascuna % per il peso atomico pertanto
20,10/16 = 1,25 per l’ossigeno
10,57/32 = 0,33 per lo zolfo
M può essere Mn o Pb
M= 68,33 / 54,9 = 1,25 per il Mn
M= 68,33 / 207,2 = 0,33 per il Pb
dividendo per il numero più piccolo ottenuto che è 0,33 si hanno i seguenti rapporti tra gli atomi:
M1S1O4 se M è il Pb
M4S1O4 se M è il Mn
si deduce che il composto in esame la cui formula minima è X1S1O4 è PbSO4
Risposta corretta D
9- Il dottor McCoy sta analizzando un composto. Ha intuito si tratti di un composto ionico e sta cercando degli indizi che confermino la sua teoria. Decide quindi di scioglierlo in un solvente. Quale sarà, tra le seguenti, la proprietà del solvente che guiderà la sua scelta?
- Sceglierà un solvente con costante dielettrica bassa
- Sceglierà un solvente con costante dielettrica alta
- Sceglierà un solvente con tensione di vapore bassa
- Sceglierà un solvente con tensione di vapore alta
soluzione
I composti ionici sono costituiti da ioni positivi e da ioni negativi tenuti insieme da un legame elettrostatico ( ionico ) dovuto all’attrazione tra particelle cariche di segno opposto. Quando un sale si scioglie in acqua il legame si rompe e gli ioni vengono circondati da una sfera di molecole d’acqua. La solubilizzazione del sale ionico avviene perché il solvente possiede una certa polarità ed attira gli ioni del cristallo proprio a causa della sua polarità.
La polarità di un solvente può essere misurata a mezzo della costante dielettrica o del momento di dipolo elettrico.I solventi polari presentano elevati valori della costante dielettrica e del momento di dipolo, mentre i solventi apolari presentano bassi valori della costante dielettrica e del momento di dipolo.
I solventi polari pertanto sciolgono i composti polari mentre i composti apolari vengono sciolti da solventi apolari.
Si deduce quindi che il Dr. McCoy userà un solvente con alta polarità e quindi elevata costante dielettrica.
Risposta corretta B
10- Si consideri reazione di equilibrio del tipo
A+B<=> C
In un sistema chiuso vengono poste 1,00 mol di A e 1,20 mol di B. All’equilibrio il 90% di A sarà convertito in C. Quale sarà il rapporto in ruoli B : A nel sistema all’equilibrio?
- 1,2 : 1
- 0,2 : 1
- 2 : 1
- Nessuna delle precedenti opzioni
soluzione
A+B<=> C
il 90% di A è il 90% di 1 mole quindi 0,9 moli
all’equilibrio si hanno
A + B <=> C
0,1 1,2-0,9 0,9
0,1 0,3 0,9
il rapporto B:A è 0,3:0,1 quindi la risposta corretta è D
11-Un composto binario di un elemento X e ossigeno ha formula XOZ. 106,6 g di questo composto sono decomposti in X e O2 secondo la reazione:
XO2 —›Х + O2
Alla temperatura di 273 K e alla pressione di 1,01x 105 Pa, tutto l’ossigeno prodotto da tale reazione occupa un volume di 33,6 L. Determinare il peso atomico dell’elemento
A- 32,1
B- 39,1
C- 71,1
D- 91,2
soluzione
Dai dati del quesito possiamo calcolare la quantità di Ossigeno presente in 106,6g di composto originario ricorrendo all’equazione di stato dei gas PV=(g/PM )x RT
pertanto 1,01 x 105 x 33,6 = (gr /32 )x 273 x 8,13 trasformando litri in metri cubi il valore di R è 8,13 m3Pa/mol x K
32 x 1,01 x 105 x 0,0336 /273 x 8,13 = gr da cui gr = 108595,2/ 2219,49 = 48,92 g cioè 48,92/32= 1,5 moli
Essendo la formula del composto XO2 ad ogni mole di O2 ottenuta corrisponde una mole di XO2 originaria per cui
1,5 = 106,6 /PM PM= 71,06 u da cui essendo gX+gO = PM allora peso di X = 71,06 – 2x 16 =39,06 g
risposta corretta B
12-A 320 K la costante di equilibrio Kp (esprimendo le pressioni in Pa) della reazione:
NH4Cl(s)<==> NH3(g) + HCl(g)
è Kp= 5,2 x 109
In un reattore chiuso, inizialmente a temperatura ambiente, viene inserito cloruro di ammonio. Nel reattore viene fatto il vuoto e la temperatura è portata a 320 K. Calcolare la pressione totale che si raggiunge all’equilibrio se la quantità di cloruro di ammonio è sufficientemente alta da non trasformarsi completamente nei prodotti.
- 1,4×105 Pa
- 7,1 x 106 Pa
- 9,7 x104 Pa
- 5,2 x 103 Pa
soluzione
calcoliamo Kx per la reazione ricordando che l’attività dei solidi ha sempre valore 1
NH4Cl(s)<==> NH3(g) + HCl(g)
1 x x quindi Kx= X2/1= X2
XHCl= nHCl/ntotali
XNh3 = nNH3/ ntotali
ma dall’equazione di dissociazione si evince che si forma un ugual numero di moli di NH3 e HCl per cui possiamo scrivere
XHCl=0,5 moli/L = XNH3 pertanto Kx = 0,5 x 0,5= 0,25
Sapendo che Kx è in relazione alla Kp attraverso la Kp= Kx PΔn ed essendo Δn = 2
si ha Kp/Kx= P2 pertanto P2 = 5,2 x 109 /0,25 = 20,8 x 109
P= √20,8 x 109
P= 1,44 x 105 Pa = 1,4 x 105 Pa
risposta corretta A
13- Una soluzione e preparata mescolando 5,00 g di una soluzione al 10,00% di KCl con 8,00 g di una soluzione al 5,00% di NaCl. Calcolare la molalità di Cl- della soluzione finale.
- 2,0 mol/ kg
- 1,1 mol /kg
- 1,5 mol/kg
- 1,7 mol/Kg
soluzione
per molalità si intende il numero di moli in 1 Kg di solvente. Dobbiamo quindi calcolare la quantità in moli di Cl- proveniente sia da KCl che da NaCl.
Quantità di Cl- proveniente da 5 g di KCl al 10%
se in 100 di sostanza vi sono 10 g di KCl allora in 5 g ve ne sono X X= 80/100= 0,5 g di KCl
se in una quantità in grammi pari al PM KCl vi sono 35,5 g di Cl- allora in 0,5 g ve ne sono X X= 35,5 x 0,5 /74,5
X= Cl-= 0,238 g
Quantità di Cl- proveniente da 8 g di NaCl al 5 %
se 100 :5 = 8 : X X= 0,4 g
se NaCl: 35,5 = 0,4 :X X= 35,5 x 0,4 /58,4 =0,243 g
quantità totale in grammi di Cl-= 0,243+ 0,238 =0,481 g
moli di Cl-=0,481 /35,5= 0,01354 moli
queste moli sono contenute in 13 g-0,481 g di solvente quindi la molarità è data da:
12,52: 0,01354 moli = 1000 : X
X=1.09 mol/kg = 1,1 moli/kg
Risposta corretta B
14- 0,168 g di un composto contenente cloro e ossigeno, (Cl2Ox )viene decomposto producendo 0,0800 g di Cl2. Stabilire la formula del composto.
A-Cl2O3
B- Cl2O
C – Cl2O7
D- Cl2O5
soluzione
per calcolare la formula minima di un composto occorre prima calcolare la % di Cl e di O presenti
la % Cl è:
0, 168 : 0,08 =100 :X X= 8/0,168= 47,6% Cl = 47,6%
la % O è :
100- 47,6 = 52,4 %
dividiamo la % di cloro per il suo Pa 47,6/35,5 = 1,34 grammoatomi
dividiamo la % di Ossigeno per il suo Pa 52,4 / 16=3,27 grammoatomi
dividiamo adesso per il numero più piccolo che è 1,34 quindi
per il Cl si ha 1,34/1,34 =1 per l’O 3,27/1,34 =2,4
Pertanto la formula minima del composto è Cl1 O2,5
Per individuare quale sia il composto dobbiamo calcolare il suo peso molecolare ricordando che
0,168:0,08 = PM : 2 Cl PM= 0,168 x 71,1 /0,08 = 149,3
questo PM corrisponde al PM del composto Cl2O5 infatti 71 + 5 x 16= 151
risposta corretta D
15- La concentrazione di CO2 nell’aria e 0,039 % V/V. Calcolare le moli di CO2 disciolte in 1,00 L di acqua, in equilibrio con l’aria alla pressione atmosferica di 1,32 x 105 Pa. Si consideri che la costante di equilibrio della reazione
CO2(aq) <=> CO2(g) Kp = 2,9 x 106 Pa L/mole
A 8,51 x 10-5 mol
B 4,96 x 10-5 mol
C 1,8 x 10-5 mol
D 2,55 x 10-5 mol
soluzione
si tratta di un’applicazione della Legge di Henry sulla solubilità dei gas nei liquidi. La legge di Henry stabilisce che, a temperatura costante, la quantità di un determinato gas che si scioglie in un determinato volume di un dato liquido è direttamente proporzionale alla pressione parziale del gas in equilibrio con il liquido. La legge di Henry può anche essere formulata dicendo che:
” la solubilità di un gas in un liquido è direttamente proporzionale alla pressione parziale del gas sovrastante il liquido”.
La quantità di CO2 nell’aria è 0,039% quindi se in 100 litri vi sono 0,039 litri di CO2 in 1 litro ve ne sono:
0,039/100 = 0,00039 L di CO2
Poichè la solubilità di un gas in un liquido segue la legge di Henry che dice che essa dipende dalla pressione a cui il gas si trova sottoposto ed essendo la pressione 1,32 x 105 Pa allora si ha :
1,32x 105 x 0,00039 = 51,48 moli ma CO2(g) è in equilibrio con CO2(l) per cui
[CO2(g)] / [CO2(l)] = 2,9 x 106 da cui [CO2(l)] = [CO2(g)] /2,9 x 106 pertanto
[CO2(l)] = 51,48 / 2,9 x 106
[CO2(l)] = 17,7 x 10-6 moli = 1,8 x 10-5 moli
risposta corretta C
16- Indicare quale delle seguenti reazioni è una dismutazione.

soluzione
Una reazione di dismutazione detta anche disproporzione è un particolare tipo di reazione di ossidoriduzione nella quale un’unica sostanza in parte si ossida e in parte si riduce: gli alogeni per esempio, in ambiente alcalino passano dallo stato elementare (stato di ossidazione 0) a ione alogenuro e ipoalogenito (gradi di ossidazione rispettivamente −1 e +1) secondo lo schema:
Ciò detto, si osserva che nelle prime due reazioni del quesito non si ha dismutazione .
L’ultima reazione, pur essendo un alogeno F2 con n.o.=0 in ambiente alcalino, forma in questo caso due composti in cui il n.o.= -1 cioè F- ed OF2 Il difluoruro di ossigeno (che si ottiene in pratica proprio con questa reazione) è un fortissimo ossidante, come suggerito dal fatto che in questo composto il numero di ossidazione dell’atomo di ossigeno è +2, (valore inusuale per l’ossigeno).
Invece la reazione C in cui NO2 (dovel’N ha n.o.+4) si trasforma in NO2- (in cui N ha n.o. +3) ed in NO3- (in cui N ha n.o. +5) .Pertanto questa è una reazione di dismutazione.
si evince che la risposta corretta è la C
17-A una soluzione 0,050 M di un catione X, si aggiungono rispettivamente le soluzioni indicate in figura:


Indicare il catione presente nella soluzione iniziale, dai valori riportati nella Tabella delle costanti di solubilità.
A) Ag+
B) Fe+2
C) Ba+2
D) Ca+2
soluzione
Dal momento che in tutti e tre i casi si forma un precipitato, ciò vuol dire che il prodotto delle concentrazioni (0,05 x 0,05 = 2,5 x 10-3 ) supera il valore del Kps tabulato. Pertanto dai valori di KPs per ogni ione indicato si può stabilire quale di essi sia il catione X.
Per Ag+
KPs Ag2CO3 = 8,1 x 10-12 Kps Ag2S = 6,0 x 10-51 KPs AgI = 1,5 x 10 -16
da questi dati si osserva che Ag+ precipiterebbe nelle tre soluzioni formando Ag2CO3, Ag2S,AgI
per Fe+2
Kps FeCO3 = 3,5 x 10-11 KPs FeS = 6 x 10-19 KPsFeI2 in acqua a 20°C è quasi insolubile
Fe+2 precipiterebbe solo in due delle 3 soluzioni FeCO3 e FeS
BaS è molto tossico, come CaS ed altri, che a contatto con H2O formano composti tossici:
Kps BaCO3= 8,1 x 10-9 KPs BaS = KPsBaI2=
KPs CaCO3 = 3,8 x 10-9 KPSCaS = KPS CaI2 =
questo indica che Ba+2 e Ca+2 precipiterebbero solo in una delle soluzioni BaCO3 e CaCO3
si deduce che il catione X è Ag+ che è l’unico a precipitare nelle tre soluzioni.
risposta corretta A
18-Determinare per quale valore della concentrazione molare di B nell’equilibrio
A(g)<==> B(g) + C(g) .
con costante Kc= 0,25 (espressa in termini di concentrazioni molari), risulta
[A] = [C].
A) 0,25 M
B) 0,13 M
C) 0,65 M
D) 0,33 M
soluzione
essendo Kp=[B][C]/[A] se [A]=[C] si ha kp= [B] quindi quando [A]=[C] allora [B]= 0,25 mol/L
risposta corretta A
19-L’apotransferrina (ApoT), proteina che trasporta il ferro nel plasma delle cellule, viene titolata con una soluzione acquosa di FeClS:
ApoT + 2 Fe3+ <=> Fe2(ApoT)
Mentre i due reagenti (ApoT, Fe+3) sono incolori, il prodotto Fe2(ApoT) è rosso ed assorbe a 465 nm. Indicare quale delle curve riportate in figura mostra la variazione di assorbanza a 465 nm di una soluzione di ApoT in funzione di titolante aggiunto( si trascuri la variazione di volume della soluzione).
A B

soluzione
poichè è il prodotto che assorbe, la sua assorbanza aumenta nel tempo sino a che la reazione non sia completa ciò significa che la figura che mostra l’andamento dell’assorbanza in funzione del tempo è la A.
20- Indicare la particella x che manca nella seguente reazione nucleare:
![]()
A) elettrone
B) protone
C) neutrone
D) fotone
soluzione
I protoni inizialmente sono 7 + 2 = 9 protoni (che appartengono rispettivamente ad N e ad He ): poichè si forma ossigeno che ha numero di massa 17 e numero atomico 8 ( essendo neutroni= protoni- numero di massa) si deduce che vi sono 8 protoni e 9 neutroni.
Il numero di neutroni rimane immutato(cioè 9)
poichè inizialmente i protoni erano 9 e dopo la reazione divengono 8 è evidente che X non è altro che un protone.
Risposta corretta B
21-Calcolare il rapporto [Сl-] / [Br-] in una soluzione ottenuta mescolando nell’ordine volumi uguali di una soluzione 0,100 M di NaCl, di una soluzione 0,1000 M di NaBr e di una soluzione 0,200 M di AgNO3
- 123
- 375
- 545
- 766
soluzione
i valori di Kps tabulati sono : Kps AgBr = 3,3 10-13 KPs AgCl= 1,8 10-10
Sappiamo che precipita prima lo ione che richiede minor quantità di reattivo pertanto:
la quantità necessaria per precipitare AgCl è :
[Ag+]= Kps/[Cl-]
la quantità necessaria per precipitare AgBr è :
[Ag+]= Kps/ [Br-]
Inizia a precipitare prima AgBr e quando inizia a precipitare AgBr la [Ag+] sarà uguale a quella necessaria per precipitare Cl- come AgCl.
Pertanto essendo [Ag+] uguale nei due casi si ha KpsAgCl/[Cl-] = KpsAgBr/ [Br-]
possiamo scrivere allora Kps AgCl /KpsAgBr = [Cl-]/[Br-] da cui
1,8 x 10-10 /3,3 x 10-13= 0,545 x 103
[Cl-]/[Br-] = 545
risposta corretta C
22. A una soluzione satura di CaF2 (s) viene aggiunto un solido al tempo t1. In base alla variazione delle concentrazioni ioniche in soluzione, riportate in figura, individuare il solido aggiunto.

A) NaF (s)
B) CaCl2 (s)
C) NaCl (s)
D) KNO3 (s)
soluzione
Il grafico indica che l’ aggiunta del sale produce un aumento di Ca+2 ed una diminuzione di F- ed ovviamente l’unico solido che fornisce Ca+2 è CaCl2 quindi è quest’ultimo sale che viene aggiunto in quanto l’aggiunta di Ca+2 fa diminuire F- perchè si forma CaF2 come corpo di fondo.
risposta corretta B
23-Quale titolazione presenta l’andamento del pH in funzione del volume di titolante indicato nella figura?

A-Una soluzione di HF con una soluzione di NaOH
B-Una soluzione di NaOH con una soluzione di HCl
C-Una soluzione di HCl con una soluzione di NHS
D- Una soluzione di HCl con una soluzione di NaOH
soluzione
Nelle titolazioni acido-base, le curve sono i grafici che rappresentano la variazione di pH della sostanza titolata (titolo) in funzione della sostanza aggiunta (titolante). Sull’asse delle ascisse sono riportati i diversi valori di titolante aggiunto e sulle ordinate si trovano i corrispondenti valori del pH.
Un esempio di una titolazione di un acido forte con una base forte è fornito in figura:

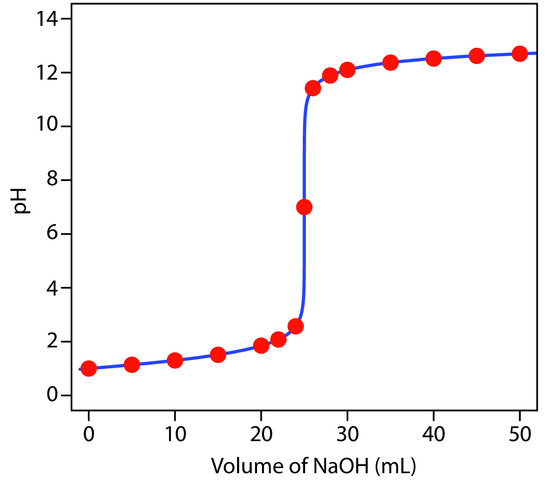
soluzione
Supponiamo di titolare 50 ml di HCl 0,1 M con NaOH 0,2 M
volume ml NaOH 0,2 M aggiunto PH
0,0 1
5.00 1,4
10 1,3
20 1,85
come si vede il PH aumenta all’aumentare di NaOH aggiunto e ricordiamo che il calcolo si effettua da:
Vol x M = vol x M le moli sono in un volume totale pari a vol di HCl aggiunto + volume di NaOH quindi ad ogni aggiunta occorre calcolare la nuova molarità di H+ perchè ad ogni aggiunta il volume totale cambia.
la curva in esame rappresenta la titolazione di HCl con NaOH
la prima curva di titolazione mostra la titolazione di HCl con NaOH e la seconda di NaOH con HCl
E evidente a questo punto che la risposta al quesito è D
24-Una soluzione acquosa di cloruro di sodio è contenuta in un recipiente termostatato il cui spazio di testa contiene aria. Mediante un materiale igroscopico (non in conflitto con la soluzione)
l’umidità dell’aria viene costantemente rimossa. Che cosa e possibile che accada dopo un certo tempo?
A-Si formeranno dei cristalli di cloruro di sodio
B-Parte del cloruro di sodio passera in fase Vapore
C-La concentrazione di cloruro di sodio nella soluzione diminuirà
D-La massa della soluzione aumenterà
soluzione
Poichè l’umidità dell’aria (H2O vapore) viene rimossa costantemente, ne consegue che la tensione di vapore dell’H2O della soluzione provoca una continua evaporazione dell’H2O liquida che porta ad un continuo aumento della concentrazione del sale. La soluzione diviene pertanto prima soprassatura e poi si vengono a formare i cristalli di NaCl come corpo di fondo.
Risposta corretta A
25- Una macchina frigorifera lavora seguendo un ciclo di trasformazioni reversibili scambiando calore esclusivamente con due serbatoi di calore a temperatura Tc ed a temperatura Th (con Th> Tc).Dopo aver svolto un numero intero di cicli, la macchina ha prelevato una quantità di calore Qc (in valore assoluto) dal serbatoio di calore alla temperatura Tc cedendo una quantità di calore Qh (in valore assoluto) al serbatoio di calore alla temperatura Th. Per far ciò, ha assorbito il lavoro W (in valore assoluto) dall’esterno. Quale delle seguenti affermazioni è vera?
A) Qh = Qc ;W=0
B) Qh= Qc- W
C) Qh=Qc+W
D) Qh+Qc=W
soluzione
Il primo principio della termodinamica asserisce che la variazione di energia interna subita da un sistema termodinamico è pari al bilancio dei calori e dei lavori ΔU=Q−W .Il secondo principio della termodinamica viene dedotto dal funzionamento delle cosiddette macchine termiche che è un dispositivo in grado di scambiare calore e lavoro con l’ambiente circostante o con altri sistemi quali due sistemi a temperatura TC e TH. Questi scambi avvengono per mezzo di un certo numero di trasformazioni termodinamiche al termine delle quali la macchina termica viene riportata nelle condizioni iniziali: si dice quindi che la macchina ha effettuato un ciclo termodinamico. Al termine di un ciclo, la variazione di energia interna è nulla, dal momento che si è tornati al punto di partenza. Di conseguenza, sempre per il primo principio, il lavoro scambiato durante un ciclo equivale al calore scambiato durante quel ciclo.Nel caso del quesito in esame, la macchina preleva calore Qc da una temperatura minore Tc e ne trasferisce una quantità Qh alla sorgente Th e per far questo è necessario fornire lavoro dall’esterno W ma per il primo principio della termodinamica Wc= -Qc (essendo il lavoro compiuto sul sistema) e Wh= Qh rappresenta il lavoro W compiuto sul sistema ciò significa che Wc+Wh= -Qc + Qh da cui essendo W=Wc+Wh .
W= -Qc +Qh
Qc +W = Qh
risposta corretta C
26-Quale tra le seguenti affermazioni può essere considerata uno dei principali vantaggi dei catalizzatori eterogenei rispetto a quelli omogenei?
A)I catalizzatori eterogenei sono più facilmente separabili dai prodotti a reazione avvenuta
B)I catalizzatori eterogenei sono più attivi
C)I catalizzatori eterogenei sono attivi a temperatura più bassa
D)I catalizzatori eterogenei non si disattivano mai
soluzione
Un catalizzatore è una specie chimica che interviene in una reazione e ne modifica il complesso attivato che si forma durante la reazione abbassando l’energia di attivazione ed aumentando quindi la velocità. Il catalizzatore si ritrova inalterato alla fine della reazione.

La curva in rosso rappresenta il cammino di reazione per effetto del catalizzatore ed Ea è l’energia di attivazione.
Un catalizzatore è detto omogeneo se si trova nella stessa fase dei reagenti. Il vantaggio dei catalizzatori omogenei consiste nel miglior contatto con i reagenti ma questo è al tempo stesso uno svantaggio, perché è difficile separare e recuperare il catalizzatore alla fine della reazione. In genere essi sono acidi minerali oppure composti dei metalli di transizione.
Un catalizzatore eterogeneo si trova in una fase diversa da quella in cui sono presenti i reagenti. Un catalizzatore eterogeneo è in genere formato da un supporto inerte o reattivo su cui sono posizionati il catalizzatore vero e proprio, oltre ad eventuali sostanze che agiscono in modo particolare migliorando o modulando l’azione catalitica. Il catalizzatore eterogeneo viene pertanto facilmente recuperato per un successiva utilizzazione.
![]() Un altro gruppo di catalizzatori è rappresentato dagli enzimi che catalizzano reazioni biochimiche e che sono dotati di grande selettività.
Un altro gruppo di catalizzatori è rappresentato dagli enzimi che catalizzano reazioni biochimiche e che sono dotati di grande selettività.
Da quanto esposto è chiaro che la risposta corretta è A
27-La decomposizione della vitamina B12, la trasformazione dell’ergosterolo in vitamina D2 e la trasformazione del 7- deidrocolesterolo in vitamina D3 sono tipici esempi di reazioni attivate dalla radiazione ultravioletta la cui velocità non è legata alla quantità di substrato reattivo, ma solo al fatto che l’energia luminosa abbia associata l’energia necessaria ad attivare la reazione. Ci si aspetta quindi che tali reazioni siano:
A)enzimatiche
B) del secondo ordine
C) del primo ordine
D)di ordine zero
soluzione
l’ordine di reazione relativo ad un reagente è l’esponente al quale è elevata la concentrazione del reagente nella reazione cinetica. La cinetica di una reazione è una legge che lega la velocità di reazione alla concentrazione di uno o più reagenti. Data una generica reazione (diretta o irreversibile):
- aA + bB → cC + dD
la legge cinetica è del tipo:
in cui si può osservare che la velocità dipende dalla concentrazione dei reagenti.
k è una costante positiva detta costante di velocità della reazione, e rappresenta la velocità iniziale della reazione quando i reagenti hanno concentrazione unitaria; m ed n sono degli esponenti non necessariamente uguali ad a e b.
Si definisce ordine di reazione la somma di m + n. Nel caso di una reazione A –> B
Se V= k [A] la velocità è detta del primo ordine
Se V=k [A]2 la velocità è detta del secondo ordine
Sono reazioni di ordine zero quelle reazioni la cui velocità è indipendente dalla concentrazione dei reagenti.
Nel caso in esame le reazioni dipendono solo dall’energia E=hν pertanto non dipende dai reagenti in esame ciò significa che la reazione è di ordine Zero.
Risposta corretta D
28-Per una data reazione, in determinate condizioni, il valore del quoziente di reazione Q è maggiore del valore della costante di equilibrio K . Di conseguenza
- si richiede l’aggiunta di un catalizzatore per aumentare il valore di K
- la reazione è in condizione di equilibrio
- la reazione procederà prevalentemente da destra a sinistra
- la reazione non potrà in alcun modo raggiungere la condizione di equilibrio
soluzione
Il quoziente di reazione ci permette di prevedere la direzione di una reazione di equilibrio conoscendo le concentrazioni iniziali o, nel caso di un equilibrio gassoso, le pressioni parziali delle specie che partecipano all’equilibrio. In una miscela di reazione, per ogni data serie di concentrazioni iniziali possiamo impostare un rapporto di concentrazioni avente la stessa forma della costante di equilibrio. Questo rapporto viene detto quoziente di reazione e viene indicato con Qc. Se Qc = Kc la reazione è all’equilibrio. Se Qc < Kc si verifica una reazione netta da sinistra a destra ( reazione diretta ). Se Qc > Kc si verifica una reazione netta da destra verso sinistra ( reazione inversa ).
Per esempio per una reazione A<=> B e se conosciamo le concentrazioni sia di A che di B (non quelle all’equilibrio)possiamo calcolare il valore di Qr facendo il rapporto Qr=[B]/[A] se questo valore è maggiore di Keq si ha una reazione da destra verso sinistra mentre se Qr < Keq la reazione procede verso destra. Praticamente se [A]= 0,90 M e [B]=0,40 M e la Keq = 5,5 x 102
il calcolo di Qr= 0,40/ 0,90 = 0,44 In questo caso Qr< Keq che è Keq= 550 pertanto la reazione
A<=> B procede verso destra
Nel caso specifico del quesito Qr > Keq quindi la reazione procede da destra verso sinistra.
Risposta corretta C
29-Si determini la temperatura di ebollizione di una soluzione di iodio in benzene formata mescolando 500 g di benzene e 12,8 g di iodio, sapendo che la costante ebullioscopica del benzene è 2,53 °C kg molª, e che il benzene puro bolle a 80,10 °C.
A) 79,75 °C
B) 80,35 °C
C) 81,15 °C
D) 82,65 °C
soluzione
quando in un solvente si scioglie un soluto non volatile, la tensione di vapore della soluzione diminuisce per cui diviene più piccola di quella del solvente puro e la temperatura di ebollizione della soluzione è (a parità di pressione esterna) superiore a quella del solvente. (ricordiamo che un liquido bolle quando la sua tensione di vapore eguaglia la pressione esterna).
Aggiungendo un soluto in un liquido, si osserva quindi un aumento del punto di ebollizione (innalzamento ebullioscopico) e la diminuzione del punto di congelamento della soluzione(abbassamento crioscopico).
Tutto ciò dipende soltanto dalla concentrazione delle particelle del suddetto soluto e dal numero di particelle presenti.
Il calcolo della Variazione di temperatura è effettuato ricordando che ΔT= Keb x molalità della soluzione x numero particelle
Keb = costante ebulloscopica.
Calcoliamo pertanto la molalità della soluzione in esame
molalità= moli di soluto in 1000 grammi di solvente
moli di soluto = 12,8g/127 x 2 = 12,8/254 =0,05 moli in 500 g di solvente
La molalità è quindi 500: 0,05 = 1000 :X X= 50/500 = 0,1 moli/Kg
trattandosi di molecola di Iodio il numero di particelle dello iodio I2 in soluzione è 1
(se fosse stato ad es. NaCl il numero sarebbe stato 2 oppure per CaCl2 sarebbe stato 3)
La ΔT= 0,1 x 2,53 x 1 = 0,25 °
essendo ΔT= temp soluzione – temp solv puro = 0,25 ed essendo
Teb soluzione = temp solv puro + 0,25 =80,10+0,25= 80,35
risposta corretta B
30-Calcolare il ΔG° della reazione (da bilanciare)
Fe3O4(s) + H2 (g) —> Fe(s) + H2O(l)
A 25° l’energia di Gbbs standard di formazione di Fe3O4 ed H2O(g) è 1015,4 KJ/mol e 237,1 KJ/mol
A) ΔG° = 67,0 kJ /mol
B) ΔGº = 87,0 kJ/ mol
C) ΔG°= 107,0 kJ /mol
D) ΔGº = 127,0 kJ/mol
soluzione
Fe3O4 + 4H2  3Fe + 4H2O
3Fe + 4H2O
ricordando che ΔG di una sostanza solida non viene considerata nei calcoli e sapendo che
ΔG° reazione = ∑ G° prodotti – ΔG°reagenti
ΔG° reazione = – 4 x 237,1 -(- 1015,4) = -948,4 + 1015,3 = 67° KJ/mol
risposta corretta A
31- La reazione di decomposizione di A in B, secondo la seguente reazione, è del primo ordine.
A(g) –> 2 B(g)
Sapendo che, la concentrazione iniziale del reagente è 0,3 mol /dm3 e dopo 50 minuti è 0,1mol/dm3 qual è la costante cinetica della reazione?
A-5,00 x 10-3/s
B-3,66 x 10-4 /s
C-7,00 x 10-4 /s
D-9,33 x 10-5 /s
soluzione
Consideriamo una reazione generica:
a A + b B –> c C + d D
Come misura della velocità di reazione si assume la diminuzione della concentrazione di uno dei reagenti o l’aumento della quantità di uno di prodotti per unità di tempo:
V= -1/a d[A]/dt = -1/b d[B]/dt = +1/c d[C]/dt = +1/d d[D] /dt
I coefficienti stechiometrici hanno il segno negativo per i reagenti (che nel tempo diminuiscono) e positivo per i prodotti (che aumentano nel tempo).La velocità di una reazione viene espressa quantitativamente da una equazione che deve essere ottenuta sperimentalmente.
Consideriamo per esempio la reazione:
A + B → prodotti
l’equazione cinetica ha questa forma
v = k [A]n[B]m
v indica la velocità di reazione e k è la costante cinetica.m ed n sono numeri, ricavati sperimentalmente, la cui somma è detta ordine di reazione.
Per una reazione del primo ordine si ha: V = k d[A]/dt
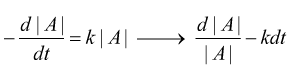


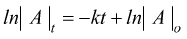
[A]t= 0,1 [A]0 = 0,3 t =50 minuti = 3000 secondi
-2,3 = -k3000 -1,2
moltiplicando tutto per -1 si ha 2,3= k x 3000 +1,2
quindi k = 2,3-0,1/3000
k= 3,6 x 10-4 /s
risposta corretta B
32-A 298,15 K, il ΔG°(C, diamante) =2,90 kJ/ mol, mentre le densità della grafite e del diamante sono 2,25 e 3,54 kg/dm3 rispettivamente. A quale pressione le due forme allotropiche saranno in equilibrio a questa temperatura?
A) 3,5 x 1013 Pa
B) 1,5 x 109 Pa
C) 5,5 x 1013 Pa
D) 6,5 x 1016 Pa
soluzione
elementi che presentano più stati allotropici possono trovarsi in una fase metastabile, infatti il carbonio si presenta sotto le due forme allotropiche di diamante e grafite. Il diamante è una forma metastabile del carbonio a pressione e temperatura standard e può essere convertito in grafite dopo assunzione di una certa energia di attivazione.
Diamante e grafite, com’è noto, sono le due più comuni forme allotropiche del carbonio stabili a pressioni e temperature ordinarie. In tali condizioni, il diamante, avendo un’energia libera di formazione leggermente maggiore di quella della grafite (2.9 kJ/mol), rappresenta una fase metastabile, la cui grafitizzazione è ostacolata da un’energia di attivazione molto elevata (circa 3eV/atomo), dell’ordine dell’energia di legame del carbonio. La grafite rappresenta quindi, a pressione e temperatura ambiente, la fase più stabile, a dispetto della regola empirica che vuole che le fasi più stabili siano quelle a maggiore densità, avendo generalmente numeri di coordinazione maggiori .Il diagramma delle fasi del carbonio, in effetti, presenta la linea di fusione del diamante e quella della grafite disposte in modo tale che, a pressione e temperatura ambiente, il carbonio risulta ben all’ interno di entrambe le regioni di stabilità delle fasi solide. e ciò indica che il carbonio può esistere, in condizioni ordinarie, in entrambi gli stati di aggregazione.
Poiché l’energia molare libera di Gibbs del diamante è 2,9 kJ / mol ed è maggiore di quella della grafite, la grafite è la fase stabile in queste condizioni. Bisogna sempre ricordare che la fase stabile ha sempre l’energia libera molare di Gibbs inferiore .
Per calcolare la pressione a cui queste due fasi del carbonio sono in equilibrio, ricordiamo innanzitutto che la dipendenza dalla pressione di g è data da:
(dg/dp)T = V cioè al volume molare
applicando al diamante ed alla grafite questa relazione si ha :
(dΔg/dp)T = ΔV (differenza dei volumi molari(Vd-Vg))
Δg= gd -gg gd=gdiamante gg= grafite
il Volume molare è in realzione alla densità mediante l’espressione V= M / densità quindi V=12/densità
Non resta che integrare l’Eq. (dΔg/dp)T = ΔV dalla pressione ambiente (1 atm), alla quale
Δg = Δg0 = 2,9 kJ / mol, alla pressione di equilibrio peq, alla quale Δg = 0.
L’integrazione viene fatta presupponendo che siano le due fasi solide incomprimibili, cioè che Δv è
costante. Questo ci dà
−Δg0 = ΔvΔp.
risolvendo per Δp e sostituendo i valori numerici che otteniamo da
V=12/3540000 = 3,4 x 10-6 le unità di misura sono infatti m3/mole
V=12/2250000 = 5,3 x 10-6
ΔV= 1,9 x 10-6 m3/mole
Δp = −Δg0 /Δv
Δp = (−2.9 kJ/mol)/(−1.92 × 10−6 m3/mol) e trasformando KJ in J (moltiplicando x 1000)
Δp = 1.5 × 109 P a.
La pressione iniziale di 1 atm è completamente trascurabile rispetto a questa grande
differenza di pressione, quindi abbiamo Peq = 1.5 GPa.
Risposta corretta B
33- Utilizzando i seguenti dati relativi alla reazione
A + B ⇆ C
Determinare l’ordine di reazione rispetto ad A e B, e la costante cinetica.
[A] [B] velocità iniziale
(mol dm‒3) (mol dm‒3) (mol dm‒3 s‒1)
2,30 ∙10‒4 3,10 ∙10‒5 5,25 ∙10‒4
4,60 ∙10‒4 6,20 ∙10‒5 4,20 ∙10‒3
9,20 ∙10‒4 6,20 ∙10‒5 1,68 ∙10‒2
- A) [A] [B] ; rA = (3,20 ∙108 mol‒1 dm3 s‒1 )
- B) [A] [B]2 ; rA = (3,20 ∙108 mol‒2 dm6 s‒1 )
- C) [A]2[B] ; rA = (3,20 ∙108 mol‒2 dm6 s‒1)
- D) [A]2[B]2 ; rA = (3,20 ∙108 mol‒3 dm9 s‒1)
soluzione
sappiamo che nelle reazioni del primo ordine
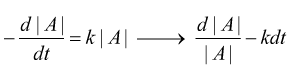
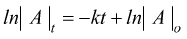
Per le reazioni del secondo ordine si ha:
![{\displaystyle {\frac {d\left[A\right]}{dt}}=-k\left[A\right]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/097b5d35d3573f6a26f653ee09d3caf8ce96045a)
![{\displaystyle {\frac {d\left[A\right]}{\left[A\right]^{2}}}=-kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd3979525b137a30c668df493ccad1e54aee229d)
![{\displaystyle \int _{\left[A\right]_{0}}^{\left[A\right]}{\frac {d\left[A\right]}{\left[A\right]^{2}}}=-\mathrm {k} \int _{0}^{t}dt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/106c679a8107613d2ae95652969c5cdec4df6c72)
in una reazione di ordine superiore al 2 e cioè di ordine N si ha:
nel caso in esame se si trattasse di una reazione del primo ordine avremmo
[A] [B] V
2,30 ∙10‒4 3,10 ∙10‒5 5,25 ∙10‒4 /s k= 1,3 x10-5
4,60 ∙10‒4 6,20 ∙10‒5 4,20 ∙10‒3 /s k= 6,7 x 10-6
9,20 ∙10‒4 6,20 ∙10‒5 1,68 ∙10‒2 /s k= 3,3 x 10-6
dai valori di k si vede che si tratta di valori diversi tra loro quindi è da escludere la riposta A
Se si trattasse di una reazione del secondo ordine [B]2 e del primo in [A] si avrebbe:
2,30 ∙10‒4 3,10 ∙10‒5 5,25 ∙10‒4 k= 4,2 x 10–10
4,60 ∙10‒4 6,20 ∙10‒5 4,20 ∙10‒3 k = 4,2 x 10-10
9,20 ∙10‒4 6,20 ∙10‒5 1,68 ∙10‒2 k= 2,1 x 10-10
anche in questo caso le costanti non risultano uguali.
Nel caso si trattasse di una reazione del secondo ordine in [A] e del primo ordine in [B] si avrebbe:
2,30 ∙10‒4 3,10 ∙10‒5 5,25 ∙10‒4 k =3,12 x 10-9
4,60 ∙10‒4 6,20 ∙10‒5 4,20 ∙10‒3 k = 3,12 x 10-9
9,20 ∙10‒4 6,20 ∙10‒5 1,68 ∙10‒2 k = 3,12 x 10-9
dai valori di k (che sono costanti ) è evidente che la risposta corretta è C cioè [A]2 [B] =kt ed il valore di k=3,12 x 10-9 mol dm-3/s o meglio 3,20 ∙108 mol‒2 dm6 s‒1
Risposta corretta C
34-Un contenitore è diviso in due settori, A e B, da una parete scorrevole. La parete può scorrere SOLO in modo che il volume di A aumenti e quello di B diminuisca. La condizione di equilibrio si raggiunge quando:
A) PA ≥ PB
B) PA = PB
C) PA ≤ PB
D) PA ≥ 0
soluzione
ricordando che PV = k e P=k/V è evidente che se V aumenta la pressione deve diminuire quindi PA ≤ PB.
risposta corretta C
35. Qual è il lavoro massimo che può esser fatto da una macchina termica che opera tra 500 e 200 K, se il calore assorbito a 500 K è 1,00 kJ?
A) 300 cal
B) 600 J
C) 3,38 kJ
D) 33,8 J
soluzione
ricordando che l’efficienza di una macchina termica è
ε = Tcaldo- Tfreddo/Tcaldo pertanto ε = 500-200/500 = 0,6
inoltre essendo il lavoro massimo w (quando vengono assorbiti 1000 J dalla sorgente a 500° ) pari al prodotto
w =ε q si ottiene W= 0,6 x 1000= 600 J
risposta corretta B
36. Sciogliendo 54,0 g di un soluto non volatile in 150 g di acqua, la tensione di vapore diminuisce da 3168 Pa a 3062 Pa. Qual è la massa molare del soluto?
A) 398 g mol‒1
B) 388 g mol‒1
C) 358 g mol‒1
D) 188 g mol‒1
soluzione
(Ricordiamo che la massa molare del soluto non è altro che il suo Peso Molecolare PM)
Alcune proprietà chimico-fisiche dipendono esclusivamente dal numero di particelle di soluto presenti nel solvente, mentre sono indipendenti dalla natura del soluto. In quanto collegate alla concentrazione della soluzione, tali proprietà sono dette colligative, e riguardano i seguenti fenomeni: l’abbassamento della tensione di vapore; l’innalzamento del punto di ebollizione; l’abbassamento del punto di congelamento; la pressione osmotica. Questo comportamento è spiegabile se si considera che in una soluzione solo una parte delle particelle è costituita da solvente, mentre la parte restante è costituita dalle particelle di soluto, la cui tensione di vapore (se non è volatile) è praticamente trascurabile; di conseguenza le molecole di solvente hanno minore probabilità di evaporare rispetto a quanto accade nel solvente puro (tale probabilità, inoltre, è tanto minore quanto maggiore è la quantità di soluto disciolto nella soluzione).
Abbassamento della tensione di vapore
In una soluzione la tensione di vapore del solvente viene diminuita dalla presenza di un soluto e tale abbassamento è proporzionale alla concentrazione di soluto espressa come frazione molare (legge di Raoult):

dove ΔP è l’abbassamento della tensione di vapore, Xsoluto, è la frazione molare del soluto e Po è la tensione di vapore del solvente puro.
L’aumento della temperatura di ebollizione di una soluzione rispetto al solvente puro, o innalzamento ebullioscopico, è una conseguenza dell’abbassamento della tensione di vapore della soluzione. L’innalzamento del punto di ebollizione è proporzionale alla molalità della soluzione:

dove ΔTeb è l’innalzamento ebullioscopico Keb è una costante detta costante ebullioscopica e m è la concentrazione molale della soluzione (nel caso dell’acqua tale costante vale 0,52, per cui ogni soluto presente nella concentrazione di 1 mol per 1000 g di acqua provoca un innalzamento di 0,52 °C del punto di ebollizione).
Pertanto nel caso in esame si ha:
essendo 
pertanto Xsoluto = ΔP/P Xsoluto = 3168 Pa – 3062 Pa/ 3168 = 106 / 3168 = 0,03346
ma la frazione molare = moli soluto/molisoluto+moli solvente
quindi 0,03346 = moli soluto/ moli soluto + ,moli solvente
0,03346 x (moli soluto + moli solvente ) = moli soluto
le moli di solvente sono 150/18 =8,3 pertanto indicando con S le moli di soluto si può scrivere:
0,03346 (S + 8,3 ) = S
S-0,03346 S = 0,277 0,967 S=0,277
da cui S= 0,287 = moli di soluto ma le moli di soluto sono date da
moli soluto = grammi soluto / Peso molecolare
quindi
0,287 = 54 /PM da cui PM=54 / 0,287 = 188,1
risposta corretta D
37. Comprimendo un certo gas a temperatura costante, si osserva la transizione diretta alla fase solida. Ciò vuol dire che la temperatura è:
A) minore di quella di evaporazione
B) minore di quella del punto triplo
C) maggiore di quella del punto triplo
D) maggiore di quella del punto critico
soluzione
Il punto triplo è un particolare stato termodinamico determinato dai valori di temperatura e pressione in cui coesistono, in condizioni di equilibrio, tre fasi di aggregazione di una sostanza. Il grafico seguente mostra il grafico T,P in cui sono mostrate le linee che sono l’insieme di punti in cui due fasi sono in equilibrio. Il punto triplo è l’unico punto in cui sono in equilibrio tre fasi:

come si può vedere dal grafico il passaggio dallo stato gassoso a quello solido è rappresentato dalla linea che sta al di sotto del punto critico quindi la temperatura, se costante, deve essere necessariamente più bassa della temperatura critica (la temperatura Tc al punto triplo indicata nel grafico).
risposta corretta B
38. Considerando il seguente schema di reazioni in serie:
A-Ka—>I —K1—> P
Assumendo che all ’inizio sia presente il solo reagente A, come varia la concentrazione di P con il trascorrere del tempo?
A) [P] = [A]o (1- exp(-kAt))
B) [P] = [A]o exp(-kt) dove k = kA + kI
C) [P] = [A]o (1- exp(-kt)) dove k = kA ∙ kI
D) [P] = [A]o (1- exp(-kt)) dove k = kA + kI
soluzione
Questo quesito è stato annullato, ma noi ci proviamo.
Si tratta di una reazione che consiste di due stadi monomolecolari consecutivi.
La velocità di reazione di A segue la cinetica [A]=[A]0exp(-k1 t)
Sostituendo questa espressione nell’eq. d[I]/dt= ka[A] ki – [I] con la condizione che [I]0 sia 0 la soluzione dell’ equazione differenziale ottenuta è:
[I] = [A]0 ka= exp( -t)k exp( t)k/ Ki -Ka
in quanto la prima reazione porta ad un aumento di [I] mentre la seconda reazione ad una sua diminuzione
La velocità con cui si forma C si può ricavare dalla condizione che in ogni istante della reazione:
[A]0=[A]+[I]+[P]
[P] =[A]0 ( 1+ – ka exp(- kat)k x – Kiexp -kit/ ki -ka )
risposta corretta D
39. La decomposizione di N2O5 è un importante processo chimico che avviene nella troposfera. Esso avviene seguendo una cinetica del primo ordine con un tempo di dimezzamento di 2,05 ∙104 s. Quanto tempo è richiesto per ridurre la concentrazione di N2O5 in un certo campione al 60% del suo valore iniziale?
A) 4 h e 12 min
B) 1500 s
C) 312 min
D) 120 min
soluzione
sappiamo che per una reazione del primo ordine si ha :
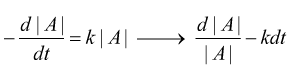
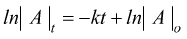
il tempo di dimezzamento t1/2 è il tempo necessario perché la concentrazione iniziale di un reagente sia ridotta a metà.
t½ = ln2 /k calcoliamo il valore di k che è k= ln2 /t½ k=0,693 / 2,05 x 104 =3,38 x 10-5
noto il valore di k sapendo che 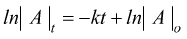 [A]t= 60 [A]0 = 100 k= 3,38 x 10-5 avremo
[A]t= 60 [A]0 = 100 k= 3,38 x 10-5 avremo
ln 60 = -3,38 x 10-5 t + ln 100 4,0 =- 3,4 x 10-5 t + 4,6 t = 4,6 – 4,1 /3,4 x 10-5 = 0,50 / 3,4 x 10-5
t = 14832 sec = 4,12 ore cioè 4 ore e 12 minuti
Risposta corretta A
40. Calcolare quanto calore bisogna fornire a un blocco di ghiaccio di 10 kg, inizialmente a -10 °C, per produrre acqua a 60 °C. La capacità termica specifica del ghiaccio è di 2,260 J K‒1 g‒1 , quella dell’acqua è di 4,184 J K‒1 g‒1, il calore di fusione del ghiaccio è di 335,2 kJ kg‒1.
A) 6,09 ∙106J
B) 8,13 ∙106 J
C) 9,09 ∙106J
D) 5,75 ∙106 kJ
soluzione
Sappiamo che la quantità di calore da fornire ad una sostanza con calore specifico c ed avente una concentrazione molale m è dato da Q= m c T2-T1. Nel caso del ghiaccio, quando si fornisce calore, le molecole del solido iniziano a vibrare sino a che i legami si allentano tanto che passano dallo stato solido a quello liquido

Quando il ghiaccio inizia a fondere l’energia fornita sotto forma di calore viene utilizzata per aumentare l’energia delle molecole, cioè la sua temperatura (tratto in salita nel grafico) sino a che il ghiaccio inizia a fondere(punto B del grafico).A questo punto il calore fornito viene utilizzato dalle molecole per allentare i legami ed inizia a fondere. Finchè non finisce di fondere, la Temperatura rimane costante, ed il calore fornito non è altro che il calore latente di fusione (riferito ad 1 Kg di sostanza).
Se si cede ulteriore energia (calore) al liquido si osserva che essa serve per aumentarne l’energia interna e la temperatura ricomincia ad aumentare. Quando però il liquido inizia ad evaporare, la Temperatura rimane costante in quanto serve per far passare le molecole allo stato di vapore. Il calore fornito è quindi il calore latente di evaporazione. Quando non vi è passaggio di fase si ha : Q= mc Δt se vi è passaggio di fase Q= λf m T2-T1
I passaggi da considerare per calcolare la quantità di calore da fornire sono:
• riscaldamento del ghiaccio da -10°C alla temperatura di fusione (0°C);
• passaggio di stato a 0°C;
• riscaldamento della massa d’acqua derivante dal ghiaccio fuso da 0°C a +60°C
Pertanto la quantità di calore totale da fornire al ghiaccio è pari a:
Qtot = Q1 + Qf + Q2
calcoliamo Q1 cioè il calore da fornire al ghiaccio per portarlo a 0°C:
Q1 = m · cg · ΔT1
Il calore da fornire per far avvenire il passaggio di stato è invece:
Qf = m · Δf
mentre la quantità di calore per riscaldare l’acqua è:
Q2 = m · c · ΔT2
Pertanto:
Qtot = Q1 + Qf + Q2 = m · cg · ΔT1 + m · Δf + m · c · ΔT2 = m · (cg · ΔT1 + Δf + c · ΔT2)
in cui
m = 10 Kg
cg = 2260 J/Kg
Δf = 335,2 KJ/Kg
ΔT1 = 0 – (-10) = + 10 °C
ΔT2 = 60 – 0 = + 60 °C
c = 4186 J/(Kg ·°C)
Sostituendo avremo:
Qtot = m · (cg · ΔT1 + Δf + c · ΔT2) = 10 · (2260 · 10 + 335200 + 4186 · 60) = 6089600 J
Qtot = = 6,09 · 106 J
In conclusione occorre un calore pari a 6,09 ·106 J per poter fondere completamente il ghiaccio e riscaldare l’acqua derivante dal ghiaccio fuso fino alla temperatura di 60°C.
risposta corretta A
41. A 400 K i composti A e B hanno una tensione di vapore di 25,6 kPa e 21,3 kPa, rispettivamente. Calcolare la composizione di una miscela ideale di A e B, a 400 K, sapendo che la tensione di vapore della miscela è di 23,6 kPa.
A) xA = 0,43; xB = 0,57
B) xA = 0,54; xB = 0,46
C) xA = 0,61; xB = 0,39
D) xA = 0,72; xB = 0,28
soluzione
sappiamo per la legge di Raoult che:
PA = P°A XA e PB = P°B XB
pTOT = pA + pB = χA p0A + χB p0B
23,6 = 25,6 Xa + 21,3 Xb
sapendo che Xa = 1-Xb sostituendo avremo
23,6 = 25,6 (1-Xb) + 21,3 Xb
23,6 = 25,6 -25,6 Xb + 21,3 Xb
23,6 = 25,6 – 4,3 Xb
4,3 Xb = 25,6 – 23,6 Xb= 2/ 4,3 Xb=0,46 Xa= 1- 0,46 =0,54
Xa= 54% Xb= 46%
risposta corretta B
42. Due gas ideali vengono mescolati a temperatura e pressione costanti. Cosa si può prevedere riguardo alla variazione delle proprietà termodinamiche del sistema a seguito del mescolamento?
A) ∆G < 0; ∆H = 0; ∆S > 0
B) ∆G > 0; ∆H > 0; ∆S = 0
C) ∆G > 0; ∆H = 0; ∆S > 0
D) ∆G < 0; ∆H < 0; ∆S = 0
soluzione
In condizioni di temperatura e pressione costanti, i sistemi tendono a trasformarsi spontaneamente verso gli stati di minima energia.Lo stato iniziale è composto dai due gas separati in un recipiente e la temperatura è tenuta costante. Quando i due gas si mescolano, la pressione totale all’interno del recipiente è la stessa per gli stati iniziale e finale, ma la pressione dei singoli gas è cambiata. Infatti ciascun gas occupa nello stato finale un volume superiore a quello che occupava nello stato iniziale. Poiché sappiamo che questo è un processo spontaneo, dovremo verificare che l’energia libera diminuisce nel processo di mescolamento.
Nello stato iniziale e nello stato mescolato la pressione di ciascun gas non è uguale alla pressione totale ma soddisfa l’equazione di Dalton PA=Xa P PB= Xb P dove Xa ed Xb sono le frazioni molari.
L’energia libera di mescolamento (definita come una quantità estensiva) è:
Δ Gmiscela = na RTlnA x nb RT lnB
Cioè ΔG= G2-G1
che risulta certamente negativa, dato che il valore della funzione logaritmo è negativo se l’argomento è inferiore all’unità, come nel caso delle frazioni molari. ΔmixG è strettamente correlata all’entropia di mescolamento ricordando la dipendenza dell’entropia dal volume, si ricava che l’entropia di mescolamento è positiva.
Inoltre sappiamo che Δ Gmiscela= ΔHmiscela – T Δ Smiscela
Si ottiene che l’entalpia di mescolamento di gas ideali è nulla cioè ΔHmiscela =0
Da quanto esposto si ha che
ΔGmiscela <0
ΔHmiscela =0
ΔSmiscela >0
risposta corretta A
43. Alla pressione di 100 kPa, il composto A si dissocia secondo la reazione:
A(g) ⇆ B(g) + C(g)
con una variazione di entalpia di 100 kJ mol‒1 . Alla temperatura di 590 °C il grado di dissociazione è 80%.
A quale temperatura (circa) il grado di dissociazione è 91%? La variazione di entalpia può essere considerata indipendente dalla temperatura.
A) 350 °C
B) 450 °C
C) 550 °C
D) 650 °C
soluzione
A(g) ⇆ B(g) + C(g)
1-α α α moli totali = 1-α + α + α= 1+ α
Keq= α2 /( 1+ α )2 / 1-α / 1+ α
K1= 0,64 / (1,8 )2 / 0,2 / 1,8 = 0,64 /3,24 / 0,1 =1,97
K2=0,828 / 3,65 / 0,09 / 1,91 = 0,227 /0,0471 =4,8
sapendo che ln(K2/K1) = (ΔH°/R)×(1/T1 – 1/T2)
ln(K2/K1) =( ΔH°/R) (T2-T1) /T1T2 ln(K2/K1) x R = ΔH°x (T2-T1/ T2xT1)
trasformando ΔH da KJ in J e sostituendo i valori si ottiene 0,9 x 8,314 = 100000 (X-863/ 863X)
7,5 /100000 = (X-863/ 863X)
7,5 x 10-5 = (X-863/ 863X)
X-863= 7,5 x 10-5 x 863X
X- 863 =0,065 X
(1-0,065 ) X = 863
X= 863 / 0,935 = 923 K quindi T2 = 923-273=650°C
risposta corretta D
44. Definire le relazioni stereochimiche tra le seguenti coppie di strutture

A) 1: enantiomeri; 2: diastereoisomeri; 3: equivalenti
B) 1: equivalenti; 2: enantiomeri; 3: diastereoisomeri
C) 1: diastereoisomeri; 2 e 3: enantiomeri
D) 1: diastereoisomeri; 2: enantiomeri; 3: equivalenti
soluzione
Con il termine stereoisomeri si intendono composti i cui atomi sono legati tra loro nello stesso modo, ma differiscono per la loro disposizione spaziale. Si possono distinguere due tipi di stereoisomeria:
- enantiomeria (chiamata anche, in maniera erronea, isomeria ottica).
- diastereoisomeria (o isomeria geometrica).
sono diastereoisomeri due stereoisomeri che non sono l’uno l’immagine speculare dell’altro oppure che non sono enantiomeri. Gli enantiomeri sono stereoisomeri le cui molecole sono l’una l’immagine speculare e non sovrapponibile dell’altra. Un esempio di enantiomeri sono le mani

alla presenza di almeno un centro chirale o stereocentro costituito, ad esempio, da un atomo di C legato a quattro sostituenti diversi e indicato con C*.(Lo stereocentro può anche essere un atomo di N o di P legato a tre sostituenti differenti).
Le molecole chirali sono caratterizzate da assenza di elementi di simmetria (asimmetria) o dalla presenza dei soli assi di rotazione semplice.Una sostanza è otticamente attiva o chirale quando, posta in soluzione e attraversata da luce polarizzata piana, è in grado di ruotare di un certo angolo la luce che la colpisce.
La coppia 1 non possiede atomi chirali e le molecole differiscono solo per la disposizione spaziale dei costituenti.Infatti sono rispettivamente 1,2,3 triclorocicloesano e 2,3,4 triclorocicloesano pertanto sono diastereoisomeri.
le coppie 2 e 3 invece sono immagini speculari l’una dell’altra e possiedono centri chirali quindi sono enantiomeri.
Si deduce che la risposta corretta è C
45- Un idrocarburo reagisce con due equivalenti di H2 per idrogenazione catalitica. Lo stesso composto produce solo butandiale per ozonolisi in condizioni riducenti. Individuare l’idrocarburo.

A) 1
B) 2
C) 3
D) 4
soluzione
L’ozonolisi è una reazione organica in cui l’ozono agisce da ossidante nei confronti di un un alchene ed il prodotto sarà , a seconda della struttura dell’alchene di partenza, un’aldeide o un chetone.Il meccanismo di reazione è:

Nel caso in esame la molecola 4 cioè il ciclobutene è da escludere perchè può reagire solo con un equivalente di H2.
La molecola 2 è da escludere anche perchè l’ozonolisi darebbe come prodotto solo il Butanale (con un solo gruppo CHO).
La molecola 3 è la molecola che richiede due equivalenti di H2 e l’ozonolisi produce la molecola di Butandiale (con due gruppi CHO) OHC-CH2-CH2-CHO
risposta corretta C
46. Perché la reazione di sostituzione nucleofila aromatica del p-bromotoluene con NaOH a 300 °C produce una miscela di para e meta-metilfenolo?

A) il meccanismo prevede la formazione di un intermedio carbocationico bidentato
B) il meccanismo prevede la formazione di un intermedio reattivo con triplo legame
C) il meccanismo prevede una trasposizione del bromo al carbonio adiacente
D) l’alta temperatura genera un equilibrio di isomerizzazione del p-metilfenolo formato
soluzione
sostituenti elettrofili sul benzene sono in grado di orientare le successive sostituzioni per gli effetti induttivo e di risonanza.Si distinguono quindi in:
- Gruppi attivanti: in genere sono sostituenti che hanno almeno un doppietto elettronico libero e che si comportano da elettron-donatori, questa caratteristica fa sì che la nube elettronica della molecola sia spostata verso l’anello benzenico per motivi di risonanza, conferendogli una parziale carica negativa. La presenza della carica parziale “attiva” la reazione di sostituzione in quanto i sostituenti elettrofili si legheranno più facilmente sull’anello benzenico.
- Gruppi disattivanti: sono tendenzialmente gruppi elettron-attrattori in grado di spostare la nube elettronica sul sostituente stesso sottraendola all’anello aromatico per effetto induttivo, si ha quindi una parziale carica positiva sul benzene che “disattiva” la sostituzione elettrofila.
Gruppi attivanti Gruppi disattivanti:
Forti-NH2, -NHR, -NR2, -OH -NO2, –NR3+
Medi-OR, –NHCOR -C≡N, – CHO, -COR, -COOH
Deboli-R, -fenile (Ph) -F, -Cl, -Br, -I
Gli effetti induttivi e di risonanza dei sostituenti non solo sono in grado di “polarizzare” la molecola interagendo con gli elettroni del benzene, ma sotto l’azione di tali effetti possono determinare l’orientamento di una seconda sostituzione elettrofila in posizione orto, meta o para. In questo caso i gruppi si distinguono in Orto, para-orientanti e Meta-orientanti .
Orto, para-orientanti Meta-orientanti
Forti -NH2, -NHR, -NR2, -OH -NO2, –NH3+, –NR3+
Medi -OR, –NHCOCH3 -C≡N, –SO3H
Deboli -R, -Ph, -F, -Cl, -Br, -I -CHO, -COR, -COOR, – COOH
I gruppi attivanti orto, para-orientanti si comportano da elettron-donatori mettendo a disposizione un doppietto elettronico libero per formare un doppio legame con l’anello aromatico. Per effetto di risonanza il legame tra gruppo attivante e benzene avrà caratteristiche intermedie tra un legame semplice e un legame doppio. In questo modo il gruppo attivante acquisterà una parziale carica positiva, mentre l’anello benzenico acquisterà una parziale carica negativa che tende a stabilizzare con diverse forme di risonanza.

Composti orto, para-orientanti:
- Fenolo
- Anilina
- toluene
- Etilbenzene
I gruppi disattivanti meta-orientanti si comportano invece da elettron-attrattori, non tanto per l’elevata elettronegatività del sostituente ma più per l’effetto induttivo tra gli atomi che compongono il gruppo disattivante, che in genere si traduce in una parziale carica positiva sull’atomo direttamente legato all’anello aromatico al quale sottrae elettroni per stabilizzarsi. Anche in questo caso si avrà un legame tra benzene e gruppo disattivante intermedio tra un legame doppio e un legame semplice, con la differenza che il doppietto è stato sottratto all’anello benzenico che dovrà stabilizzare la parziale carica positiva così acquisita con diverse forme di risonanza. Si osserva qui che la carica è dislocata sui carboni orto e para. La parziale carica positiva diminuisce la reattività per una seconda sostituzione elettrofila sul benzene che avverrà molto più lentamente e con maggiore probabilità in posizione meta (dove vi è minore densità di carica positiva).

da quanto abbiamo detto, il metile del toluene deve orientare il secondo sostituente in para mentre il Bromo lo orienta in meta. Il meccanismo riportato sotto per il Cloro-Toluene è identico a quello del Bromo toluene
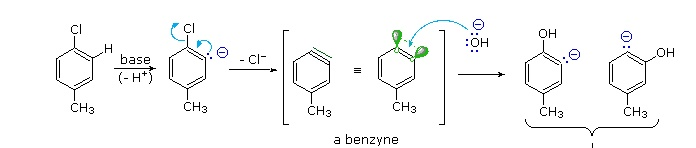
OH- attacca l’H in orto al bromo lasciando i due elettroni disponibili per il benzene e si forma il Benzino (triplo legame) immediatamente attaccato dall’OH- l’apertura del legame può avvenire sia in posizione para rispetto a CH3 che il posizione meta e si ottiene una miscela equimolecolare dei due composti.La spiegazione di questo curioso riposizionamento del gruppo sostituente risiede in un diverso meccanismo in due fasi a cui possiamo fare riferimento come processo in aggiunta all’ eliminazione. L’intermedio in questo meccanismo è una specie di benzino instabile.Contrariamente alla sovrapposizione parallela degli orbitali p in un triplo legame stabile alchilenico, gli orbitali p di un benzino sono inclinati di ca.120º, quindi la reattività di questo triplo legame incipiente nelle reazioni di addizione è notevolmente migliorata. In assenza di impedimento sterico si ottengono uguali quantità di meta- e para-cresoli.
Naturalmente la risposta corretta è B
47. Quale agente riducente deve essere usato per fare avvenire la seguente reazione?

- A) NaBH4
- B) H2, nickel Raney
- C) Ag2O, NH3
- D) Na, NH3 (l)
soluzione
Non può essere il Nikel Raney con H2 perchè si idrogenerebbe il doppio legame dell’alchene.
Ag2O, NH3 (reattivo di tollens usato per il riconoscimento degli zuccheri) non può essere usato perchè il prodotto finale è un acido R–CHO + 2[Ag(NH3)2]+ + 3OH– → RCOO– + 2Ag↓+ 4NH3 + 2H2O
Na,NH3 viene invece usato per la riduzione degli alchini ad alcheni e quindi agisce sui legami pi greco pertanto non si può adoperare nel caso in esame.
NaBH4 è il reattivo di elezione,infatti NaBH4 è un riducente piuttosto blando che viene usato in solvente alcolico o acquoso. Può ridurre solo aldeidi, chetoni e cloruri acilici (i derivati più reattivi degli acidi), mentre non riduce gli acidi carbossilici e gli altri derivati né i doppi legami di alcheni e alchini. Permette quindi di ridurre in modo selettivo il gruppo carbonilico di aldeidi e chetoni in molecole che possiedono anche altri gruppi funzionali.
Risposta corretta A
48. Quale delle seguenti affermazioni spiega perchè il pirrolo in condizioni acide viene protonato sul C-2 piuttosto che sull’azoto?

A) la protonazione dell’azoto è stericamente impedita
B) la presenza di un idrogeno sull’azoto ne impedisce la protonazione
C) l’ibridazione sp2 dell’azoto rende il doppietto elettronico poco disponibile
D) lo ione che si forma è stabilizzato dalla risonanza
soluzione
Il doppietto solitario dell’azoto nel pirrolo (detto anche Azolo) viene delocalizzato nel ciclo della molecola formando pertanto un sistema aromatico (con 6 elettroni π delocalizzati). Nel furano e nel tiofene la carica negativa è localizzata sull’ossigeno e sullo zolfo mentre il pirrolo presenta una carica positiva localizzata sull’azoto . Questo è dovuto alle diverse formule di risonanza in cui la carica negativa compare su tutti e quattro gli atomi di carbonio mentre sull’atomo di azoto compare solo la carica positiva.
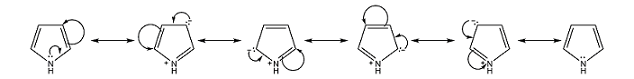
Il pirrolo in presenza di H’ viene protonato ma per effetto della risonanza sono gli atomi di carbonio e non l’azoto a protonarsi, ed essendo il carbonio in posizione 2 il catione termodinamicamente più stabile la protonazione avviene proprio in posizione 2.
risposta corretta D
49. La metilazione esauriente seguita da idrolisi acida di un campione di destrano, un polisaccaride ramificato, fornisce:
2,3,4,6-tetra-O-metil-D-glucosio,
2,3,4-tri-O-metil-D-glucosio,
2,4,6-tri-O-metil-D-glucosio
2,4-di-O-metil-D-glucosio.
Quali legami glicosidici uniscono le unità di glucosio tra loro nel destrano?
A) 1-3 e 1-6
B) 2-3 e 2-6
C) 1-5 e 1-6
D) 1-4 e 1-5
soluzione
I destrani sono polimeri ramificati del glucosio con peso molecolare variabile prodotti dai lattobacilli (o altri batteri fermentanti, a partire dal saccarosio grazie alla presenza dell’enzima destransaccarasi. Il destrano è caratterizzato da una successione di molecole di D-glucosio legate tra loro mediante un legame glicosidico alfa 1-6 con brevi ramificazioni nelle posizioni alfa 1-2, 1-3 e 1-4
La struttura del destrano è :

Il legame glicosidico si ha per sostituzione dell’OH anomerico con un altro gruppo.E’ chiaro che il legame glicosidico è alfa 1-6 spesso con ramificazioni alfa 1,3.
Risposta corretta A
50. Sia il ditiotreitolo e che il 2-mercaptoetanolo (HSCH2CH2OH) riducono i ponti disolfuro, ma l’equilibrio della reazione del ditiotreitolo, mostrato qui sotto, è spostato molto più a destra. Perché?

A) i due gruppi ossidrilici del ditiotreitolo favoriscono la reazione di riduzione
B) il 2-mercaptoetanolo è meno solubile del ditiotreitolo nelle condizioni di reazione
C) si forma un composto ciclico a sei termini, particolarmente stabile
D) si forma un composto achirale
soluzione
i ponti disolfuro vengono generalmente ridotti con DTT (ditiotreitolo) o con il 2 mercaptoetanolo e la reazione risulta reversibile. L’equilibrio è spostato a destra perchè il prodotto di reazione è termodinamicamente più stabile in quanto si forma un anello a sei atomi .
Risposta corretta C
51. Quale idrocarburo di formula C5H12 genera solo 4 prodotti di monoclorurazione, di cui due chirali e due achirali?
A) 2-metilbutano
B) 2,2-dimetilpropano
C) pentano
D) metilciclobutano
soluzione
il composto C5H12 è un idrocarburo saturo a 5 atomi di C quindi si tratta di un pentano.

Il 2,2 dimetil propano darebbe solo un prodotto clorurato visto che ha la seguente struttura

il n-pentano ha la struttura seguente : CH3-CH2-CH2-CH2-CH3
Nella clorurazione radicalica del pentano l’alogeno non si lega a caso ma al radicale più stabile che si forma dal processo e che fornisce il prodotto maggiore.Nella molecola di pentano si possono formare al massimo radicali secondari (da 3 atomi di C secondari) e 2 primari (dai rispettivi C primari) quindi saranno i secondari a portare al prodotto maggiore. Si otterrà una miscela di 1, 2 e 3 cloro pentano quindi solo 3 e non 4 prodotti come ci dice il testo del problema.Il prodotto maggiore sarà il 2-cloro pentano perchè ha due atomi di C che portano a questo prodotto, segue il 3-cloro pentano quindi il cloro pentano.
Il metil ciclobutano

non può fornire 4 prodotti di cui due chirali e 2 achirali.
Come si può vedere la risposta corretta è A
52. Indicare il prodotto finale della seguente serie di reazioni:

A) 1
B) 2
C) 3
D) 4
soluzione
la prima reazione è una reazione di Grignard:

la seconda reazione porta alla formazione di :

che per esterificazione porta al composto B

Risposta corretta B
53. Gli idrogeni metilici delle 2- e 4-metil-piridine hanno un’acidità insolitamente alta (10‒35 < Ka < 10‒32).
Individuare la spiegazione più corretta. Le rispettive basi coniugate sono stabilizzate…
A) dalla formazione di dimeri ciclici
B) da effetti elettronici induttivi e di risonanza
C) da effetti elettronici induttivi
D) da effetti sterici
soluzione
la 4-metil piridina ha la seguente struttura ed uno ione piridinio con un PKa= 5,98 che rispetto alla piridina è 0,7 % in più
la 2-metilpiridina ha la formula seguente con lo ione piridinio con Pka=5,96
![]()
come è noto il metile determina un effetto induttivo sull’anello piridinico e la densità elettronica sull’anello aumenta determinando una maggior risonanza. Quindi possiamo dire che la differenza di acidità degli atomi di H del metile dipende esclusivamente dall’effetto induttivo e dalla conseguente risonanza.
Risposta corretta B
54. La 3-bromoacetanilide si prepara dal benzene tramite quattro reazioni le cui condizioni sono riportate sotto. In quale sequenza vanno applicate le reazioni?

A) e, b, a, d
B) a, e, b, d
C) e, b, d, a
D) e, a, b, d
soluzione
la prima reazione è la nitrazione del benzene con formazione del Nitrobenzene

questo viene sottoposto a reazione con reattivo di Grignard con formazione del Bromo nitrobenzene

questo viene ridotto sul nitrogruppo con Fe ed HCl con formazione del gruppo amminico NH2
L’ultima reazione è l’acetilazione del gruppo amminico
pertanto la risposta corretta è D
55. Quale delle seguenti molecole mostra 5 segnali nello spettro 13CNMR (disaccoppiato dal protone)?

A) 1
B) 2
C) 3
D) 4
soluzione
Invitiamo a leggere l’argomento NMR su Pianetachimica.com a cura del prof.Tonellato che affronta l’argomento in modo esauriente.
Osserviamo adesso le molecole seguenti:

possiamo vedere che la prima molecola dovrebbe dare 4 segnali NMR la seconda 5 segnali, la terza 3 segnali e la quarta 6 segnali.
Nel caso del quesito, la molecola 1 dovrebbe dare 6 segnali in quanto rispetto alla molecola 2 della foto sopra vi sono anche i 2 atomi di C dei CH3 .
La molecola n.2 del quesito è simile alla molecola 3 della foto e dovrebbe fornire 4 segnali 3 + il segnale del C dei due CH3
La molecola 3 è simile alla molecola 4 della foto e dovrebbe fornire 6 segnali NMR
La molecola n.4 del quesito (simile alla n.1 della foto) è l’unica che può fornire 5 segnali di cui 4 dovuti al C dell’anello e 2 dovuti sia ai due atomi di C del CO (1 segnale ) ed al C dei due CH3 (1 segnale).
Si evince che la risposta corretta è D
56. Individua quali dei seguenti composti puri (o miscele) ha attività ottica diversa da zero:
a) (S,S)-2,3-butandiolo;
b) composto meso;
e) miscela 1:1 di L e D-glucosio;
d) miscela 2:1 di isopropanolo e 3-pentanolo;
e) miscela 1:1 di α-D-galattosio e β-D-galattosio.
A) a, b
B) c, d
C) a, e
D) a, d
soluzione
il primo dei composti

Ha 2 centri asimmetrici quindi è otticamente attivo per cui si può scrivere (2S,3S)-(+)-2,3-Butandiol
I composti meso non hanno attività ottica: per esempio, il composto acido tartarico ha una forma meso

anche se contiene più centri di asimmetria , nel suo complesso, a causa dell’esistenza di un piano di simmetria interno, risulta otticamente inattivo infatti . Il piano di simmetria divide la molecola orizzontalmente, facendola essere speculare.
Il glucosio, noto anche con il nome di destrosio, è un monosaccaride a sei atomi di carbonio

Poichè vi sono centri di asimmetria ambedue i composti sono otticamente attivi.D si riferisce alla posizione destro del gruppo OH vicino al CH2OH e L alla posizione Levo del gruppo OH da non confondere con + è – che invece si riferiscono all’attività ottica.
I composti
 e
e 
non possiedono carbonio asimmetrico per cui sono otticamente inattivi.

I due composti sono otticamente attivi ma trattandosi di una miscela in rapporto 1:1 , nell’insieme non sono attivi perchè le attività si annullano.
Da quanto espresso vediamo che la risposta esatta è C
57. Cosa si intende per reazioni stereoselettive?
A) reazioni che, partendo da un determinato stereoisomero del reagente, formano uno specifico stereoisomero del prodotto
B) reazioni che portano alla formazione preferenziale di uno stereoisomero rispetto a quelli che si potrebbero formare
C) reazioni che portano alla formazione del prodotto con minore ingombro sterico
D) reazioni che portano alla formazione di uno specifico isomero costituzionale
soluzione
secondo la IUPAC la stereoselettività in una reazione chimica è la formazione preferenziale di uno stereoisomero su un altro. Quando gli stereoisomeri sono enantiomeri, il fenomeno si chiama enantioselettività ed è espresso quantitativamente dall’eccesso di enantiomero; quando sono diastereoisomeri, si chiama diastereoselettività ed è espressa quantitativamente dall’eccesso di diastereoisomero » come per esempio l’idrogenazione catalitica degli alchini che porta ad un prodotto Cis.
È importante non confondere la stereoselettività con la stereospecificità , che si basa invece sull’uso di un particolare stereoisomero come composto di partenza in modo da poter controllare il prodotto finale della reazione che corrisponde alla risposta A del quesito.
Le risposte C e D sono errate per cui dalla definizione IUPAC si evince che la risposta corretta è B
58. Per quale motivo il diene riportato sotto non subisce la reazione di Diels-Alder?

A) per l’assenza di gruppi elettrondonatori sul diene
B) perché il diene non riesce a disporsi in conformazione s-cis
C) perché il diene è ciclico
D) perché il diene non è coniugato
soluzione
Le reazioni di Diels-Alder sono concertate, stereospecifiche e seguono la regola dell'endo.
La reazione di Diels-Alder è una reazione concertata, ciò significa che si verifica in un
solo passaggio. Inoltre, tutti gli atomi che partecipano alla forma di reazione si legano
contemporaneamente.
In secondo luogo, le reazioni di Diels-Alder sono stereospecifiche, il che significa che i sostituenti attaccati sia al diene che al dienofilo mantengono la loro stereochimica per tutta la reazione. Ad esempio, se i gruppi funzionali sul dienofilo si scambiano tra loro nei reagenti, essi dovrebbe rimanere trans . (vedi figura)
 In terzo luogo, le reazioni di Diels-Alder sono governate dall'endorule. Ciò significa che ogni volta che si forma un anello a ponte, i sostituenti legati al dienofilo sono o trans o cis sul ponte. Cosa succede se ci sono più di due
gruppi attaccati al dienofilo? Bene, due di loro indicheranno il lato endo e gli altri due andranno verso il lato exo.
Come hanno sottolineato le convenzioni comuni, i gruppi funzionali uniti sul lato destro del dienofilo vanno
verso il lato endo (che significa lontano dal ponte) e i gruppi attaccati a sinistra del dienofilo puntano verso il lato
eso (cioè verso il ponte).
In terzo luogo, le reazioni di Diels-Alder sono governate dall'endorule. Ciò significa che ogni volta che si forma un anello a ponte, i sostituenti legati al dienofilo sono o trans o cis sul ponte. Cosa succede se ci sono più di due
gruppi attaccati al dienofilo? Bene, due di loro indicheranno il lato endo e gli altri due andranno verso il lato exo.
Come hanno sottolineato le convenzioni comuni, i gruppi funzionali uniti sul lato destro del dienofilo vanno
verso il lato endo (che significa lontano dal ponte) e i gruppi attaccati a sinistra del dienofilo puntano verso il lato
eso (cioè verso il ponte).
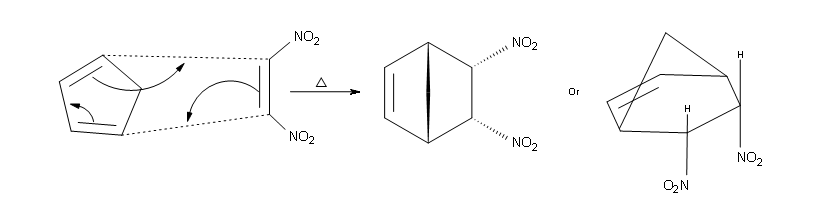
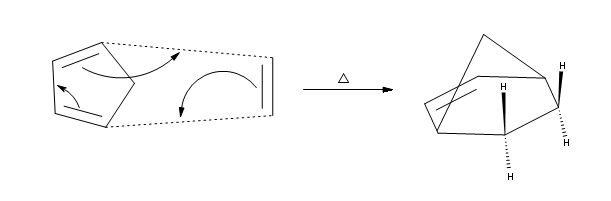
La seconda parte della regola è che i sostituenti sul lato sinistro del dienofilo sono considerati sul lato endo nel prodotto e che i sostituenti legati sul lato destro sono considerati exo. Ciò significa che i sostituenti endo puntano verso il basso e i sostituenti exo puntano verso l’alto nel prodotto finale. Di seguito è riportato un esempio
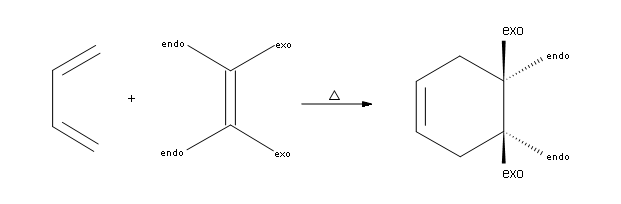
In coclusione, la rerazione di Diels Alder è una reazione stereospecifica per cui è fondamentale la disposizione spaziale del diene. Nel caso in esame la struttura è tale che il diene non può disporsi in posizione cis per cui la reazione risulta impossibile.
La risposta corretta è B
59. Individuare la spiegazione che giustifica la minore basicità delle ammidi (RCONH2) rispetto alle corrispondenti ammine (RNH2).
A) sull’azoto ammidico, al contrario di quello amminico, non è presente un doppietto elettronico
B) l’ossigeno carbonilico instaura legami idrogeno intermolecolari che diminuiscono la forza basica del
doppietto elettronico dell’azoto ammidico
C) l’effetto elettrondonatore del carbonile diminuisce la disponibilità del doppietto elettronico sull’azoto ammidico
D) l’effetto coniugativo del doppietto elettronico sull’azoto ammidico ne diminuisce la disponibilità verso gli acidi
soluzione
La coppia solitaria di elettroni sull’ammina in cui l’azoto usa orbitali ibridi Sp3 è più disponibile ad accettare un protone ed agire quindi da base. Nelle ammidi,invece, il gruppo carbonile (C = O) possiede un doppio legame in cui i due atomi C ed O sono ibridi SP2 e quindi tendono a coniugare il doppietto elettronico dell’azoto anch’esso ibrido SP2 , rendendolo meno disponibile ad accettare un protone.
La risposta corretta al quesito è D
60. La condensazione di Dieckmann (reazione di Claisen intramolecolare) dell’esandioato dimetilico genera un prodotto ciclico con formula molecolare C7H10O3: individuare la struttura di questo composto

A) 1
B) 2
C) 3
D) 4
soluzione

il meccanismo è il seguente:

I protoni in α rispetto ai carbonili del diestere (adiacenti) sono più acidi degli altri, dato che il carbonio cui sono legati presenta una parziale carica positiva (δ+) proprio in virtù della vicinanza al gruppo carbonilico (elettron attrattore). Per questa ragione appena trattiamo con una base abbastanza forte (nel nostro esempio etossido di sodio) uno di essi viene facilmente rimosso. Ne risulta un carbanione stabilizzato parzialmente per risonanza dalla sua forma enolica (esattamente come nella condenazione di Claisen).
Istantaneamente avviene la reazione di ciclizzazione (intramolecolare). In questo caso, si forma un ciclo stabilizzato a 5 termini infatti il carbanione va ad addizionarsi al carbonile dell’estere, con il legame π che si rompe ed i due elettroni che si localizzano sull’ossigeno.
La carica negativa può tornare indietro a formare il doppio legame con conseguente uscita di una molecola di alcossido. Normalmente gli alcossidi non sono buoni gruppi uscenti, ma in questo caso lo sono se paragonati all’alternativa, ovvero l’uscita di un carbanione. (N.B basicità → R– > RO–)
Formalmente la reazione è finita, ma dato che siamo in ambiente basico ed il composto ha un protone acido si troverà sotto forma di enolato. Per terminare la reazione ed ottenere il vero e proprio chetoestere è sufficiente trattare con acido.
Il composto chetoestere che si forma è pertanto il composto numero 3
Risposta corretta C


![{\displaystyle r=k\left[A\right]^{m}\left[B\right]^{n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/befb8544a8b6d648756d7e82a5fa70e0c66f305d)
![{\displaystyle {\frac {1}{\left[A\right]}}-{\frac {1}{\left[A\right]_{0}}}=\mathrm {k} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cea54114260d9db5864c04632cf83ff651df699)
![{\displaystyle \left({\frac {1}{N-1}}\right)\left({\frac {1}{\left[A\right]^{N-1}}}-{\frac {1}{\left[A\right]_{0}^{N-1}}}\right)=\mathrm {k} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9526a249b9d8ee5af8f5c700cde88d3a950b4e6e)
Lascia un commento