1. Secondo la teoria VSEPR la geometria della molecola PCl5 è:
A) trigonale planare
B) bipiramidale trigonale
C) a T
D) nessuna delle precedenti
soluzione
La teoria Valence Shell Electron Pair Repulsion proposta dal chimico americano Gillespie è utilizzata per valutare la geometria di una molecola semplicemente considerando che gli elettroni dei legami di una molecola tendono a disporsi il più lontano possibile a causa delle repulsioni reciproche. I doppietti elettronici non impegnati in legame( coppie solitarie o lone pair) si respingono con maggior forza rispetto a quelli impegnati nei legami. In generale viene usato il cosiddetto metodo AXE .
La sigla AXE rappresenta con la lettera A l’atomo centrale e ha sempre come valore sottinteso 1.
La X rappresenta il numero di legami sigma che si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli) contano come un X. Infine la E rappresenta il numero di coppie solitarie di elettroni (lone pair) presenti sull’atomo centrale. La somma di X ed E, definita come NUMERO STERICO , ed è associata anche al numero totale di orbitali ibridi.
![]() lineare
lineare


trigonale planare angolare



tetraedrica piramide trigonale Angolare

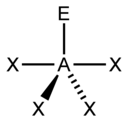


bipiramide trigonale altalena a forma di T lineare
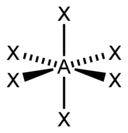


ottaedrica piramide a base quadrata planare quadrata
secondo questo metodo la molecola PCl5 non possiede un doppietto libero( E) quindi la sua struttura è del tipo 
quindi ha una struttura a forma di bipiramide trigonale
Risposta corretta B
2. Nella seguente reazione (da bilanciare):
NH3 (g) + O2 (g) → NO2 (g) + H2O (g)
indicare il rapporto tra i coefficienti stechiometrici di O2 e di H2O.
A) 7/3
B) 21/2
C) 7
D) 7/6
soluzione
dalla reazione si evince che l’azoto si ossida da -3 nell’ammoniaca a +4 nell’NO2 con un trasferimento elettronico di 7 elettroni
l’ ossigeno O° a sua volta acquista gli elettroni formando O-2 con acquisto di due elettroni per atomo quindi O2 acquista 4 e
4[N-3 + 2 H2O → NO2 + 7 e
7[O2 +4 e → 2 H2O
_____________________________
4N-3 +7O2 +8 H2O → 4 NO2 + 14 H2O
4NH3+ 7O2 ——-> 4NO2 + 6H2O
ne consegue che il rapporto coefficienti dell’O2 e dell’acqua è 7/6
risposta corretta D
3. Indicare gli orbitali ibridi utilizzati dallʼatomo di fosforo in [PCl6]
A) sp2d3
B) sp3d2
C) sp3d3
D) p3d3
soluzione
per spiegare la geometria molecolare de PCl6 come di altre molecole si può ipotizzare una combinazione degli orbitali SPd dell’atomo centrale ed esattamente SP3d2 che produce 6 orbitali ibridi di uguale energia.
il fosforo P ha la seguente struttura elettronica : 1s22s22p63s23p3 con orbitali 3d non occupati. Questa struttura tuttavia non giustifica la struttura ottagonale del PCl6 quindi dobbiamo ipotizzare che si possa fare una combinazione lineare di orbitali che diano origine a 6 orbitali ibridi uguali diretti secondo gli angoli di un ottaedro. Infatti
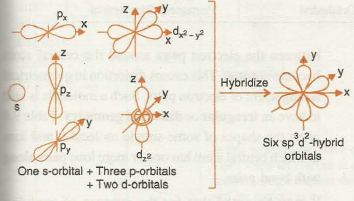
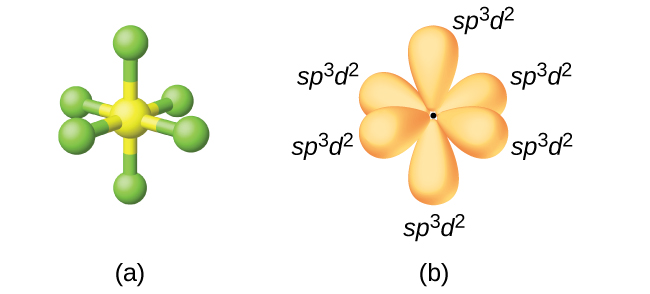
Il fosforo normale avrebbe 5 elettroni di valenza: due negli orbitali 3s e uno in ognuno dei tre orbitali 3p in PCl6 vi sono 6 elettroni.
risposta corretta B
4. Calcolare quanto fluoro è contenuto in 984 g di una miscela di cloruro di argento e di fluoruro di potassio al 36,24% in cloruro di argento.
A) 11,7 g
B) 116,6 g
C) 205,2 g
D) 80,5 g
soluzione
se la % di cloruro di Argento è 36,24 allora il fluoruro di potassio è 100-36,24 =63,76 %
pertanto la quantità di fluoruro è il 63,76% di 984 g cioè 0,6376 x 984 =627,39 g
se in KF vi è F in 627,39 ve ne sono X
58: 19 = 627,39 :X X= 627,39 x 19/ 58= 205,5 g
riposta corretta C
5. La costante di equilibrio della reazione
AgClO3 (s) → Ag+(aq) + ClO3-(aq)
è 1,65 ·10-3 a 30,0 °C. Calcolare la concentrazione di Ag+ in una soluzione acquosa satura di AgClO3 a 30,0 °C.
A) 0,00165 M
B) 0,0406 M
C) 1,65 M
D) nessuna delle precedenti
soluzione
AgClO3 (s) → Ag+(aq) + ClO3-(aq)
1 X X
X2 = KPs X= √1,65 ·10-3 = 0,0406 moli /l
risposta corretta B
6. Il carbonato di sodio in una soluzione acquosa di acido solforico reagisce secondo la reazione:
H2SO4(aq) + Na2CO3(aq) Æ CO2(g) + H2O(l) + Na2SO4(aq)
Mettendo a reagire quantità stechiometriche di carbonato e di acido si sviluppano 44,8 mL di CO2 misurati a STP (T = 273,15 K, P = 101,3 kPa). Calcolare la massa di Na nel campione di Na2CO3 che si è trasformato.
A) 92,0 mg
B) 46,0 mg
C) 0,174 mg
D) 84,3 mg
soluzione
la quantità in grammi di CO2 ottenuta che corrisponde a 44,8 ml di gas è calcolata dall’equazione generale di stato dei gas
PV=g/PM RT
101300 Pa x 44,8 = g/44 8,314 x 273,15
g= 101300 x 44,8 x 44 / 8,314 x 273,15
g=199682560 /2270,9 =87,931
se da Na2CO3 :CO2 = X: 87,93
106:44 = X:87,93
X= 211,8 g di Na2CO3
se Na2CO3 : 2 Na = 211,8 :X X= 211,8 x 2 x 22,98 /106
X= 91,8 g
risposta corretta A
7. Lʼanalisi elementare di una sostanza composta da mercurio, carbonio, azoto e ossigeno dà i seguenti risultati espressi come percentuale in peso:
C = 8,44%; N = 9,84%; O = 11,24%.
Determinare la formula bruta del composto.
A) HCNO
B) HgCNO
C) HgC2N2O2
D) HgC3N3O3
soluzione
La % di Hg è data da 100 -(8,44+9,84+ 11,24 )= 70,48
dividiamo la % per il peso atomico
C = 8,44%/ 12 N = 9,84%/14 O = 11,24%./16 Hg =70,48 /200,6
0,703 0,703 0,703 0,351
dividiamo per il numero più piccolo (0,351 ) ed otteniamo i rapporti minimi tra gli atomi che sono
Hg1 C2 N2 O2
risposta corretta C
8. Indicare il gruppo di coefficienti che bilancia la seguente reazione:
FeSO4 (s) + H2SO4 (aq) + HNO3 (aq) → Fe2(SO4)3 (aq) + NO (g) + H2O (l)
A) 4, 2, 3, 2, 2, 4
B) 6, 2, 3, 4, 4, 2
C) 4, 6, 2, 4, 1, 2
D) 6, 3, 2, 3, 2, 4
soluzione
la reazione è un’ossidoriduzione in ambiente acido per acido solforico, in cui NO3- si riduce ad NO ed Fe+2 si ossida a Fe+3
1[NO3- +4 H+ +3e → NO +2H2O
3[Fe+2 → Fe+3 +e
________________________________
NO3– + +3 Fe+2 + 4H+ → NO + 3Fe+3 +2H2O
siccome si forma Fe2 (SO4)3 occorre moltiplicare tutto per 2 e quindi
la reazione globale bilanciata è
6 FeSO4 (s) +3 H2SO4 (aq) + 2HNO3 (aq) → 3Fe2(SO4)3 (aq) + 2NO (g) + 4H2O (l)
i coefficienti sono 6-3-2-3-2-4
risposta corretta D
9. Lʼanidride solforica si ottiene dalla combustione di zolfo secondo la seguente reazione:
2 S (s) + 3 O2 (g) →2 SO3(g)
Determinare quanti grammi di anidride solforica si possono ottenere mettendo a reagire 50,0 g di zolfo e
1,00 kg di O2.
A) 62,4 g
B) 125g
C) 2500g
D) 1250g
soluzione
dalla reazione si evince che ogni 2 moli di Zolfo S sono necessari 3 moli di ossigeno cioè ogni 32 x 2 =64 g di S sono necessari 2x 32= 64 g di ossigeno quindi l’ossigeno messo a reagire è in eccesso.
Pertanto da 2S si ottengono 2 SO3 quindi da 50 g se ne otterranno X
64 : 80 =50 :X
X= 62,5 g
10. Uno pneumatico di una macchina da corsa viene gonfiato alla pressione di 3,03 kPa alla temperatura di 25 °C. Durante il gran premio, la temperatura nella camera dʼaria sale a 75 °C ed il volume aumenta del 10%. La variazione di pressione è di:
A) 0,89 kPa
B) 0,19 kPa
C) 0,50 kPa
D) -0,19 kPa
soluzione
P1V1/T1 = P2V2/T2 V1=100 V2 =110 P1= 3,03 P2= X T1 = 298 T2 = 348
3,03 x 100 / 298 = X x 110 / 348
P2 =X= 1,017 x 348 /110 =3,22 kPa
la differenza di pressione è 3,22-3,03 = 0,19 KPa
risposta corretta B
11. Indicare il gruppo di coefficienti, riportati in ordine casuale, che bilancia la seguente reazione di ossido-riduzione:
FeS (s) + KClO3 (aq) + HCl (aq) → FeCl3 (aq) + S (s) + KCl (aq) + H2O (l)
A) 1, 1, 2, 4, 5, 7, 8
B) 1, 1, 2, 3, 5, 5, 6
C) 1, 1, 2, 2, 3, 3, 6
D) 1, 1, 2, 2, 2, 3, 6
soluzione
il ferro (II) si ossida a ferro (III) mediante ClO3- (che è l’ossidante)assieme allo zolfo che si ossida anch’esso da S-2 ad S° in ambiente acido H+ per acido cloridrico. (le due semireazioni seguenti di ossidazione possono essere considerate una sola reazione e gli elettroni scambiati sono dati dalla somma degli elettroni delle due reazioni
6[Fe+2 → Fe+3 + e
6 [S-2 → S +2e
3[ClO3 – + 6H+ + 6e -→ Cl- + 3H2O
______________________________
2 Fe+2 + 2S-2 + ClO3- +6H+ → 2Fe+3 + 2S + cl- +3H2O
la reazione bilanciata è
2FeS (s) + KClO3 (aq) + 6HCl (aq) → 2 FeCl3 (aq) + 2 S (s) + KCl (aq) +3 H2O (l)
i coefficienti sono quindi 2,1,6,2,2,1,3
risposta corretta D
12. Calcolare il pH di una soluzione ottenuta aggiungendo 4,0 g di NaOH solido a 1 L di soluzione di HF 0,1 M.
A) 13,0
B) 9,8
C) 8,1
D) 7,5
soluzione
la concentrazione dell’ NaOH è data da 4 g / PM = 0,1 moli in 1 litro di HF
HF è un acido debole e poichè le concentrazioni sono uguali ed il volume è uguale, tutto HF viene trasformato in NaF cioè un sale che però subisce idrolisi ed il PH viene calcolato da
A−(aq) + H2O(l) ⇄ HA(aq) + OH−(aq)
base acido acido coniugato + base coniugata
Kb = [HA] [OH-] / [A-] ed essendo Kw = Ka ⋅ Kb e [HA] = [OH−]
Kw/Ka = [OH-]2 / [A-] [OH ]=√ Kw [A– ]/ Ka [OH -]=√ Kw Cs / Ka
pertanto
[OH -]=√1 x 10-15 / 7,2 10-4
[OH -]= √1,38 x 10-12 =1,17 x 10-6
POH = -log 1,17 x 10-5 = 6-log 1,17 = 6- 0,07 = 5,93
PH= 14 -5,93 =8,07 = 8,1
risposta corretta C
13. Un individuo assume ogni giorno 2,0 L di acqua di una fontana che ha un contenuto di As(V) pari a
6,5 μg/L. Quanti milligrammi di As(V) vengono ingeriti in 2 anni da tale individuo? Si consideri lʼanno di 365 giorni.
A) 4,3 mg
B) 5,7 mg
C) 9,5 mg
D) 7,1 mg
soluzione
Ogni giorno l’individuo consuma 2 litri x 6,5 μg =13,0μg
1 anno è costituito da 365 giorni quindi in un anno consuma 13,0 x 365= 4745 μg pertanto in 2 anni assume 9490 μg
1μg corrisponde a 1 x 10-6 g quindi 9490 μg corrispondono a
1 : 0,000001 = 9490 :X X= 0,00949 g = 9,5 mg
risposta corretta C
14. Decomponendo termicamente 52,3 g di un minerale contenente CeO2 (s), si formano 0,014 molidi O2 (g), secondo la reazione (da bilanciare):
CeO2 (s) → Ce2O3 (s) + O2 (g).
Calcolare la % di Ce nel minerale.
A) 15,0%
B) 21,7%
C) 38,9%
D) 41,8%
soluzione
la reazione bilanciata è: 4 CeO2 (s) → 2Ce2O3 (s) + O2 (g).
la quantità di CeO2 nel minerale è calcolata considerando che se da 4CeO2 si ottiene O2 da X g se ne ottengono 0,014 x 32 g
4 x 172,11 :32 = X : 0,448 X= 9,63 g di CeO2 presenti nel campione
Se in CeO2 vi è 1 atomo di Ce in 9,634 ve ne saranno X
X = 140,11 x 9,634 / 172,11 = 7,83 g
la % di cerio nel campione di minerale è
se in 52,3 g vi sono 7,83 g di cerio in 100 ve ne sono X
X=7,83 x 100/ 52,3 = 14,7 % = 15%
Risposta corretta A
15 Calcolare il pH di una soluzione ottenuta mescolando volumi uguali di una soluzione di HCl 0,1 M e una di CH3COONa 0,l M.
A) 3,0
B) 4,5
C) 6,9
D) 5,7
soluzione
trattandosi di volumi uguali e concentrazioni uguali tutto il sale si trasforma in acido per cui il PH è quello che deriva da un acido debole
[H+] = √Ka x Ca = √K1,8 x 10-5 x 0,1 = 1,34 x 10-3 PH= 3-0,12=2,88 =3,0
risposta corretta A
16- calcolare la costante di ionizzazione di un acido debole HA sapendo che aggiungendo 50 mL di una soluzione di NaOH 0,1 M a 50 mL di una soluzione 0,2 M di HA si ottiene una soluzione con un pH = 4,5.
A) 6,8 ∙ 10-7
B) 3,2 ∙ 10-5
C) 8,4 ∙ 10-3
D) 5,2 ∙ 10-8
soluzione
[H+]= 10 -4,5 = 0,5 (questo è un logaritmo!) x 105
Ricorda che per risalire dal PH ad H+ [ H+]=10-ph e se Ph è intero [ H+]=10-ph . Se l’esponente non è intero come nel caso specifico, allora occorre aumentare l’esponente al valore intero superiore e poi sottrarre da questo il valore del PH
e nel caso specifico 10-4,5 diviene 10-5 e la differenza è 5-4,5 =0,5
Questo però è un logaritmo dal quale occorre calcolare il numero corrispondente infatti il numero a cui corrisponde il logaritmo 0,5 è 3,16 .
5 mmoli Na+ reagiscono con 5 mmoli di HA ;
si formano 5 mmoli di sale NaA e rimangono 5 mmoli di HA
si ha quindi HA in presenza del sale NaA cioè si è formato un tampone.
poichè per una soluzione tampone [ H+] = Ka Ca/Cs
Ca= 5 mmoli e Cs = 5 mmoli formate nella reazione in un volume di 100ml quindi le due concentrazioni sono uguali Ca=Cs
[H+] = Ka x 1 = Ka
quindi [H+]= 3,16 x 10-5
rispota corretta B
17 -Determinare quanti grammi di FeC2(s| si ottengono dalla decomposizione di 1,50 moli di ferrocianuro di potassio secondo la reazione (da bilanciare):
[Fe(CN)6]4-(aq) → FeC2 (s) + CN–(aq) + N2 (g)
A) 233,1 g
B) 119,8g
C) 275,9 g
D) 223,9 g
soluzione
la reazione bilanciata è: [Fe(CN)6]4-(aq) → FeC2 (s) + 4CN–(aq) + N2 (g)
da 1 mole di [Fe(CN)6]4- si ottiene 1 mole di FeC2 quindi da 1,5 moli si ottengono 1,5 moli di FeC2
cioè 79,84 g x1,5 =119,8
risposta corretta B
18. Il carburo di litio Li2C2 (s) si ottiene attraverso la seguente reazione condotta a 1200 K:
2 Li (s) + C2H2 (g) →Li2C2 (s) + H2 (g) con Kp = 0,15.
Se la pressione nel recipiente allʼequilibrio è 1,0 ∙105 Pa, calcolare la composizione % (v/v) dei gas.
A) C2H2 (g) = 38% H2 (g) = 62%
B) C2H2 (g) = 26% H2 (g) = 74%
C) C2H2 (g) = 87% H2 (g) = 13%
D) C2H2 (g) = 55% H2 (g) = 45%
soluzione
Kp= H2 (g) / C2H2 (g) = 0,15 = PH2/PC2H2
0,150= X/1-X
0,15 (1-X ) =X
0,15 -0,15X =X
1,15X= 0,15 X=0,13
quindi da 1 mole si formano 0,13 moli di H2 da 100 se ne formano 13 quindi H2=13%
C2H2 = 100-13 = 87%
risposta corretta C
19. Un volume Va mL di una soluzione di un acido forte di concentrazione CH M viene titolato con un volume VB mL di una soluzione di una base forte di concentrazione COH M. Quale sarà lʼandamento della grandezza (Ca – Cb) in funzione del pH durante la titolazione dove:
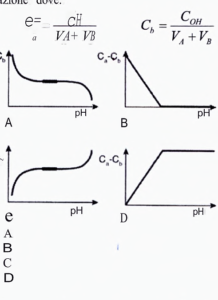
soluzione
la concentrazione Ca ( e di conseguenza [H+]) diminuisce gradualmente man mano che si aggiunge Cb quindi Ca-Cb diminuisce ed il PH aumenta. Quando tutto l’H+ dell’acido viene neutralizzato, l’aggiunta ulteriore di Cb fa s’ che il PH dipenda solamente dalla presenza della Cb quindi il PH aumenta.
Risposta corretta A
20. Si considerino i seguenti potenziali redox standard:
Al3+(aq) + 3 e-→Al(s) E0 = -l,66 V
Co3+(aq) + 3 e-→Co(s) E0 = +l,45 V
Cr3+(aq) + 3 e-→Cr(s) E0 = -0,74 V
Bi3+(aq) + 3 e-→ Bi(s) E0 = + 0,29 V
I2 (s) + 2 e -→ 2 I-(aq) E0 = + 0,54 V
Indicare quale dei seguenti composti non è stabile:
A) CoI3 (s)
B) AlI3 (s)
C) CrI3 (s)
D) BiI3 (s)
soluzione
dai valori di E° possiamo notare che il Co +3 possiede il valore positivo più alto del valore di E° dello iodio (+1,45 contro + 0,54) ciò significa che Co+3 agisce da ossidante nei confronti di I- quindi CoI3 è ovviamente un composto instabile perché tende a formare I2.
Al contrario. gli altri valori di E° sono inferiori al valore di E° dello iodio ( alcuni sono addirittura negativi)per cui i relativi composti sono stabili in quanto I- non viene ossidato ad I2
risposta corretta A
21. La solubilità dellʼacido urico in acqua è di 3,57 ·10‒5 M. La sua costante acida è Ka= 4,0 ·10‒6
Calcolare il pH di una soluzione satura di acido urico. (Si trascurino altri equilibri).
A) 4,9
B) 7,8
C) 9,2
D) 8,4
soluzione
l’acido urico è

Ka=[H+]2 / Ca [H+]2= Ka Ca [H+]= √4,0 ·10‒6 x 3,57 ·10‒5 = √14,3 x 10-11
[H+]= 1,19 x 10-5
PH = -log 1,19 x 10-5 = 5- 0,07 = 4,93
risposta corretta A
22. Lʼamminoacido cisteina ha tre costanti di ionizzazione acida: Ka1 = 10‒1,9 ,
Ka2 = 10‒10,7 e Ka3 = 10‒8,4
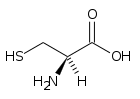
In realtà un atomo di H+ si muove sul doppietto elettronico libero di NH2 per formare NH3+.
Assegnare ad ogni gruppo (COOH, NH3+, SH) la propria costante Ka. (Si assumano trascurabili le interazioni intermolecolari).
A) Ka1 = 10‒1,9 (NH3+); Ka2 = 10‒10,7 (COOH); Ka3 = 10‒8,4 (SH)
B) Ka1 = 10‒1,9 (SH); K a2 = 10‒10,7 (NH3+); Ka3 = 10‒8,4 (COOH)
C) Ka1 = 10‒1,9 (COOH); Ka2 = 10‒10,7 (NH3+); Ka3 = 10‒8,4 (SH)
D) Ka1= 10‒1,9 (SH); Ka2 = 10‒10,7 (NH3+ );Ka3 = 10‒8,4 (COOH)
soluzione
E’ evidente che il gruppo più acido è il gruppo acetico COOH l’altro gruppo acido è NH3+ in quanto H+ è più facilmente staccabile rispetto ad SH quindi Ka2 è dovuto ad NH3+ e chiaramente il terzo gruppo acido è SH
pertanto le costanti da attribuire sono:
Ka1 = 10‒1,9 (COOH); Ka2 = 10‒10,7 (NH3+); Ka3 = 10‒8,4 (SH)
riposta corretta C
23. La solubilità (% m/m) di K2SO4 in acqua dipende dalla temperatura secondo la tabella Temperatura (K). a 273,15 K e 293,15 K la Solubilità (% m/m) è rispettivamente 6,7 e 10,0 . Calcolare quanti g di K2SO4 precipitano raffreddando, fino 273,15 K, 500 g di una soluzione satura a 293,15 K.
A) 22,7 g
B) 17,8 g
C) 16,6 g
D) 18,9 g
soluzione
quando la soluzione si raffredda precipita l’eccesso di sale rispetto al limite che può essere solubilizzato a 273,15 K
l’eccesso di sale ogni 100 g è 10-6,7 = 3,3 g
la soluzione in realtà contiene 3,3 g in 503,3 g totali quindi la quantità in grammi che precipita è 3,3 x 5,03=16,6
risposta corretta C
24. Un recipiente chiuso e rigido contenente acqua liquida in equilibrio con vapore acqueo viene termostatato a 373,15 K. Mediante un dispositivo che non consente al vapore di uscire, viene aggiunto del cloruro di sodio ed il contenitore viene delicatamente agitato, sempre sotto termostatazione. Cosa può accadere?
A) si forma unʼemulsione
B) la pressione allʼinterno del contenitore aumenta
C) parte del vapore condensa
D) parte dellʼacqua liquida evapora
soluzione
soluzione
quando si stabilisce l’equilibrio dinamico tra le particelle della superficie liquida e le particelle del vapore la pressione del vapore misurata è chiamata tensione di vapore.
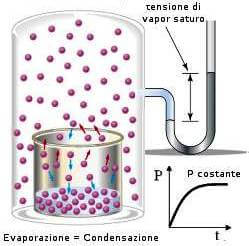
l’aggiunta di NaCl secondo la legge di Raoult provoca un abbassamento della tensione di vapore pertanto la quantità di vapore deve diminuire ed infatti parte del vapore condensa sulla superficie del liquido o sulle pareti.
risposta corretta C
25. Un sistema chiuso, in cui non avvengono reazioni chimiche, subisce una serie di processi reversibili che lo riportano allo stato iniziale. Sommando tutti gli scambi termici avvenuti nei singoli processi, si trova che il sistema ha assorbito calore dallʼambiente circostante. Quale delle seguenti affermazioni è vera?
A) lʼambiente circostante ha svolto lavoro sul sistema
B) il sistema ha svolto lavoro sullʼambiente circostante
C) in totale il sistema non ha svolto alcun lavoro
D) nessuna delle precedenti
soluzione
il primo principio della temodinamica ΔΕ = Q + L
La convenzione del “primo criterio” o “criterio misto” dice che il calore Q è positivo se si trasferisce dall’ambiente al sistema, mentre L è positivo se compiuto dal sistema.
La convenzione “egoistica” sostiene invece che sia il lavoro che il calore sono considerati positivi quando vengono forniti al sistema. In tal caso l’espressione del primo principio della termodinamica è:
∆U = Q + L
in un sistema isolato (cioè costituito dal sistema + ambiente) ΔΕ =0 perciò Q= -L
Nel caso specifico il sistema assorbe calore dall’esterno quindi è il sistema a compiere lavoro
Risposta corretta B
26-Qual è lʼeffetto della presenza di un catalizzatore su una reazione chimica?
A) sposta lʼequilibrio verso la formazione dei prodotti
B) diminuisce lʼenergia di attivazione della reazione
C) favorisce termodinamicamente la formazione di una quantità maggiore di prodotti
D) sottrae prodotti dalla miscela di reazione, favorendo la conversione totale dei reagenti
soluzione
perchè una reazione avvenga è necessario che venga superata una barriera di energia che viene chiamata ENERGIA DI ATTIVAZIONE. Nella figura seguente l’energia di attivazione è rappresentata dal punto di massimo della curva.

l’energia di attivazione è l’ energia minima necessaria per far avvenire una reazione ( X→ Y) .
Perché una reazione avvenga è necessaria la collisione di due o più molecole opportunamente orientate e dotate di un livello di energia minimo (l’energia di attivazione), da permettere la collisione nonostante le forze repulsive generate dalle loro nuvole elettroniche esterne. Tale livello minimo di energia costituisce pertanto una barriera di potenziale . Se l’energia disponibile è tale da superare questa barriera allora le forze repulsive vengono superate e le molecole coinvolte vengono a trovarsi ad una distanza tale da poter riorganizzare i legami tra gli atomi che le compongono per originare nuovi composti (prodotti della reazione).
Spesso l’energia di attivazione non permette che una determinata razione avvenga, per cui si utilizzano alcune sostanze dette catalizzatori che diminuiscono la barriera di energia tanto da far avvenire reazioni che altrimenti potrebbero non verificarsi senza catalizzatore.
Ne consegue che la risposta corretta al quesito è B
27-Il reagente A si converte in altre specie chimiche seguendo una legge cinetica del secondo ordine, v = k[A]2.
Quale delle seguenti affermazioni è vera?
A) il procedere della reazione non richiede che le molecole di A si incontrino tra loro
B) la reazione avviene quando le molecole di A si incontrano tra loro
C) la reazione è favorita da una diminuzione della temperatura
D) A è un composto intrinsecamente instabile
soluzione
La reazione dovrebbe essere 2 A → B per cui la velocità è v = k[A]2. La reazione avviene quindi quando le molecole di A reagiscono urtandosi tra loro.
riposta corretta B
28. Sapendo che la seguente reazione è endotermica
2 H2O(g) → 2 H2 (g) + O2 (g)
cosa si può fare per diminuire la quantità di H2O allʼequilibrio?
A) aggiungere ossigeno
B) diminuire il volume del recipiente in cui avviene
la reazione
C) aggiungere un catalizzatore
D) aumentare la temperatura a pressione costante
soluzione
dal primo principio della termodinamica ΔE= Q + L dove L= lavoro che, a pressione costante, per un gas è P (V2-V1)
ΔE = Q + PV2-PV1 il prodotto ΔE= Q + H2 -H1 dove H= entalpia quindi
ΔE= Q + ΔH
in una reazione chimica si ha ∑ H prodotti – ∑ H reagenti= ΔH di reazione
per la reazione 2 H2O(g) → 2 H2 (g) + O2 (g)
(2H O2 + H H2) – HH2O = ΔH
Per processo endotermico si intende una trasformazione che comporta un aumento di entalpia del sistema e dunque un trasferimento di calore dall’ambiente al sistema stesso. Adottando il criterio egoistico, che prende in riferimento il sistema, la variazione di entalpia ΔH assume valore positivo. In riferimento invece alla notazione mista, il ΔH, rappresentando energia ceduta dall’ambiente, assume valore negativo.
Ciò stabilito, se si aumenta la temperatura la reazione data sopra procederà da sinistra a destra e auindi la concentrazione di H2O diminuisce.
risposta corretta D
29 Qual è la pressione osmotica di una soluzione costituita da 1,50 g di canfora (C10H16O) in 100,00 g di benzene (C6H6) a 15 °C, se la densità della soluzione è 0,900 g/mL?
A) 212 kPa
B) 687 kPa
C) 322 kPa
D) 821 kPa
soluzione
L'osmosi è il processo in cui un liquido passa attraverso una membrana i cui pori consentono
il passaggio di molecole di solvente ma non permettono il passaggio delle molecole di soluto.
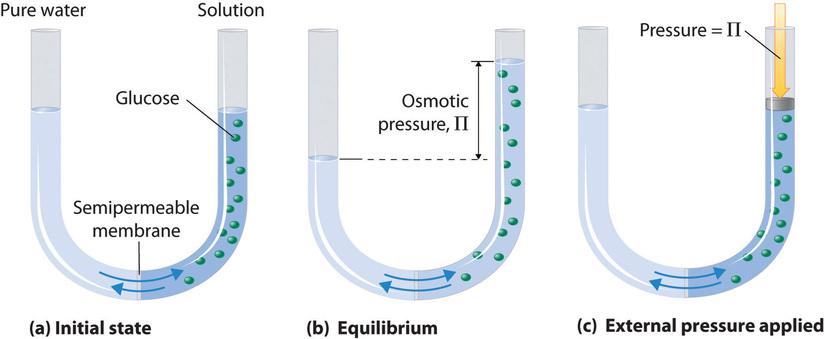
La cellula mostrata sopra è una semplice cellula osmotica. Entrambi i compartimenti separati dalla membrana semipermeabile contengono acqua, ma quello a destra contiene anche un soluto le cui molecole (rappresentate dai pallini scuri ) sono troppo grandi per passare attraverso la membrana. Molte sostanze artificiali e naturali sono in grado di agire come membrane semi-permeabili.Le pareti della maggior parte delle cellule vegetali e animali rientrano in questa categoria. Nella prima figura a sinistra del tubo ad U vi è il solvente puro(acqua) ed a destra la soluzione di glucosio in acqua.Nella seconda figura si vede che il solvente entra nel tubo di destra dove vi è la soluzione creando pertanto un dislivello. Nella terza figura si vede che esercitando una pressione sul ramo di destra si fa in modo da far ritornare la situazione all'equilibrio cioè con i livelli di liquido uguali nei due rami La pressione esercitata viene definita PRESSIONE OSMOTICA e si indica con π. Jacobus Van't Hoff ha studiato la pressione osmotica ed ha provato che si comporta come la pressione di un gas ideale. Pertanto Π x V = nRT i tuttavia, la pressione osmotica (al contrario della pressione di un gas) è una proprietà colligativa ioè dipende dal numero di particelle in soluzione che si indicano con la lettera i. Per esempio se la soluzione è costituita da glucosio, questo non si scinde in particelle quindi i=1 Se la soluzione è quella di NaCl questo sale si scinde in 2 ioni Na+ e Cl- quindi i=2 Se la soluzione è K2 SO4 allora si hanno 3 particelle (2K+ ed So4-2) quindi i =3 ecc. Nel caso in esame la densità d= 0,900 g/mL ciò significa che 1 ml pesa 0,9 g quindi 100 g di solvente corrispondono a V= g/d V= 100/0,9=111,1 ml le moli n della canfora sono 1,5/PM 1,5/152,2 = 0,0098 =n pertanto Π = 0,0098 x 8,314 x 288 / 111,1 =0,212 Pa = 212 KPa risposta corretta A 30. Calcolare il valore a 25 °C della costante di equilibrio della reazione: CO (g) + l/2 O2 (g) → CO2 (g) sapendo che lʼenergia di Gibbs standard di formazione di CO2 e CO valgono, rispettiva- mente, -394,36 kJ mol‒1 e -137,17 kJ mol‒1. A) K = 5,1 ·10‒23 B) K = 5,1 ·1021 C) K = 1,2 ·1045 D) K = 1,2 ·1021 soluzione L'energia libera di Gibbs(o entalpia libera) è una funzione di stato (che dipende cioè solo dallo stato iniziale e finale del sistema e non dal modo con cui si perviene a quegli stati) usata in termodi- namica e termochimica per determinare la spontaneità di una reazione. Infatti in una reazione chimica ΔG =∑Gprodotti - ∑ Greagenti Se l'energia ∑G dei prodotti è più bassa significa che i prodotti si formano più facilmente e la reazione è spontanea, se invece ∑G dei prodotti è più alta allora la reazione non è spontanea. Quando per una reazione ∑Gprodotti = ∑ Greagenti allora ΔG =0 cioè la reazione è all'equilibrio. Nella reazione data sopra CO (g) + l/2 O2 (g) → CO2 (g) Gprodotto (CO2) = -394,36 kJ Greagente (CO) = -137,17 kJ pertanto ΔG = -394, 36 + 137,17 = -257190 j sappiamo tuttavia che è legato alla costante di equilibrio dalla relazione ΔG =-RT lnK quindi - 257190=- 8,314 x 298 x lnK lnK= 257190 / 2477,6 =103,806 K= 1,2 x 1045 risposta corretta C 31. Se una reazione del primo ordine ha unʼenergia di attivazione di 104,600 kJ mol‒1 e un fattore preesponenziale di 5 ·1013 s‒1, determinare a quale temperatura il tempo di dimezzamento è di 30 giorni. A) 350 °C B) 35 K C) 35 °C D) -3,5 °C soluzione si tratta in questo caso di valutare la cinetica della reazione del primo ordine e quindi il tempo di dimezzamento(in secondi),La Velocità di una reazione chimica è la variazione della concentrazione di un reagente o di un prodotto nell’ unità di tempo : per una reazione A→ B la legge cinetica è del primo ordine l'ordine è l'esponente di A (in questo caso 1) nell'equazione V= -d[A] /dt = k[A] che integrata dà ln[A] = - kt + ln [A]0 in cui[ A]0 è la concentrazione iniziale di A e k è la costante di velocità. La costante k è in relazione all'energia di attivazione mediante l'equazione di Arrhenius k= A e -Ea/RT dove Ea = energia di attivazione A = fattore di frequenza R= costante dei gas T= temperatura assoluta Dallaequazione cinetica sappiamo che il tempo di dimezzamento t1/2 è definito come il periodo di tempo in cui la concentrazione iniziale diviene la metà cioè quando [A]= [A]0 /2 quindida cui si ha k= 0,693/t1/2 ed esssndo t1/2 = 2,592 x 106 s (30 giorni) allora k= 2,67 x 10-6 sapendo che dall'equazione di Arrhenius ln k = – (Ea/RT) + ln A si ha RTlnk = - Ea + RTlnA Tlnk = -Ea/R + TlnA T ln 2,67 x10-7 = - 104600/8,314 + Tln 5x 1013 T -15,2 = - 104600/8,314 + T31,54 che possiamo riscrivere 15,1T = - 12581 + 31.54T 46,64 T= -12581 da cui si ottiene la temperatura assoluta T: T=269,7 t°C = 273,15- 269,7 = -3,45° e arrotondando -3,5°C risposta corretta D 32. Calcolare lʼentalpia standard di formazione del dipropilchetone, (C3H7)2CO, sapendo che le entalpie standard di combustione di H2 (g), C (s), (C3H7)2CO (l) sono, rispettivamente, -285,8 kJ mol‒1, -395,5 kJ mol‒1 e -4395,3 kJ mol‒1 A) -159 kJ mol‒1 B) -137 kJ g‒1 C) 137 kJ mol‒1 D) -374 kJ mol‒1 soluzione per ottenere (C3H7)2CO, occorrono 4 atomi di C e 7 molecole di H2 quindi sapendo che ∑Hprodotti-∑Hreagenti =ΔH reaz allora avremo 4395,3 -( 7 x -285,8 + 7 x - 395,5 ) ΔH= 4395,3 -( -2000,6 - 2768,5) = 4395,3 - 4769,1 = -374 kJmol-1 risposta corretta D 33. Una reazione chimica viene condotta in due esperimenti separati a partire da concentrazioni iniziali differenti di reagente A. Tutti gli altri reagenti sono presenti in forte eccesso, in modo che la loro variazione di concentrazione sia trascurabile. Nel primo esperimento, la concentrazione iniziale di A è 5,37 ·10‒2 mol dm‒3 e si trova un tempo di dimezzamento di 8 minuti e 34 secondi; nel secondo, la concentrazione iniziale di A è 3,69·10‒2 mol dm‒3 e il tempo di dimezzamento è 12 minuti e 27 s. Determinare lʼordine di reazione rispetto ad A e la costante cinetica. A) secondo ordine; k = 3,6 ·10‒2 dm3 mol‒1 s‒1 B) primo ordine; k = 5,3 s‒1 C) primo ordine; k = 3,6 ·10‒2 s‒1 D) secondo ordine; k = 5,3 dm3 mol‒1 s‒1 soluzione sappiamo che per una reazione del primo ordine
se la reazione fosse del primo ordine nel primo esperimento avremmo k = 0,693/514 sec = 1,34 x 10-3 nel secondo esperimento avremmo k= 0,693 / 747 = 9,2 x 10-4 essendo i valori di k diversi è evidente che la reazione non è del primo ordine. Se la reazione fosse del secondo ordine avremmo
da cui
Il tempo di dimezzamento per reazioni del secondo ordine che seguono una cinetica del tipo v = k · [A]2 [A]t = ½ [A]o
da cui
pertanto nel primo esperimento si ha 514= 1/ 5,37 ·10‒2 x k k= 1/5,37 x 10-2 x 514 =1/ 27,6 = 3,62 x 10-2 dm3 mol‒1 s‒1 nel secondo esperimento k= 1/ 3,69·10‒2 x747 = 1/27,56 =3,62 x 10-2 dm3 mol‒1 s‒1 essendo il valore k 0ttenuto nei due esperimenti costante paria a 3,62 x 10-2 dm3 mol‒1 s‒1 risulta evidente che la reazione è del secondo ordine . risposta corretta A 34. In condizioni di temperatura, pressione e numero di moli di ogni componente costanti, un sistema si trova in uno stato di equilibrio se: A) tutti i possibili processi cui può sottostare prevedono una diminuzione di G B) alcuni dei possibili processi cui può sottostare prevedono una diminuzione di G C) alcuni dei possibili processi cui può sottostare prevedono un aumento di G D) tutti i possibili processi cui può sottostare prevedono un aumento di G soluzione in un sistema che non è all'equilibrio, ∑Gprodotti - ∑reagenti ≠0 quindi, se viene favorita la formazione dei prodotti necessariamente ∑Gprodotti - ∑reagenti <0 mentre se la formazione dei prodotti è sfavorita ∑Gprodotti - ∑reagenti >0. un valore di ∑Gprodotti - ∑reagenti deve essere 0 e quindi se il sistema deve essere all'equilibrio, ogni processo deve prevedere un aumento di G in ognuno dei due casi sia che sia favorita la formazione dei prodotti sia che sia sfavorita, affinchè ΔG sia sempre uguale a zero cioè che il sistema sia all'equilibrio. risposta corretta D 35. Una macchina termica lavora secondo un ciclo di Carnot tra le temperature di 150 °C e 25 °C. La quantità di calore teorica che la macchina deve prelevare per fornire un lavoro di 1,00 kJ è: A) 33,8 cal B) 3,38 cal C) 3,38 kJ D) 33,8 J soluzione il ciclo di Carnot è costituito da 4 processi due isotermici e due adiabatici e per un gas sono:
Gli stati B e C sono sulla stessa adiabatica Gli stati D e A sono sulla stessa adiabatica
| A→ B Espansione isoterma, Q – L = D U; gas ideale ® D U=0, Q = L dove DU è la variazione di energia ed L il lavoro |
B→ C Espansione adiabatica, Q - L = D U, Q = 0, → L = -D U,
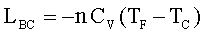 C→D Compressione isoterma, Q = L
C→D Compressione isoterma, Q = L
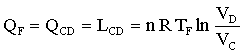
B→ C Compressione adiabatica, L = -D U,
![]()
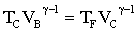
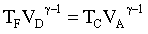
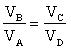 ù
ù
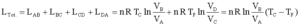
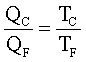
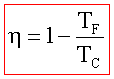
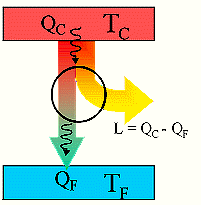
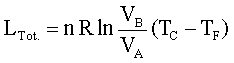
questo indica che il rendimento di una macchina termica η non può mai essere uguale ad 1. In una macchina di carnot seè il lavoro in uscita dal sistema (lavoro prodotto che in questo caso è 1,00 KJ) e se
è il calore assorbito dal sistema per produrre il lavoro (calore richiesto che in questo caso è X ), allora si ha
dove W/Q =η è il rendimento della macchina che dipende esclusivamente dalla tempe- ratura iniziale T1 e finale T2 T2 = 273+25 T1 = 273+150 quindi 1/X = 1-0,705 X= 1/ 0,295 X= 3,38 kJ risposta corretta C 36. Quale volume di glicole etilenico (C2H6O2) bisogna aggiungere a 1,00 dm3 di acqua perché questa congeli a -10 °C? La densità del glicole etilenico è 1,1132 kg dm3 e la costante crioscopica dellʼacqua è 1,86 K mol-1 kg. A) circa 0,50 dm3 B) circa 0,15 dm3 C) circa 0,40 dm3 D) circa 0,30 dm3 soluzione sappiamo che quando si scioglie un soluto non volatile in un solvente la tensione di vapore della soluzione è più piccola di quella del solvente puro e ciò, a parità di pressione esterna, si traduce in un aumento del punto di ebollizione o un abbassamento del punto di congelamento. La legge che regola l'abbassamento della temperatura di congelamento è ΔT = K·g/M ΔT = Kcrioscopica x molalità/Peso Molecolare dove k = costante ebulloscopica del solvente e ΔT=T2-T1 dove g= grammi di soluto in 1000 g di solvente ed M il peso molecolare .(da notare che questa espressione permette di calcolare il Peso Molecolare di una sostanza da dati di crioscopia). Nel caso in esame si ha 10 = (moli /1000) x 1,86 = g/PM / 1000 (10 x 62 /1,86) x1000=g g =333333 =333,33 Kg essendo la densità 1,1132 kg/L il volume di glicol necessario è V= g/d V= 333,3/1,1132 =0,299 L risposta corretta D 37. Riscaldando un solido ad una pressione costante minore di quella del punto triplo, quali transizioni di fase è possibile osservare? A) nellʼordine, fusione ed ebollizione B) nellʼordine, ebollizione e fusione C) sublimazione D) fusione soluzione Il punto triplo è uno stato termodinamico determinato dai valori di temperatura e pressione in cui coesistono in equilibrio i tre stati solido-liquido-vapore.
come si vede dal grafico le la pressione costante è inferiore alla pressione del punto critico la sostanza si trova allo stato solido e se si aumenta la temperatura si trasforma direttamente in vapore per cui si ha SUBLIMAZIONE. Risposta corretta C 38. Il composto A si converte in due prodotti (B e C) secondo due reazioni parallele, come schematizzato di seguito: B ← A → C Le due reazioni sono del primo ordine ed hanno costante cinetica k1 e k2, rispettivamen- te. La concentrazione di A varia quindi nel tempo seguendo la relazione: A) [A] = [A]0 - kt dove k = k1 · k2 B) [A] = [A]0 x ekt dove k = k1 + k2 C) [A] = [A]0 x e kt dove k = k1 · k2 D) [A] = (1/[A]0 + kt)‒1 dove k = k1 + k2 soluzione si tratta di una cinetica di due reazioni competitive o parallele A → B (k1) A → C (k2) quando t = 0 [A] = a0 [B] = 0 [C] = 0 quando t = t a0 = [A] + [B] + [C] - d[A] /dt = d[B]/dt + d[C] / dt = k1[A] + k2 [A] (k1+k2) [A] [A] = a0 e -(k1+k2) t ln[A]= ln a0 - (k1+ k2) t K = (k1 + k2) e quindi [A] = a0 e - Kt la risposta corretta è pertanto B 39. Si consideri la reazione di decomposizione del ciclobutano ad etilene a 438 °C: C4H8 (g| →2 C2H4 (g) per la quale è la costante cinetica è k = 2,48 ·10‒4s‒1. Dopo quanto tempo la concentra- zione iniziale di ciclobutano si riduce del 10%? A) 7 minuti e 5 secondi B) 75 secondi C) 45 secondi D) 4 minuti e 5 secondi soluzione sappiamo che per una reazione del primo ordine
![{\displaystyle {\frac {d\left[A\right]}{dt}}=-k\left[A\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d99a1a854d8fafe83bd0a7d184c46c974480f72e)
![{\displaystyle {\frac {d\left[A\right]}{\left[A\right]}}=-kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad717b48d29c475014081be49e9bff97020cf393)
![{\displaystyle \int _{\left[A\right]_{0}}^{\left[A\right]}{\frac {d\left[A\right]}{\left[A\right]}}=-k\int _{0}^{t}dt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a7abc57fc770db6bf467aaf58c793c3ddf9b12)
![{\displaystyle \left[A\right]=\left[A\right]_{0}e^{-kt}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a505680e73f178880ded3e4e783053cad71140f)
- kt = ln[A]t - ln[A]0 kt= ln[A]0 - ln[A]t t= ln[A]0 - ln[A]t / K t= 4,605 - 4,49 /2,4 x 10-4 = 443,54 secondi =7minuti e 4 sec risposta corretta A 40. In un sistema chiuso avviene una reazione endotermica che assorbe un calore di 24 kJ. Si vuole termostatare a 0 °C il sistema immergendolo in un bagno di acqua che contiene del ghiaccio (acqua e ghiaccio sono inizialmente a 0°C). Calcolare la massa di acqua necessaria per evitare che la temperatura del sistema diminuisca. Si trascurino le dispersioni. Il calore di fusione del ghiaccio è 333 J g‒1 A) circa 33 g B) circa 0,5 kg C) circa 72 g D) i dati forniti non sono sufficienti soluzione Il valore fornito del Calore di fusione indica che 1 g di acqua fonde con 333 j siccome la reazione endotermica assorbe 24000 J per mantenere costante la temperatura del bagno è sufficiente la seguente proporzione 1:333 J = X: 24000 X=72 g risposta corretta C 41. Dibromoetene e dibromopropene formano una soluzione ideale. Sapendo che la tensione di vapore delle due sostanze pure a 358 K è 22,9 kPa e 17,1 kPa, rispettivamen- te, determinare la pressione della miscela gassosa, costituita dai due composti in equili- brio con una soluzione in cui la frazione molare di dibromoetene è 0,60. A) 20,6 kPa B) 21,2 kPa C) 19,1 kPa D) 18,4 kPa soluzione P°A = tensione di vapore del dibromoetene puro =22,9 kPa alla temperatura 358K P°B = tansione di vapore del dibromopropene puro = 17,1 kPa alla temperatura 358 K sappiamo che xA = frazione molare di A = 0,60 sappiamo inoltre che XA + XB =1 allora xB = frazione molare di B = 1-0,60 = 0,40 poiché PA = P°A * xA PB = P°B * xB Pt = pressione totale = PA + PB = P°A * 0.60 + P°B * 0.40 Pt= 22,9 x 0,60 + 17,1 x 0,40 =13,74 + 6,48 = 20,6 kPa risposta corretta A 42. Se un gas è portato, a temperatura costante, dalla pressione di 100 kPa fino a 150 kPa, cosa si può prevedere sul suo potenziale chimico? A) il potenziale chimico decresce B) il potenziale chimico aumenta C) non si può prevedere il segno della variazione del potenziale chimico D) il potenziale chimico non cambia soluzione il potenziale chimico è in relazione alla pressione μ =μ° +RT ln(P) è evidente che aumentando la pressione, il potenziale chimico deve aumentare.
risposta corretta B
43. Alla pressione di 100 kPa, il grado di dissociazione del fosgene (COCl2) in
monossido di carbonio e cloro gassoso è dellʼ80% a 553 °C e del 91% a 603 °C
°C. Calcolare lʼentalpia standard di reazione.
A) -780 kJ mol‒1
B) -480 kJ mol‒1
C) 120 kJ mol‒1
D) -120 kJ mol‒1
soluzione
la reazione è : COCl2 <=> CO +Cl2
1-α α α
numero totale di moli = 1- α + α + α = 1 + α
calcoliamo la costante di equilibrio dal valore di alfa a 553° C ed a 603°C
Ppa = Xa Pt Ppb =XbPt
dove Xa= farz molare di CO= α /1+α Xb = frazione molare di Cl2= α/1+α
fraz molare CoCl2 = 1- α /1+ α x Pt
pertanto K1 = [α /1+α ]Pt x [α /1+α ] Pt / [1- α /1+α] Pt
K1 = [0,8 / 1,8 ] x 100 x [0,8 / 1,8 ] x 100 /[ 1-0,8 / 1,8 ]x 100
K1= 0,4 x 100 x 0,4 x100 / 0,111 x 100 =40 x 40 / 11,1
K1=1600 /11,1 =144,14
analogamente per K2 si ha K2=[ 0,91/ 1,91 ]x100 x [ 0,91/ 1,91 ]x100 / [1-0,91 /1,91 ] x 100
K2 = 0,476 x 100 x 0,476 x 100 /0,0471 x 100
K2= 47,6 x 47,6 / 4,71 = 481,05
ricordando che ln K2/K1 = ΔΗ° /R ( T2-T1 )/ T2 x T1 ed essendo T2= 603+273 = 876
e T1 = 553 +273 = 826
ln 481,05 / 144,14 x 8,314 = ΔΗ° x 876- 826 / 723576
1,205 x 8,314 = ΔΗ° x 0,000069
ΔΗ°= 145,2 kJ
44. Individuare i composti che hanno uno stereoisomero meso:
a) 2,3-dimetilpentano, b) 2-cloro-3-metilbutano,
c) 1,3-dietilciclopentano, d)3-4-difluoro esano
A) a, c
B) a, d
C) c, d
D) d
soluzione
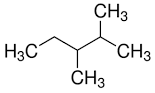
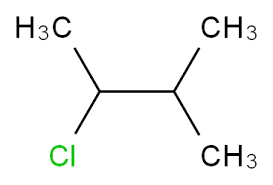
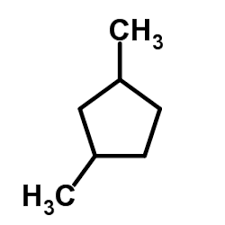
 Un composto meso è un composto la cui molecola contiene più di un Carbonio asimmetrico e
presenta un piano di simmetria interno. Tale genere di composto presenta quindi degli enantiomeri
(+ e - contemporaneamente) . Alcune forme meso si possono riconoscere, per esempio, perché i
sostituenti legati agli atomi chirali sono gli stessi e si trovano dallo stesso lato della molecola.
Se osserviamo le molecole scritte sopra notiamo che solo le ultime due presentano un piano di
simmetria che divide in due parti speculari la molecola e possiedono 2 centri asimmetrici.
La risposta corretta è C
45. Lʼidrolisi delle ammidi catalizzata dagli acidi è un processo irreversibile.
Individuare la motivazione corretta.
A) nellʼultimo stadio della reazione lʼammoniaca eliminata viene protonata
B) lʼacido carbossilico formato viene protonato
C) la formazione dellʼacido carbossilico è stericamente favorita
D) le idrolisi acide sono sempre processi irreversibili
soluzione
Le ammidi sono composti organici con formula generica RCONH₂, in pratica sono derivati degli
acidi carbossilici in cui l'ossidrile acido è sostituito d un gruppo amminico che può essere primario
-NH2 secondario R-N-H terziario R2-N-
Questo gruppo può subire idrolisi sia in ambiente acido che in ambiente basico secondo il
meccanismo
Un composto meso è un composto la cui molecola contiene più di un Carbonio asimmetrico e
presenta un piano di simmetria interno. Tale genere di composto presenta quindi degli enantiomeri
(+ e - contemporaneamente) . Alcune forme meso si possono riconoscere, per esempio, perché i
sostituenti legati agli atomi chirali sono gli stessi e si trovano dallo stesso lato della molecola.
Se osserviamo le molecole scritte sopra notiamo che solo le ultime due presentano un piano di
simmetria che divide in due parti speculari la molecola e possiedono 2 centri asimmetrici.
La risposta corretta è C
45. Lʼidrolisi delle ammidi catalizzata dagli acidi è un processo irreversibile.
Individuare la motivazione corretta.
A) nellʼultimo stadio della reazione lʼammoniaca eliminata viene protonata
B) lʼacido carbossilico formato viene protonato
C) la formazione dellʼacido carbossilico è stericamente favorita
D) le idrolisi acide sono sempre processi irreversibili
soluzione
Le ammidi sono composti organici con formula generica RCONH₂, in pratica sono derivati degli
acidi carbossilici in cui l'ossidrile acido è sostituito d un gruppo amminico che può essere primario
-NH2 secondario R-N-H terziario R2-N-
Questo gruppo può subire idrolisi sia in ambiente acido che in ambiente basico secondo il
meccanismo
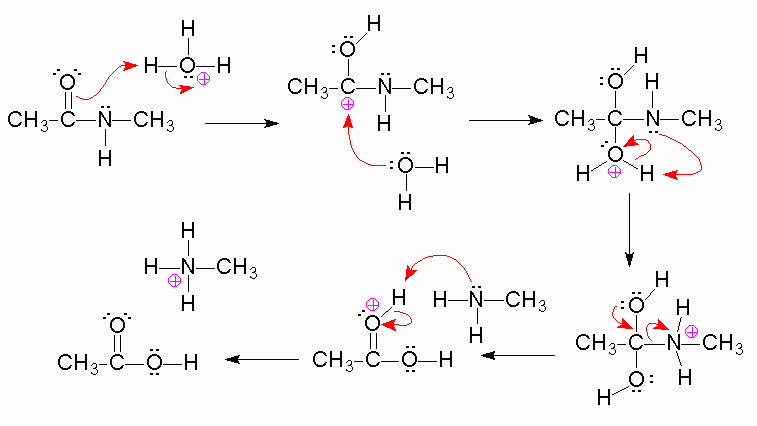 in cui si ha l'attacco di H3O+ all'ossigeno del CO che forma C-OH e successiva unione di H2O sul carbocatione ed infine il gruppo
amminico viene espulso dopo essere stato protonato CH3-NH3+
La riposta corretta quindi è A
46. Quale dei seguenti alcoli secondari può essere ottenuto per reazione del formiato di
etile con un eccesso di reattivo di Grignard
in cui si ha l'attacco di H3O+ all'ossigeno del CO che forma C-OH e successiva unione di H2O sul carbocatione ed infine il gruppo
amminico viene espulso dopo essere stato protonato CH3-NH3+
La riposta corretta quindi è A
46. Quale dei seguenti alcoli secondari può essere ottenuto per reazione del formiato di
etile con un eccesso di reattivo di Grignard
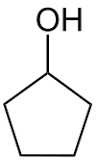 1 idrossi 1ciclopropil etano
soluzione
1 idrossi 1ciclopropil etano
soluzione
I reattivi di Grignard sono dei composti organometallici in cui il metallo è generalmente il Magnesio Metallico .Si ottengono per reazione tra un alogenuro alchilico RX con un atomo di magnesio Mg. Quì di seguito è chiarito il meccanismo di formazione di RMgX
R–X + ↵|Mg –> [R–X]•– + •Mg+
il doppietto elettronico del Mg si scinde in due elettroni ed uno di essi rimane sul magnesio mentre l’altro forma un radicale RX•–
questo a sua volta si scinde in un radicali R• ed X–
R--X•- → R• + X-
X- reagisce con •Mg+ per formare il radicale •MgX che a sua volta reagisce con il radicale R•
per formare RMgX i reattivi di Grignard sono nucleofili molto forti (e basi forti), pertanto
reagiscono con numerose sostanze mediante addizione nucleofila in solventi anidri quali
l’etere dietilico o tetraidrofurano (THF) ad una temperatura di zero gradi C.
In questo caso specifico l'addizione avviene con il formiato di etile (derivato dell'acido formico ) che
presenta un gruppo CO
il formiato di etile ha la seguente formula :
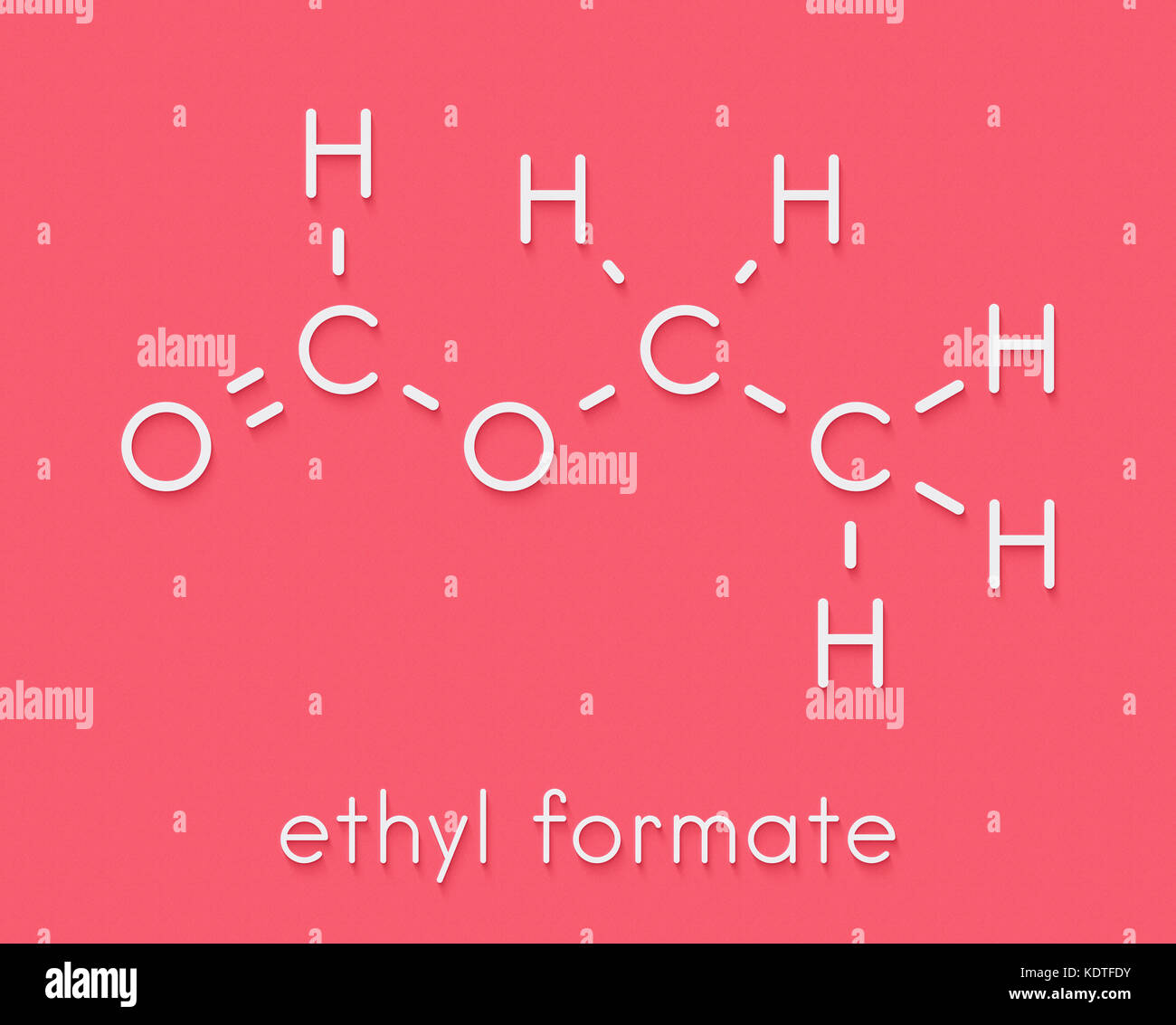 l'altro reattivo è CH3-CH2-MgX (reattivo di GRignard)
Si tratta quindi di una reazione che aumenta il composto di partenza di due atomi di carbonio.
THF anidro
CH3-CH2-MgBr + H CH3-CH2-O ------ C+-----O- ---------------> CH3-CH2 - --C ---O- + +MgBr
↓ ⁄ | |
-----> ---------------->------------⁄ H CH2-CH3
per idrolisi acida si riforma MgBr e si ottiene l'alcol con 2 atomi di Carbonio in più:
l'altro reattivo è CH3-CH2-MgX (reattivo di GRignard)
Si tratta quindi di una reazione che aumenta il composto di partenza di due atomi di carbonio.
THF anidro
CH3-CH2-MgBr + H CH3-CH2-O ------ C+-----O- ---------------> CH3-CH2 - --C ---O- + +MgBr
↓ ⁄ | |
-----> ---------------->------------⁄ H CH2-CH3
per idrolisi acida si riforma MgBr e si ottiene l'alcol con 2 atomi di Carbonio in più:
 pertanto la risposta corretta è B
47. Indicare lʼagente riducente che deve essere utilizzato per fare avvenire la reazione:
CH3-CH=CH-CH=O → CH3-CH2-CH2-CH2OH
A) NaBH4
B) H2, nickel Raney
C) LiAlH4
D) Na, NH3 (l).
soluzione
NaBH4 è un riducente blando e riduce solo aldeidi e chetoni quindi non riduce il doppio legame
LiAlH4 riduce la maggior parte dei gruppi non saturi ad eccezione degli alcheni e degli alchini
Na ed NH3 viene utilizzata per la riduzione degli alchini
La riduzione con H2 e Nikel Raney è utilizzata in questo caso per ottenere
CH3-CH2-CH2-CH2OH
perchè si può ridurre sia il carbonile che il doppio legame.
La risposta corretta è B
48. I valori di pKa dellʼacido ossalacetico sono 2,22 e 3,98. Indicare il gruppo
carbossilico più acido e perché.
pertanto la risposta corretta è B
47. Indicare lʼagente riducente che deve essere utilizzato per fare avvenire la reazione:
CH3-CH=CH-CH=O → CH3-CH2-CH2-CH2OH
A) NaBH4
B) H2, nickel Raney
C) LiAlH4
D) Na, NH3 (l).
soluzione
NaBH4 è un riducente blando e riduce solo aldeidi e chetoni quindi non riduce il doppio legame
LiAlH4 riduce la maggior parte dei gruppi non saturi ad eccezione degli alcheni e degli alchini
Na ed NH3 viene utilizzata per la riduzione degli alchini
La riduzione con H2 e Nikel Raney è utilizzata in questo caso per ottenere
CH3-CH2-CH2-CH2OH
perchè si può ridurre sia il carbonile che il doppio legame.
La risposta corretta è B
48. I valori di pKa dellʼacido ossalacetico sono 2,22 e 3,98. Indicare il gruppo
carbossilico più acido e perché.
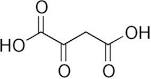 A) il carbossile adiacente al carbonile chetonico a causa dellʼeffetto induttivo di
questʼultimo.
B) il carbossile adiacente al carbonile chetonico per effetto di un legame idrogeno
intramolecolare.
C) il carbossile adiacente al metilene perché stericamente meno impedito
D) il carbossile adiacente al metilene a causa dellʼeffetto induttivo di
questʼultimo
soluzione
l'ossigeno del carbonile chetonico attrae verso di sé il doppietto elettronico e ciò provoca
una maggior attrazione degli elettroni che legano l'ossigeno all'idrogeno aumentando quindi l'acidità
della molecola.
risposta corretta A
49. Perché la condensazione di Claisen va a completezza solo se si mette a reagire un
estere con almeno due idrogeni α e una quantità equivalente (e non catalitica) di base?
A) il carbossile adiacente al carbonile chetonico a causa dellʼeffetto induttivo di
questʼultimo.
B) il carbossile adiacente al carbonile chetonico per effetto di un legame idrogeno
intramolecolare.
C) il carbossile adiacente al metilene perché stericamente meno impedito
D) il carbossile adiacente al metilene a causa dellʼeffetto induttivo di
questʼultimo
soluzione
l'ossigeno del carbonile chetonico attrae verso di sé il doppietto elettronico e ciò provoca
una maggior attrazione degli elettroni che legano l'ossigeno all'idrogeno aumentando quindi l'acidità
della molecola.
risposta corretta A
49. Perché la condensazione di Claisen va a completezza solo se si mette a reagire un
estere con almeno due idrogeni α e una quantità equivalente (e non catalitica) di base?
 +
+  CH3O , CH3OH ---- → β cheto estere
A) nellʼultimo stadio della reazione viene rimosso quantitativamente un protone dal β-chetoestere, che sposta
la reazione a destra
B) per ragioni steriche la base ha più accessibilità al carbonio a dellʼestere
C) lʼeffetto elettron-attrattore del carbonile estereo aumenta, stabilizzando il prodotto
D) il carbonile estereo risulta più elettrofilo e lʼequilibrio si sposta a destra
soluzione
La condensazione di due esteri è simile a quella delle aldeidi e dei chetoni con la differenza che la base
in questo caso non può essere forte come NaOH ma deve essere un alcossido che abbia gli stessi atomi
di C che l'estere di partenza ha legati all'ossigeno.
Per esempio nel caso dell'acetato di etile
CH3O , CH3OH ---- → β cheto estere
A) nellʼultimo stadio della reazione viene rimosso quantitativamente un protone dal β-chetoestere, che sposta
la reazione a destra
B) per ragioni steriche la base ha più accessibilità al carbonio a dellʼestere
C) lʼeffetto elettron-attrattore del carbonile estereo aumenta, stabilizzando il prodotto
D) il carbonile estereo risulta più elettrofilo e lʼequilibrio si sposta a destra
soluzione
La condensazione di due esteri è simile a quella delle aldeidi e dei chetoni con la differenza che la base
in questo caso non può essere forte come NaOH ma deve essere un alcossido che abbia gli stessi atomi
di C che l'estere di partenza ha legati all'ossigeno.
Per esempio nel caso dell'acetato di etile
 si userà l'etossido di sodio CH3CH2ONa (la parte destra della formula) mentre nel caso dell'acetato
di metile
si userà l'etossido di sodio CH3CH2ONa (la parte destra della formula) mentre nel caso dell'acetato
di metile
 si userà il metossido di sodio CH3ONa (la parte destra della formula).
E necessario che l'estere di partenza abbia almeno un atomo di idrogeno in alfa al carbonile
(con pKa pari a circa 25). Infatti il primo step della reazione è la deprotonazione (eliminazione di un
H+) in posizione alfa. L’estere di partenza deve possedere un secondo idrogeno in alfa affinché il
beta chetoestere che si ottiene abbia due idrogeni attivati che, come quelli dell’estere , sono partico-
larmente acidi (pKa circa 10). Questi idrogeni potranno eventualmente essere estratti da una base in
modo da spostare la reazione verso destra.
Da quanto visto, si osserva che la reazione di formazione del beta cheto estere deve necessariamen-
te avvenire tra 2 molecole una di estere ed una di enoato che deve pertanto essere presente in
quantità stechiometriche affinché si formi l'estere.
Alla fine della reazione si riforma l'enoato mediante protonazione con acido cloridrico.
la risposta corretta è A
50. Perché lʼanilina non subisce le reazioni di alchilazione e acilazione di
Friedel-Crafts?
si userà il metossido di sodio CH3ONa (la parte destra della formula).
E necessario che l'estere di partenza abbia almeno un atomo di idrogeno in alfa al carbonile
(con pKa pari a circa 25). Infatti il primo step della reazione è la deprotonazione (eliminazione di un
H+) in posizione alfa. L’estere di partenza deve possedere un secondo idrogeno in alfa affinché il
beta chetoestere che si ottiene abbia due idrogeni attivati che, come quelli dell’estere , sono partico-
larmente acidi (pKa circa 10). Questi idrogeni potranno eventualmente essere estratti da una base in
modo da spostare la reazione verso destra.
Da quanto visto, si osserva che la reazione di formazione del beta cheto estere deve necessariamen-
te avvenire tra 2 molecole una di estere ed una di enoato che deve pertanto essere presente in
quantità stechiometriche affinché si formi l'estere.
Alla fine della reazione si riforma l'enoato mediante protonazione con acido cloridrico.
la risposta corretta è A
50. Perché lʼanilina non subisce le reazioni di alchilazione e acilazione di
Friedel-Crafts?
 + CH3-CH2-Cl +
+ CH3-CH2-Cl +  ------------------> NESSUNA REAZIONE
AlCl3
A) il gruppo NH2 è un sostituente fortemente disattivante
B) la reazione di alchilazione o acilazione avviene preferenzialmente sul gruppo NH2
C) il doppietto elettronico sullʼazoto è responsabile della formazione di un complesso
acido-base di Lewis con lʼAlCl3, che altera gli effetti elettronici del gruppo NH2
D) il doppietto elettronico sullʼazoto è responsabile della formazione di un complesso acido-base di Lewis con
lʼAlCl3 che impedisce la reazione per ingombro sterico
soluzione
La reazione di friedel-Craft è la seguente:
alchilazione acilazione
------------------> NESSUNA REAZIONE
AlCl3
A) il gruppo NH2 è un sostituente fortemente disattivante
B) la reazione di alchilazione o acilazione avviene preferenzialmente sul gruppo NH2
C) il doppietto elettronico sullʼazoto è responsabile della formazione di un complesso
acido-base di Lewis con lʼAlCl3, che altera gli effetti elettronici del gruppo NH2
D) il doppietto elettronico sullʼazoto è responsabile della formazione di un complesso acido-base di Lewis con
lʼAlCl3 che impedisce la reazione per ingombro sterico
soluzione
La reazione di friedel-Craft è la seguente:
alchilazione acilazione
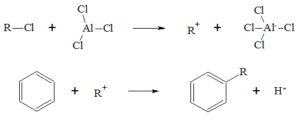
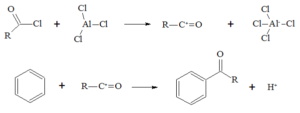 tuttavia, mentre per il benzene la reazione è possibile, essa non è realizzabile con
l'anilina perchè essendo l'azoto ibrido SP2 contribuisce con i suoi 2 elettroni liberi alla
delocalizzazione rendendo l'anello più stabile ed esercitando un effetto disattivante.
L'acilazione o l'alchilazione possono, tuttavia, avvenire in posizione para solo se si protegge l'anilina trasfor-
mando l' azoto SP2 in azoto SP3.
risposta corretta A
51. Indicare il prodotto finale della seguente serie di reazioni.
tuttavia, mentre per il benzene la reazione è possibile, essa non è realizzabile con
l'anilina perchè essendo l'azoto ibrido SP2 contribuisce con i suoi 2 elettroni liberi alla
delocalizzazione rendendo l'anello più stabile ed esercitando un effetto disattivante.
L'acilazione o l'alchilazione possono, tuttavia, avvenire in posizione para solo se si protegge l'anilina trasfor-
mando l' azoto SP2 in azoto SP3.
risposta corretta A
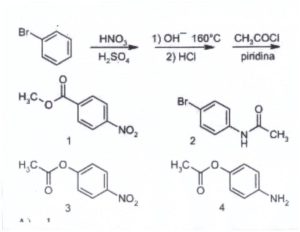
51. Indicare il prodotto finale della seguente serie di reazioni.
 A) 1
B) 2
C) 3
D) 4
soluzione
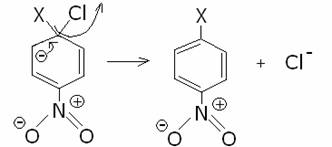
Si tratta di una sostituzione elettrofila aromatica (Nitrazione) seguita da una reazione
di acilazione.
La miscela nitrante di acido nitrico e solforico concentrati porta all'inserimento del gruppo NO2
sull'anello in posizione para rispetto al Bromo, che orienta il gruppo entrante in para (0ppure orto).
La prima fase della reazione è :
A) 1
B) 2
C) 3
D) 4
soluzione
Si tratta di una sostituzione elettrofila aromatica (Nitrazione) seguita da una reazione
di acilazione.
La miscela nitrante di acido nitrico e solforico concentrati porta all'inserimento del gruppo NO2
sull'anello in posizione para rispetto al Bromo, che orienta il gruppo entrante in para (0ppure orto).
La prima fase della reazione è :
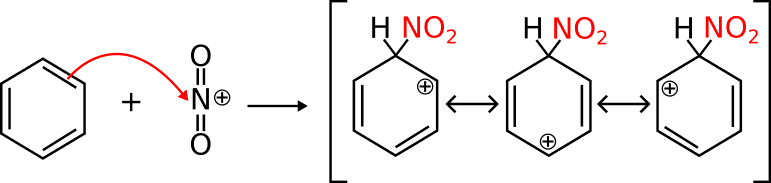
 essendo questa una situazione di instabilità, si ha
essendo questa una situazione di instabilità, si ha
 si ha cioè la formazione dello ione Nitronio (NO2+ ) che reagisce dando origine
al 4-bromo-nitrobenzene ( para nitro bromobenzene)
si ha cioè la formazione dello ione Nitronio (NO2+ ) che reagisce dando origine
al 4-bromo-nitrobenzene ( para nitro bromobenzene)
 secondo il meccanismo di nitrazione
secondo il meccanismo di nitrazione
 ------>
------>
 L'OH- della seconda reazione serve per eliminare H+ che si forma .
L'OH- della seconda reazione serve per eliminare H+ che si forma .
 ed il gruppo acilico che rappresentiamo con X dà luogo alla reazione :
(tieni presente Br al posto di Cl)
ed il gruppo acilico che rappresentiamo con X dà luogo alla reazione :
(tieni presente Br al posto di Cl)
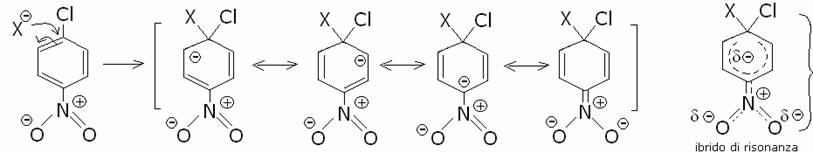 il nitrogruppo permette una maggiore delocalizzazione della carica negativa e quindi
una maggiore stabilità dell’intermedio e si forma
il nitrogruppo permette una maggiore delocalizzazione della carica negativa e quindi
una maggiore stabilità dell’intermedio e si forma
 da quanto detto si forma il composto n. 1. (non si può formare il n.3 pur essendo uguale
al n.1 per motivi sterici ).
la risposta corretta è A
52. Perché, rispetto alla pirrolidina, il pirrolo ha un momento dipolare orientato in
senso opposto, che indica un eccesso di densità elettronica sui carboni dellʼanello
aromatico
pirrolidina pirrolo
da quanto detto si forma il composto n. 1. (non si può formare il n.3 pur essendo uguale
al n.1 per motivi sterici ).
la risposta corretta è A
52. Perché, rispetto alla pirrolidina, il pirrolo ha un momento dipolare orientato in
senso opposto, che indica un eccesso di densità elettronica sui carboni dellʼanello
aromatico
pirrolidina pirrolo
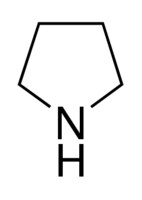
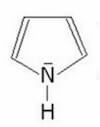 μ= 1,57 D ↑ μ = 1,80 D ↓
A) lʼaromaticità del pirrolo inverte lʼeffetto induttivo dellʼazoto.
B) nel pirrolo lʼeffetto elettron-donatore per risonanza dellʼazoto sovrasta il suo effetto
induttivo elettron-attrattore
C) nel pirrolo lʼeffetto induttivo elettron-donatore dellʼazoto sovrasta il suo effetto
elettron-attrattore per risonanza
D) lʼibridazione sp2dellʼazoto nel pirrolo diminuisce la sua elettronegatività, rendendo
il doppietto più disponibile ad essere condiviso con lʼanello
soluzione
nella pirrolidina abbiamo un effetto induttivo elettron donatore e quindi un momento di dipolo
orientato verso l'alto, mentre nel pirrolo oltre all'effetto induttivo si osserva anche un effetto elettron
attrattore dovuto alla delocalizzazione degli elettroni del C .La motivazione è che l'azoto della
pirrolidina è ibrido SP3 ed il doppietto elettronico dell'azoto non è delocalizzato , mentre nel pirrolo è
ibrido SP2 e si ha delocalizzazione con una variazione decisa del centro di massa delle cariche poichè
attrae verso di sè gli elettroni SP2 del pirrolo.
risposta corretta B
53. Le coppie di composti dicarbonilici che seguono possono dare addizione aldolica
intramolecolare in presenza di OH‒. Quale composto, in ciascuna coppia, fornisce più
facilmente un prodotto di addizione intramolecolare?
μ= 1,57 D ↑ μ = 1,80 D ↓
A) lʼaromaticità del pirrolo inverte lʼeffetto induttivo dellʼazoto.
B) nel pirrolo lʼeffetto elettron-donatore per risonanza dellʼazoto sovrasta il suo effetto
induttivo elettron-attrattore
C) nel pirrolo lʼeffetto induttivo elettron-donatore dellʼazoto sovrasta il suo effetto
elettron-attrattore per risonanza
D) lʼibridazione sp2dellʼazoto nel pirrolo diminuisce la sua elettronegatività, rendendo
il doppietto più disponibile ad essere condiviso con lʼanello
soluzione
nella pirrolidina abbiamo un effetto induttivo elettron donatore e quindi un momento di dipolo
orientato verso l'alto, mentre nel pirrolo oltre all'effetto induttivo si osserva anche un effetto elettron
attrattore dovuto alla delocalizzazione degli elettroni del C .La motivazione è che l'azoto della
pirrolidina è ibrido SP3 ed il doppietto elettronico dell'azoto non è delocalizzato , mentre nel pirrolo è
ibrido SP2 e si ha delocalizzazione con una variazione decisa del centro di massa delle cariche poichè
attrae verso di sè gli elettroni SP2 del pirrolo.
risposta corretta B
53. Le coppie di composti dicarbonilici che seguono possono dare addizione aldolica
intramolecolare in presenza di OH‒. Quale composto, in ciascuna coppia, fornisce più
facilmente un prodotto di addizione intramolecolare?
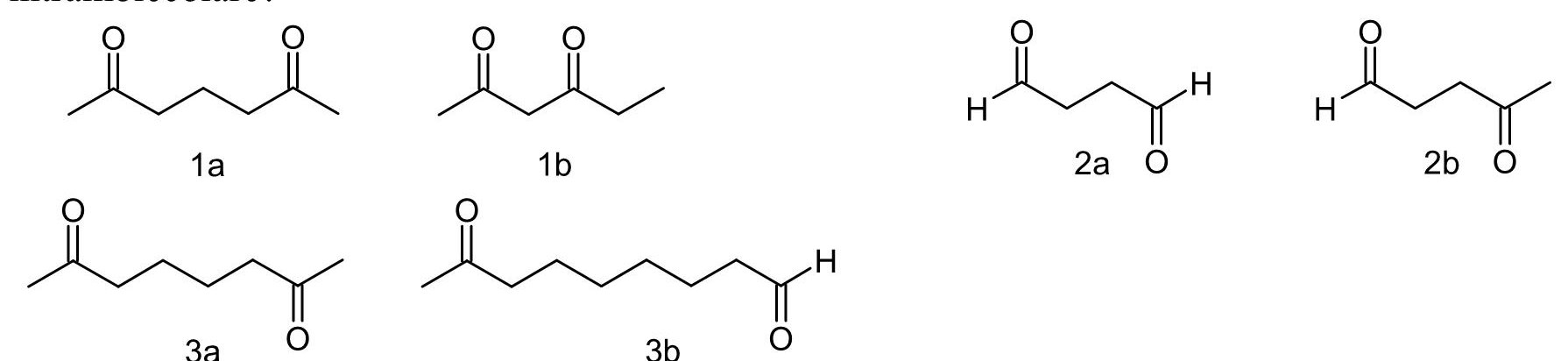
A) 1a, 2a, 3b
B) 1a, 2b, 3b
C) 1b, 2a, 3a
D) 1a, 2b, 3a
soluzione
L’addizione aldolica avviene tra un carbonio in posizione alfa e il carbonile di un’aldeide, l’addizione al carbonile di un chetone è più lenta. Se la reazione è intramolecolare, è favorita quella che chiude un anello a cinque o sei termini. I composti bicarbonilici possono dare una reazione di condensazione intramolecolare con formazione di un composto ciclico a 5 o 6 atomi (tale reazione è indicata come reazione di ciclizzazione di Dieckmann ):
dai composti del quesito si può notare che i composti in grado di effettuare una condensazione intramolecolare con formazione di anelli sono i composti 1a,2b,3a.
risposta corretta D
54. Una miscela di 0,10 mol di benzene e 0,10 mol di p-xilene è messa a reagire, in condizioni dinitrazione, con 0,10 mol di ione nitronio fino a che tutto il nitronio abbia reagito. Si ottengono dueprodotti: 0,02 mol di uno e 0,98 mol dellʼaltro. Qual è il prodotto più abbondante e perché?

A) nitrobenzene, per ragioni di ingombro sierico
B) nitrobenzene, per la maggiore reattività del benzene rispetto al p-xilene nelle sostituzioni elettrofile aromatiche
C) 1,4-dimetil-2-nitrobenzene, per la maggiore reattività del p-xilene rispetto al benzene nelle sostituzioni elettrofile aromatiche
D) 1,4-dimetil-2-nitrobenzene, per lʼinstaurarsi di legami idrogeno intramolecolari
soluzione
il legame metile-carbonio CH3-C ha un piccolo momento polare che causa un piccolo aumento di carica elettrica sul C adiacente al CH3: questo effetto si chiama: effetto induttivo elettron-repulsore e si indica con +I. Ne consegue che nel dimetilbenzene aumenta la disponibilità della nube elettronica dell’anello benzenico aumentandone quindi la reattività proprio vicino al C che è legato al metile, cioè in posizione orto (in questo caso sul C in posizione 2 dell’anello) per cui le reazioni elettrofile avvengono preferibilmente in una molecola che possiede gruppi metilici legati all’anello benzenico anziché sulla molecola di benzene
Ne consegue che l’ 1,4 dimetil- 2- nitrobenzene si forma è in quantità di gran lunga superiori al nitrobenzene che non presenta alcun effetto induttivo.
risposta corretta B
55. Qual è lo ione più stabile in ciascuna coppia?
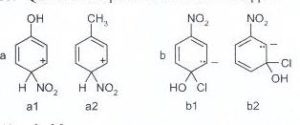
A) al e b2
B) a2 e b2
C) al e bl
D) a2 e bl
soluzione
la risposta consiste nella valutazione degli effetti induttivi dei gruppi legati all’anello benzenico.
Il gruppo nitro è uno dei più forti gruppi ad attrazione elettronica, quindi è un forte disattivante. Il motivo risiede nel fatto che sia l’azoto che i 2 atomi di ossigeno sono ibridi SP2 complanari con gli orbitali π dell’anello benzenico e quindi gli elettroni dell’anello si delocalizzano verso questo gruppo. Questo crea sull’anello un decremento di carica negativa e la formazione di una carica positiva.( EFFETTO MESOMERICO) . Se fosse presente solo NO2, le due molecole a1 e a2 dovrebbero avere uguale reattività. Tuttavia, in a1 è presente il gruppo OH in posizione para rispetto ad NO2 ed in a2 vi è il gruppo CH3 che invece sono elettrondonatori con effetto di aumentare la densità elettronica sul benzene. Dal momento che OH ha un effetto di gran lunga superiore a CH3 (infatti l’ossigeno possiede 2 doppietti elettronici non impegnati (lone pair), il bilanciamento della carica elettronica tra attrazione di NO2 e repulsione di OH stabilizza meglio la distribuzione elettronica in 1a anziché in 1b per cui 1a è più stabile.
Nella seconda coppia vi sono due gruppi OH e Cl che superano di gran lunga l’effetto di NO2 e si crea una carica negativa sull’anello.Tuttavia, la molecola più stabile per motivi sterici è al molecola 1 b .
la risposta corretta al quesito è pertanto C
56. Il glutatione è un tripeptide formato da acido glutammico, cisteina e glicina. Cosa cʼè di inusuale nella sua struttura?
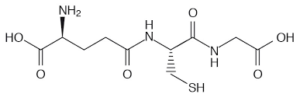
A) il residuo di cisteina è in forma ridotta
B) il residuo di acido glutammico è connesso alla cisteina attraverso il carbossile in catena laterale
C) il tripeptide ha carica netta negativa
D) lʼassenza di un ulteriore legame peptidico
soluzione
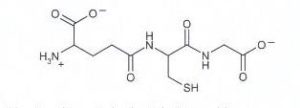
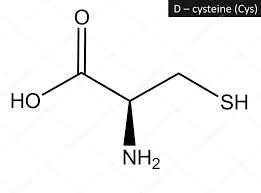
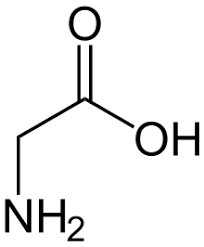
acido glutammico cisteina glicina

acido (2S)-2-ammino-5-[[(2R)-1-(carbossimetilammino)-1-osso- 3-solfanilpropan-2-il]ammino]-5-ossopentanoico
Il glutatione è un forte antiossidante, uno dei più importanti tra quelli che l’organismo è in grado di produrre.Svolge un’importante azione nei globuli rossi proteggendoli dalle ossidazioni che causerebbero la rottura del globulo (emolisi).Elemento importante per il suo funzionamento è il NADPH (Nicotinammide adenin dinucleotide fosfato). Tale molecola è un derivato della vitamina pp (acido nicotinico) e funziona da cofattore ossido-riduttivo dell’enzima glutatione reduttasi (o GSR). L’enzima rigenera il glutatione ridotto (GSH) a partire da glutatione ossidato (o GSSG) attraverso gli elettroni ceduti dal NADPH al Glutatione ossidato.
Ciò detto, dall’esame della molecola si vede che l’acido glutammico lega la cisteina con il residuo carbossilico terminale, per cui si deduce che la risposta corretta è B
57. La reazione di Mannich è la reazione tra un composto carbonilico enolizzabile (nucleofilo) e uno ione immonio (elettrofilo) generato in situ a partire da unʼaldeide e da unʼammina secondaria. Individuare i reattivi necessari per generare il composto 1 tramite lo schema di Mannich proposto.
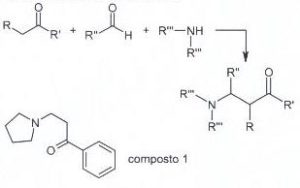
A) benzoato di metile, formaldeide e pirrolidina
B) acetofenone, formaldeide e pirrolidina
C) acetofenone, acetaldeide e pirrolidina
D) acetofenone, formaldeide e dietilammina
soluzione
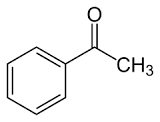
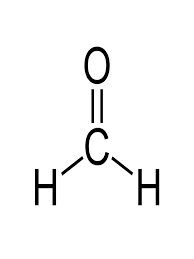
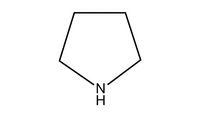
il meccanismo inizia con la formazione di uno ione imminio dalla reazione tra il composto azotato pirrolidina e formaldeide in ambiente acido.
il chetone tautomerizzato in forma enolica può attaccare lo ione imminio per formare il composto 1
La risposta corretta al quesito è B
58. La piridina è meno reattiva del benzene nei confronti della sostituzione elettrofila aromatica, ma è possibile aumentarne la reattività trasformandola temporaneamente in un suo derivato. Identificare quale, tra quelli proposti, è il derivato più reattivo.
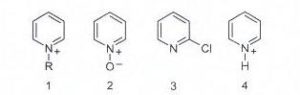
A) 1, per lʼeffetto elettron-donatore del gruppo alchilico R
B) 2, per lʼeffetto elettron-donatore dellʼossigeno
C) 3, per lʼeffetto elettron-donatore del cloro
D) 4, per lʼeffetto della protonazione dellʼazoto
soluzione
tra i composti presentati, è evidente che è l’ossigeno in grado di fornire una maggior quantità di elettroni all’azoto e quindi rendendo disponibile una maggior quantità di elettroni all’anello favorendo più degli altri le reazioni elettrofile.
La risposta corretta è B
59. Determinare la configurazione assoluta dei centri stereogenici nel seguente composto
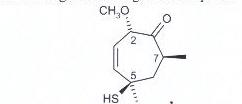
A) 2R, 5S, 7R
B) 2S, 5R, 7S
C) 2S, 5S, 7R
D) 2R, 5R, 7S
soluzione
l’assegnazione R o S dei centri stereogenici non è altro che la la configurazione di Cahn-Ingold-Prelog che dipende dall’ordine con cui i vari sostituenti sono disposti intorno all’atomo asimmetrico. Secondo questo metodo i sostituenti legati allo stereocentro vengono numerati in base all’ordine di importanza e successivamente si orienta la molecola in modo tale che il sostituente a più bassa priorità sia posizionato lontano dall’osservatore mentre gli altri tre gruppi sempre legati allo stesso centro stereogenico siano orientati verso l’osservatore e si osserva la direzione verso cui è indirizzato il percorso partendo dalla priorità maggiore e finendo a quello con priorità minore.
Se il percorso è in senso orario si attribuisce la configurazione R
Se il percorso è antiorario si attribuisce la configurazione S
più alto o è il numero atomico, più alta è la priorità.
L’idrogeno, con massa atomica di 1 , ha la più bassa priorità non soltanto rispetto ai suoi isotopi, ma anche rispetto a tutti gli altri elementi della tavola periodica.
La più bassa priorità in assoluto spetta al doppietto di elettroni non condiviso. Se non si può assegnare una priorità sulla base del numero atomico dell’atomo legato allo stereocentro, perché ad esempio sono legati due atomi uguali, si va al set di atomi successivi loro legati.

nel caso in esame al C stereocentro 2 la priorità è O CH3O CH CH e quindi il CH è orientato verso l’osservatore e poi partendo da O si arriva a CH3O poi a CH con percorso verso sinistra cioè antiorario :pertanto il C2 ha configurazione S
Con lo stesso procedimento si vede che il C5 ha configurazione R mentre il C 7 ha configurazione S
la risposta corretta è B
60. Lʼanestetico locale procaina è soggetto ad una rapida idrolisi enzimatica, mentre la lidocaina ha una maggiore resistenza allʼidrolisi. Quale delle seguenti caratteristiche strutturali può ragionevolmente
spiegare il comportamento della lidocaina?
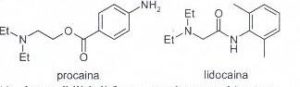
A) la possibilità di formare un legame a idrogeno intramolecolare
B) la differente posizione del gruppo carbonilico sulla catena
C) la presenza di un gruppo ammidico e lʼingombro sterico dei due gruppi metilici sullʼanello aromatico
D) lʼassenza del gruppo amminico sullʼanello aromatico
soluzione
Intanto possiamo dire che l’idrolisi di un estere è sempre più veloce di una idrolisi di un ammide, inoltre nel caso in esame,la struttura della lidocaina rispetto alla procaina è più compatta nel senso che i gruppi metilici sull’anello aromatico formano un forte impedimento all’idrolisi e proteggono l’ammide dall’attacco idrolitico.
la risposta corretta è C
Lascia un commento