GIOCHI DELLA CHIMICA 2013 FASE NAZIONALE CLASSI A.B.C
1. Un campione di Fe2O3 reagisce con un eccesso di CO ad alta temperatura secondo la seguente reazione:
Fe2O3 + 3 CO →3 CO2 + 2 Fe
Indicare la resa in massa percentuale della reazione se da 6,50 g di ossido di ferro(III) si ottengono 3,85 g di Fe metallico:
A) 59,2 % B) 69,9 % C) 76,3 % D) 84,7 %
soluzione
se da Fe2O3 si ottengono 2 di Fe da 6,5 g in teoria dovremmo ottenerne X
159,7 : 2 x 55,85 =6,5 : X X= 111,7 x 6,5/159,7= 4,546 g
considerato che se ne ottengono 3,85 g allora il rendimento è
4,546:3,85 =100:X X=84,7 %
risposta corretta D
2. Indicare la [Na+ ] finale in una soluzione preparata mescolando 70 mL di una soluzione di Na2SO4 3,00 M con 30 mL di una soluzione di NaCl 1,00 M, ammettendo i volumi additivi:
A) 2,00 M B) 2,40 M C) 4,00 M D) 4,50 M
soluzione
ricordiamo che la quantità di una sostanza in soluzione è calcolata da
Volume in litri x Concentrazione= Moli (o equivalenti)
Volume in ml x Concentrazione = millimoli (o milliequivalenti)
quindi la quantità di Na+ in 70 ml di una soluzione 3 M di Na2SO4 è:
millimoli di Na+ = 70 x 3 =210 millimoli provenienti da Na2SO4
a cui si aggiungono le millimoli di Na+ provenienti da 30 ml di soluzione di NaCl 1 M
30 x 1 = 30 millimoli provenienti da NaCl
in totale abbiamo quindi 240 millimoli cioè 0,24 moli contenute in un volume finale di 100 ml
Pertanto, ricordando che la concentrazione Molare deve essere espressa in Moli/litro, se in 100 ml vi sono 0,24 Moli, in 1000 ve ne saranno X da cui X= 0,240 x 1000 /100
X = 2,4 M
risposta corretta B
3. In un sale di potassio di formula K2S2Ox la percentuale in massa di O è il 36 %. Ciò permette di individuare la formula dell’anione dell’acido:
A) S2O3 2- B) S2O5 2- C) S2O7 2- D) S2O8 2-
soluzione
se l’ossigeno è il 36 % nella formula K2S2Ox il resto cioè S e K saranno 100-36 cioè il 64%
il peso molecolare PM di K2S2Ox contiene quindi il 64 % in peso dovuto a 2 atomi di K+2 atomi di S pertanto possiamo calcolare il PM dalla proporzione essendo il PM il 100%
nel PM :vi sono 2 S + 2 K = come in 100 : ve ne sono 64 PM = 100 x 2x 32 + 2 x 40 / 64
PM = 144x 100/64 = 225
Poichè il peso della molecola è 225 g e gli elementi S e K sono contenuti in quantità pari a 144 g allora la quantità di ossigeno è O = 225-144= 81 g che corrispondono ad 81/16 = 5 atomi
La formula è pertanto K2S2O5 quindi lo ione è S2O5-2
risposta corretta B
4. Indicare la molarità M di una soluzione di glucosio (C6H12O6) 0,396 m se la sua densità è pari a 1,16 g mL-1 : A) 4,29 ·10-1 M B) 2,15 ·10-1 M C) 1,10 ·10-1 M D) 8,10 ·10-1 M
soluzione
sappiamo che con m si indica la molalità (moli soluto/Kg solvente) e 0,396 molale significa che in 1 Kg vi sono 0,396 moli per cui ricordando che m=g/PM
la quantità in grammi di glucosio è 0,396 x 180,15= 71,33 g
ma essendo la densità 1,16g /ml vuol dire che 1 ml pesa 1,16 g
71,33 x 1,16= 82,74 g
quindi la quantità totale 1000 + 71,33 g cioè 1071,33 g
ma essendo la densità 1,16g /ml vuol dire che 1 ml pesa 1,16 g
82,74 g che corrispondono a 82,74/PM glucosio(180,15) = 0,459 moli
cioè 0,459 moli in 1071,33 g o meglio in 1071,33 ml (essendo la densità del solvente acqua =1
(Questo significa che 1071,33 g corrispondono 1071,33 ml)
per calcolare la Molarità (moli /Litro) ricorriamo alla semplice proporzione:
se in 1071,33 ml vi sono 0,459 moli allora in 1000 ml (1 litro) ve ne saranno X
1071,33 :o,459 =1000 😡 X= 0,429 moli /litro
la molarità è quindi M = 0,429
risposta corretta A
5. La concentrazione di un soluto in una soluzione è una proprietà: A) estensiva B) intensiva C) colligativa D) chimica
soluzione
intensive sono le proprietà della materia che non dipendono dalla quantità o dalle dimensioni del corpo in esame ma dipende dalla sua propria natura e dallo stato in cui si trova. Al contrario, una proprietà si dice estensiva se il suo valore dipende dalle dimensioni del corpo.
Esempi di proprietà intensive sono : TEMPERATURA, PRESSIONE, DENSITA’
Esempi di proprietà Estensive sono: MASSA, VOLUME, ENTALPIA, ENTROPIA
Le proprietà colligative sono quelle proprietà DI UNA SOLUZIONE che dipendono dal numero di particelle che vi sono e non dalla loro natura.
Esempi di proprietà colligative sono:
ABBASSAMENTO DELLA TENSIONE DI VAPORE,
INNANZAMENTO DELLA TEMPERATURA DI EBOLLIZIONE ,
ABBASSAMENTO CRIOSCOPICO,
LA PRESSIONE OSMOTICA
Una proprietà chimica è una proprietà intrinseca della materia che può permettere trasfomazioni come ad esempio
AFFINITA’ CHIMICA ,ACIDITA’,ALCALINITA’, IGROSCOPIA, GRADO DI DISSOCIAZIONE, COSTANTE DI EQUILIBRIO ECC.
POICHE’ LA CONCENTRAZIONE DIPENDE DALLA QUANTITA’ DI SOSTANZA E’ UNA PROPRIETA’ INTENSIVA
risposta corretta B
6. Indicare il coefficiente di OH- nella seguente reazione dopo averla bilanciata con i coefficienti interi più piccoli: Br2 + OH- → Br- + BrO3 – + H2O
A) 3 B) 6 C) 12 D) 18
la reazione è una dismutazione (in cui uno stesso elemento si ossida e si riduce contemporaneamente)
5[½Br2 +e → Br-
1[½Br2 + 6 OH- + 5e → BrO3- + 3H2O
___________________________________
6 Br2 + 6OH- → 5 Br- + BrO3- + 3 H2O
il coefficiente di OH- è 6
risposta corretta B
7. Una soluzione di MgCl2 che contiene il 5 % di Mg in massa ha densità di 1,17 g / mL. Indicare la quantità in moli di Cl presenti in 300 mL di soluzione:
A) 0,368 mol B) 0,627 mol C) 0,737 mol D) 1,45 mol
soluzione
Consideriamo 100 g di soluzione.
essendo la densità = 1,17 g/volume
volume = 100g/1,17 = 85,47 mL
In essa sono contenuti 5 grammi di Mg (Pa=24,305) che corrispondono a 5/24,305 moli
moli di Mg = 5/24.305= 0,206 in 85,47 ml
Poichè nel composto MgCl2 le moli di Cloro sono il doppio delle moli di Mg allora
moli di Cl in 85,47 ml= 0,206 x 2= 0,412 moli
le moli contenute in 300 mL si calcolano dalla una proporzione:
se in 85,47 ml vi sono 0,412 moli di cloro in 300 ml ve ne saranno X
cioè 0,412 : 85,47 = x : 300
x = 300 x 0,412/85,47 = 1,45
le moli di Cl contenute in 300 ml di soluzione sono 1,45
risposta corretta D
8. Due campioni di gas, uno di Ar e l’altro di He, hanno uguali T, P e V. Ammettendo che i due campioni si comportino come gas ideali, indicare l’affermazione corretta:
A) il campione di He contiene più atomi di quello di Ar e gli atomi di He hanno maggiore velocità media
B) i due campioni hanno uguale numero di atomi ma gli atomi di elio hanno maggiore velocità media
C) i due campioni hanno uguale numero di atomi che hanno uguale velocità media
D) i due campioni hanno uguale numero di atomi ma gli atomi di Ar hanno maggiore velocità media
soluzione
essendo i due gas nelle stesse condizioni di temperatura e pressione contengono un ugual numero di molecole infatti P1V1=n1 RT1 e P2V2=n2RT2 da cui si ha che n1=n2. Poichè 1 mole di una qualunque sostanza è costituita da 6,02 x 10 ²³ molecole ne consegue che il numero di molecole sia di He che di Ar sono uguali essendo nelle condizioni date n1=n2. La velocità di una molecola invece sappiamo che è data da E=½ mV² da cui V² = 2E/m e poichè non tutte le molecole di uno stesso gas hanno uguale velocità, questa si esprime come velocità media cioè la media delle velocità di tutte le molecole del gas. Pertanto, 1 mole di He pesa 4 g mentre una mole di Ar 39,9 g ne consegue che l’elio si muove più velocemente dell’argo infatti V ² = 2 E / 4 mentre per Ar si ha V²= 2E /39,9 quindi,essendo i due gas alla stessa temperatura possiedono uguale energia ed a parità di energia, l’elio possiede una velocità media maggiore.
Risposta corretta B
9. Nella tabella sono riportati tre composti organici e i loro punti di ebollizione (p.e.). Formula CH3CH2CH3 CH3OCH3 CH3CHO p.e. 231 K 250 K 294 K L’andamento crescente dei valori si spiega meglio se si considerano:
A) i loro legami covalenti
B) le attrazioni dipolo-dipolo
C) le forze di dispersione di London
D) i legami a idrogeno
soluzione
L’andamento crescente dei valori dei punti di ebollizione non si può spiegare certamente per i loro legami covalenti nè per i legami idrogeno nè tantomeno per le forze di London. Infatti, dalla struttura delle molecole in esame, possiamo osservare che CH3CH2CH3 è un alcano lineare con un numero dispari di atomi di carbonio e presenta un dipolo elettrico permanente dovuto alla ibridazione sp3 dei carboni. (Per un alcano lineare con numero pari di atomi di carbonio questo non accade poiché a tale dipolo ne corrisponde un altro in direzione opposta).
Nell’acetone CH3COCH3 l’ossigeno è più elettronegativo del carbonio e, quindi, il carbonile ha un momento dipolare permanente con l’estremità negativa del dipolo localizzata sull’atomo di ossigeno; infatti, l’acetone ha momento dipolare μ = 2.88 D. Analogo momento dipolare si osserva per l’aldeide acetica che in questo caso ha un maggiore punto di ebollizione in quanto a causa della presenza del dipolo permanente, si instaurano anche attrazioni tra i dipoli e le molecole vicine con un’attrazione dipolo-dipolo cui si aggiunge un ‘attrazione dell’ossigeno di una molecola nei confronti dell’idrogeno di una molecola vicina.
Ne consegue che la risposta corretta è B
10. Indicare la soluzione acquosa con il punto di ebollizione più vicino a quello di una soluzione 0,30 M di fruttosio (C6H12O6):
A) 7,5 ·10-2 M AlCl3
B) 1,5 ·10-1 M CuCl2
C) 3,0 ·10-1 M NaCl
D) 6,0 ·10-1 M glucosio (C6H12O6 )
soluzione
Il calcolo della temperatura di ebollizione è effettuato da ΔT = Keb x molalità x numero di particelle
pertanto
ΔT = 0,51 x 0,3 x 1 = 0,153 per il fruttosio
ΔT = 0,51 x 0,075 x 4 = 0,153 per AlCl3
ΔT = 0,51 x 0,15 x 3 = 0,229 per CuCl2
ΔT = 0,51 x 0,3 x 2 = 0,306 per NaCl
ΔT = 0,51 x 0,6 x 1 = 0,306 per glucosio
la risposta corretta è A
11. Indicare la serie che riporta gli acidi in ordine di acidità crescente in acqua:
A) H3BO3 < H3PO4 < HClO3
B) HClO3 < H3BO3 < H3PO3
C) H3PO4 < HClO3 < H3BO3
D) H3BO3 < HClO3 < H3BO4
soluzione
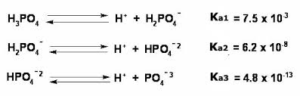
12. Completare in modo corretto. Nel passaggio da atomo neutro a ione, un atomo: A) perde o acquista protoni
B) perde o acquista elettroni
C) trasforma neutroni in elettroni e protoni
D) perde o acquista cariche positive
soluzione
ovviamente nella formazione di uno ione positivo (Catione) si ha perdita di elettroni mentre nella formazione di uno ione negativo si ha un acquisto di elettroni
es Na – 1 e = Na+ Cl + 1 e = Cl-
risposta corretta B
13. Una possibile definizione dell’energia di affinità elettronica (Eae espressa in kJ/mol di atomi) afferma che essa rappresenta:
A) la variazione di energia che si osserva quando una mole di atomi allo stato gassoso acquista una mole di elettroni dall’esterno
B) l’energia che bisogna fornire a una mole di atomi in fase gassosa per estrarre una mole di elettroni, i più facili da estrarre
C) la tendenza ad attrarre gli elettroni di un legame a cui un atomo partecipa
D) l’energia che un atomo spende nel formare un legame ionico
soluzione
per definizione l’affinità elettronica è la quantità di energia in KJ/mole rilasciata o assorbita, quando viene aggiunto 1 elettrone ad un atomo neutro isolato in condizioni di gas monoatomico per formare uno ione gassoso con una carica -1 . La maggior parte degli elementi hanno affinità elettronica negativa (processo favorevole dal punto di vista energetico e viene quindi rilasciata energia) ciò significa che questi atomi non hanno bisogno di energia per acquistare un elettrone, anzi la rilasciano.L’affinità elettronica generalmente aumenta verso l’alto all’interno di ogni gruppo della tavola periodica e verso destra in ogni periodo.
La risposta corretta è A
14. Indicare la sostanza che, in acqua, è un elettrolita debole:
A) NaCl
B) HCl
C) NaOH
D) HCN
soluzione
NaCl, HCl, NaOH sono elettroliti forti che si dissociano completamente in acqua mentre HCN è un acido debole che si dissocia in HCN<==> H+ + CN- con una costante di dissociazione acida pari a Ka= 6,3 x 10-10 il che significa che in soluzione HCN fornisce una [H+]= √KaConc.acido = √Ka x Ca quindi ad esempio per una concentrazione 1 M di HCN la [H+] =√6,3 x 10-10 quindi [H+]=2,5 x 10 –5 una quantità piccolissima rispetto alla [H+] di HCl 1 M oppure [H+] di NaOH 1 M calcolabile da [H+]= 10-14 / [OH-]
risposta corretta D
15. Indicare la massa in g di HCl presente in 100 mL di una soluzione acquosa 1 M dell’acido:
A) 3,98 g
B) 0,25 g
C) 3,65 g
D) 2,34 g
soluzione
la Molarità è definita come “ la quantità di moli contenuta in 1000 ml ( 1 litro) di soluzione. Pertanto poichè una mole di HCl pesa 36,5 g 1 M significa che in 1000 cc vi sono 36,5 g.
Pertanto, poiché in 1000 ml vi sono 36,5 g in 100 ve ne sono X
1000: 36,5 = 100: X X = 3,65 g
16. In1dicare l’elemento più elettronegativo: A) O B) Na C) F D) Cl
soluzione
l’elettronegatività è la tendenza di un atomo ad attrarre verso di sé gli elettroni di un legame.
Se due atomi che formano un legame possiedono elettronegatività diversa, allora si crea un dipolo e quindi un momento dipolare ![]()
Per esempio,nell’acqua l’ossigeno attrae verso di sé gli elettroni del legame O ←H creando sull’ossigeno una carica parziale negativa e sull’idrogeno una carica parziale positiva.
- Scala di Pauling
- Scala di Mulliken
- Scala di Allred-Rochow
Nella scala di Mulliken l‘elettronegatività è definita semplicemente come la media aritmetica tra l’ energia di ionizzazione Eae l’affinità elettronica I
Questa scala è correlata con la scala di Pauling ed una formula che mette in relazione i due valori è:
La scala di Allred-Rochow si basa sull’idea che un elettrone è attratto da un atomo per effetto della forza di coulomb esercitata dal nucleo:
dove Z* è la carica nucleare efficace ; l’elettronegatività è proporzionale a questa forza
dove r è il raggio covalente dell’atomo e le costanti numeriche sono tali da ottenere dei valori compatibili con la scala di Pauling.
Nella tabella periodica i valori diminuiscono procedendo dall’alto verso il basso lungo un gruppo ed aumentano lungo un periodo. Dalla tavola periodica si evince che il Fluoro F ha una elettronegatività pari a 3,98 ; l’ossigeno 3,44 il sodio o,93 ed il cloro 3,16 pertanto la risposta corretta è C
18. Secondo la teoria di Broensted e Lowry una sostanza si comporta da acido quando: A) cede (si lascia strappare) un protone a (da) un’altra che lo accetta e si comporta da base B) in acqua è completamente dissociata in ioni H + e A C) forma un sale con una base D) accetta una coppia di elettroni da una sostanza che si comporta da base
soluzione
Secondo Broensted e Lowry un acido è una qualunque sostanza contenente la specie H+ ma che è in grado di cederla ad un altra che accettandola si comporta da base.
Per esempio HCl in acqua si dissocia in H+ e Cl- e si comporta da acido perché cede all’acqua H+ che l’accetta comportandosi quindi da base :
H+ + H2O → H3O+ (ione idronio)
Ricordiamo che lo ione idronio H3O+ si comporta esattamente come se fosse H+ e spesso sostituiamo la specie H3O+ con H+
19. Indicare il nome corretto IUPAC dei due ioni Na+ e Cl- : A) ione sodio e ione cloro B) anione sodio e ione cloruro C) catione sodio e anione cloro D) ione sodio e ione cloruro
soluzione
la corretta definizione IUPAC di Na+ e Cl- è ione Sodio per Na+ e ione Cloruro per Cl- Infatti nei composti binari il cloro rappresenta l’elemento che viene scritto a destra nella formula .Per es. il nome del composto NaCl è Cloruro di Sodio.
20. L’anidride carbonica a temperatura e pressione ordinaria è: A) un gas velenoso B) un solido atossico C) un gas inadatto alla respirazione D) un liquido bassobollente.
soluzione
La respirazione è un processo metabolico energetico degli organismi attraverso il quale si ha l’ossidazione dei composti organici. Il processo aerobico, negli esseri viventi consuma ossigeno e produce anidride carbonica.Ciò indica che l’anidride carbonica è un prodotto della respirazione ed è inadatto ad essere utilizzato dagli organismi aerobici.
21. In una reazione di ossidazione c’è sempre una specie che: A) si ossida e un’altra che funge da riducente B) si ossida e una che si riduce C) si ossida e funge da ossidante D) si riduce ed è anche detta riducente
soluzione
una reazione REDOX è una reazione in cui si ha un’ossidazione ed una contemporanea riduzione. Non può esistere un’ossidazione senza un ossidante il quale contemporaneamente si riduce.
Per ossidazione si intende un processo in cui un atomo aumenta il proprio numero di ossidazione cedendo elettroni all’ossidante
Per riduzione si intende un processo in cui un atomo diminuisce il proprio numero di ossidazione acquisendo elettroni dalla sostanza che si ossida e che agisce pertanto da riducente.
(L’ossidante si riduce ed il riducente si ossida)
per esempio la reazione
Fe+2 → Fe+3 + e
è un’ossidazione che può avvenire solo in presenza di un ossidante ad es. HNO3 il quale nell’ossidare il ferro, si riduce secondo la reazione
NO3- + 3e → NO + 2H2O
la reazione globale è
3[Fe+2 → Fe+3 + e
1[NO3- + 3e → NO + 2H2O
___________________________
3Fe+2 + NO3- → 3 Fe+3 + NO + 2H2O
i coefficienti 3 ed 1 rappresentano lo scambio di elettroni.
22. Rispetto all’acqua pura, una soluzione di NaCl è: A) più basica B) più acida C) ha uguale contenuto di ioni idrossonio e ossidrilici D) più o meno acida a seconda della concentrazione molare del sale
soluzione
Una soluzione è acida se in soluzione predominano gli ioni H+ mentre è basica se predominano gli ioni OH–
Sappiamo che l’H2O si dissocia in H+ ed OH- ma le quantità di H+ ed OH- generate sono uguali, infatti
2H2O<=> H3O+ + OH-
questa è una reazione in equilibrio per cui possiede una Keq= [H3O+] [OH-]/[H2O]²
poichè H3O+ si comporta esattamente come se fosse H+ allora possiamo scrivere:
H2O<=> H++ OH- e Keq = [H+][OH-] /[H2O] =1,8018 x 10– 16 a 25° ed 1 atm
ma la [H2O] espressa in moli /litro di H2O è data da
[H2O] = grammi H2O in 1 litro/PMH2O
ma i grammi di 1 litro (1000ml) di acqua, essendo la densità a 25° ed 1 atm pari ad 1, sono 1000 g per cui
[H2O] = 1000 g/18 = 55,56 per cui, moltiplicando Keq x 55,56 si ottiene il valore 1 x 10-14
che viene indicato come costante di dissociazione dell’acqua e si indica con Kwater cioè Kw perciò essendo
Kw= [H+][OH-] possiamo calcolare [H+] e [OH-] infatti essendo [H+]=[OH-]
[H+]² = 10-14 moli/L
[OH-]² = 10-14 moli/L
da cui [H+] =[OH-] = 10-7 moli/litro
Questo comporta che nessuna delle due specie chimiche è preponderante rispetto all’altra e quindi l’acqua è neutra cioè non è nè acida nè basica.
NaCl è un sale che sciogliendosi in acqua dà origine alle due specie ioniche Na+ e Cl- in quantità uguali, e come si vede ciò non modifica in alcun modo il contenuto di H+ o di OH- della soluzione.NaCl è un sale Neutro.
Si deduce che la risposta corretta è C
23. I nitriti alcalini sono: A) alcaloidi ad elevato peso molecolare B) sali dell’acido nitroso con potere antiossidante C) sottoprodotti che si formano per azione di batteri nei salumi avariati D) sali di ammonio usati come fertilizzanti in agricoltura
soluzione
Gli alcaloidi sono sostanze organiche di origine vegetale contenenti gruppi amminici NH2 che conferiscono alle molecole caratteristiche basiche.
I sali di ammonio quaternari sono sali in cui un atomo di azoto è legato a 4 gruppi atomici organici R per formare lo ione ammonio quaternario R₄N⁺. Sono usati come disinfettanti oppure come fertilizzanti.
I nitriti sono sali dell’acido nitroso HNO2 e sono adoperati come conservanti alimentari con la sigla E250 . Sono usati soprattutto nei prodotti a base di carne (in scatola, prosciutto,pancetta ecc.).Essi inibiscono la crescita di microorganismi dannosi alla salute ed inibiscono l’ossidazione dei lipidi che causano il sapore rancido. Inibiscono anche lo sviluppo del botulino nei cibi conservati perché inibiscono i centri di Fe e S necessari allo sviluppo del botulino ma non è efficace contro salmonella ed escherichia coli.
24. La formula dell’idrogenocarbonato di calcio è:
A) CaCO2 B) CaHCO3 C) Ca(HCO3)2 D) CaOH(CO3)2
soluzione
Il calcio ha n.o. +2 e l’idrgenocarbonato o carbonato acido di calcio è HCO3- ne consegue che la formula dell’idrogenocarbonato di calcio è il prodotto tra Ca+2 + HCO3-1
da cui è possibile vedere che occorrono 2 molecole di HCO3- per neutralizzare le due cariche positive del Ca+2
pertanto
Ca+2 + 2 HCO3-1 → Ca( HCO3)2
che è la formula dell’idrogeno carbonato di calcio oppure carbonato acido di calcio
25. Indicare il nome internazionale (IUPAC) del composto P2O5 e il numero di ossidazione del fosforo:
A) ossido di fosforoV; N.O. = 5+
B) pentossido di difosforo; N.O. = +5
C) pentossido di difosforo; N.O. = 5+
D) perossido di difosforo; N.O. = +5
soluzione
secondo la nomenclatura IUPAC degli ossidi, il nome viene definito indicando prima il numero di atomi di ossigeno, quindi in questo caso pentossido poi il numero di atomi di fosforo quindi di difosforo ed infine si indica il numero di ossidazione
Il composto P2O5 è pertanto il pentossido di difosforo. Il numero di ossidazione del fosforo è N.O. +5. perchè il pentossido di fosforo ha la seguente struttura
In questo caso l’ossigeno è più elettronegativo del P per cui il fosforo ha un N.O. col segno + e siccome l’ossigeno è legato ad un atomo di P con 5 legami, ogni atomo di P ha n.o.5 quindi il N.O. del P in P2O5 è +5.
Per ottenere rapidamente il n.o del P in P2O5 è sufficiente moltiplicare il numero di atomi di O per +2 e dividere per il numero di atomi di fosforo quindi n.o.P in P2O5 = +2 x 5 /2 =5 )
Per esempio il n.o dell’azoto nella molecola NO2 è +2 x 2 /1 =4
il n.o del Cr nella molecola K2Cr2O7 è +2 x 7 /2 =14 -2 /2 poichè in questo caso occorre sottrarre 2 in quanto il Cr è legato anche al K che è meno elettronegativo perciò
K2Cr2O7 = +2 x 7 /2 =14 -2 /2
il n.o. dello S in H2SO4 è (4x +2 ) -2 =8-2=6
il n.o. del Cl in HClO3 è (3 x +2)- 1 = 5
26. Indicare la percentuale in massa di ossigeno in CO2:
A) 27,3 B) 63,6 C) 72,73 D) 60,6
soluzione
calcolare la percentuale di O in CO2 significa calcolare quanti g di O vi sono in 100 g di CO2 quindi
se in CO2 vi sono 2 O in 100 ve ne sono X
CO2: 2O = 100 :X 44 g :32 = 100 : X X = 72,73 %
27. Tenendo conto della seguente reazione:
N2O3 + 6 H2 →2 NH3 + 3 H2O
Indicare la quantità chimica di NH3 si ottiene da 0,22 mol di N2O3 e 0,87 mol di H2: A) 0,29 mol B) 0,44 mol C) 0,73 mol D) 1,1 mol
soluzione
dalla reazione si osserva che 1 mole di N2O3 reagisce con 6 moli di H2 quindi 0,22 moli dovrebbero reagire con 6x 0,22 = 1,32 moli ma la quantità di H2 è 0,87 moli quindi la quantità di idrogeno è la quantità limitante nel senso che non reagisce con tutto N2O3 ma con una sola parte di esso infatti
la quantità di N2O3 che reagisce con 0,87 moli di H2 è ottenuta dalla proporzione
se 1 mole di N2O3 reagisce con 6 moli di H2 X moli di Na2O3 reagiscono con 0,87 moli di H2
1:6 = X: 0,87 X = moli di N2O3 che reagiscono con 0,87 moli di H2
X= 0,145 moli di N2O3 che reagiscono
Per calcolare quanto NH3 si ottiene si ricorre alla proporzione
se da 1 mole di N2O3 si ottengono 2 moli di NH3 allora da 0,145 moli di N2O3 se ne ottengono X
1 : 2 = 0,145 :X
X= 0,145 x 2 =0,29 moli
risposta corretta A
28. Tutte le seguenti caratteristiche sono tipiche dei composti ionici puri eccetto:
A) alta conducibilità elettrica
B) alto punto di fusione
C) alta solubilità in acqua
D) insolubilità in solventi organici
soluzione
i punti C e D sono tipici dei composti ionici in quanto i composti polari sono solubili in solventi polari (acqua) e poco solubili nei solventi apolari. Il punto di fusione è il valore di temperatura in cui, a pressione atmosferica, fase solida e fase liquida coesistono in equilibrio.Il calore fornito al solido serve a spezzare le forze di coesione che tengono unite le molecole o gli ioni allo stato solido; la temperatura necessaria alla fusione dipende dalle forze che, in ordine crescente di energia, sono:1- forze di Van der Waals,2- l’ attrazione tra dipoli, 3- legami idrogeno,4- attrazione tra ioni. Da questo si evince che fondono a temperature maggiori i composti ionici, piuttosto che sostanze con forze di coesione deboli, come le forze di Van der Waals.
La conducibilità elettrica rappresenta l’attitudine di un corpo a lasciar fluire una corrente elettrica quando è sottoposto all’azione di un campo elettrico. I metalli sono ottimi conduttori di elettricità in quanto i loro elettroni fluiscono velocemente dalla banda di valenza alla banda di conduzione attigua alla banda di valenza. Poichè la conduzione elevata dei metalli è dovuta al movimento degli elettroni è evidente che gli ioni nei cristalli non possono avere elevata conducibilità elettrica.
risposta corretta A
29. Indicare l’unica molecola apolare: A) O3 B) H2O2 C) CO D) CCl4
soluzione
sia O3 che H2O2 e CO possiedono un momento dipolare netto mentre il CCl4 ha simmetria tetraedrica e pur avendo momenti di dipolo tra Carbonio e Cl la somma dei 4 vettori fornisce un momento dipolare nullo.Quindi nonostante il singolo legame C-Cl sia polarizzato, la simmetria tetraedrica della molecola rende la molecola del CCl4 nel complesso apolare.
30. Indicare quante cifre significative devono essere riportate nel seguente calcolo: 12,501 · 3,52 / 0,0042 = A) 2 B) 3 C) 4 D) 5
soluzione
poiché nel calcolo i numeri al numeratore hanno rispettivamente 3 cifre decimali e 2 cifre decimali ed il denominatore ha 4 cifre decimali il risultato deve avere 2 sole cifre decimali poiché le cifre successive a 2 non hanno significato. Quindi il risultato 10477,0285 va scritto co 2 cifre decimali cioè 10477,03
31. Indicare la soluzione col minor pH delle seguenti soluzioni 1M:
A) HClO B) H2SO3 C) H3PO4 D) H2SO4
soluzione
HClO è un acido debole con Ka=3,0 x 10 -8
[H+] = √Ka x 1 =√3,0 x 10 -8 = 1,7 x 10-4
PH -log 1,7 x 10-4
PH= 4-log 1,7 =4-0,23 =3,77
H2SO3 è un acido diprotico che si dissocia
H2SO3 <==> H+ + HSO3- Ka1 = 1,70 × 10-2
[H+] = √ 1,70 × 10-2 x 1
[H+] = 1,3 x 10-¹ PH = 1 -log 1,3 =1-0,1 = 0,9
HSO3- <==> H+ + SO3-2 Ka2 = 6,20 × 10-8
H3PO4 è un acido triprotico che si dissocia in
H3PO4<==> H+ + H2PO4- Ka1=7,1 × 10−3
H2PO4- <==> H+ + HPO4-2 Ka2 =7,9 × 10−8
32. Indicare quale sostanza in fase solida è costituita da molecole discrete: A) grafite B) mercurio C) iodio D) diamante
soluzione
la grafite ed il diamante sono due stati fisici del Carbonio che è un elemento. Il mercurio è un metallo monoatomico liquido a temperatura ambiente pertanto, l’unico solido formato da molecole discrete è il cristallo di iodio formato da molecole I2 con struttura ortorombica.
33. Indicare i coefficienti, riportati in ordine confuso, della seguente ossidoriduzione:
H2C2O4 + MnO4 – + H+ →Mn2+ + CO2 + H2O
A) 5, 1, 1, 4, 10, 4 B) 6, 2, 4, 8, 10, 2 C) 4, 5, 10, 4, 6, 4 D) 16, 2, 2, 8, 10, 5
soluzione
5[C2O4-2 → 2 CO2 +2 e
2[MnO4- +5e +8H+ → Mn+2 + 4H2O
_________________________________
5 C2O4-2 +2MnO4- + 16H+ → 10 CO2 + 2 Mn+2 + 8 H2O
34. Indicare quale asserto Einstein confermò con l’effetto fotoelettrico a lui ascritto:
A) gli elettroni possono assorbire energia e cambiare livello negli atomi
B) l’energia luminosa può essere convertita nella massa di elettroni
C) gli elettroni hanno le proprietà delle onde
D) la luce ha proprietà non solo di onde ma anche di particelle
soluzione
quando una radiazione elettromagnetica di una certa lunghezza d’onda colpisce una superficie metallica si verifica un’emissione di elettroni da parte del metallo ed il fenomeno fisico costituisce l’effetto fotoelettrico.
L’effetto fotoelettrico mette in evidenza la natura quantistica della luce che si muove nello spazio sotto forma di quanti di luce detti Fotoni. Sono proprio i fotoni che interagiscono con il metallo e se l’energia del fotone è sufficiente, dalla superficie del metallo viene staccato l’elettrone. Questo avviene solo se l’energia del fotone supera un limite di soglia che possiamo definire Lavoro di Estrazione.Il valore di soglia varia da metallo a metallo e varia anche in funzione della sua purezza. L’energia viene espressa in elettroni volts (ev) oppure in Joules che sono in relazione tra loro
E (J) = E (eV) x 1,602176 x 10−19J.
L’equazione di Einstein è E= h ν dove ν = c/λ
ν = frequenza della radiazione C= velocità della luce h= costante di Plank = 6,626 x 10−34Js
all’aumentare dell’energia del fotone incidente aumenta anche la velocità o meglio l’energia cinetica dell’elettrone estratto dal metallo.E’ da notare che l’aumento di intensità della luce incidente non modifica l’energia cinetica degli elettroni estratti, poiché questa dipende esclusivamente dall’energia dei fotoni incidenti.
da quanto detto si evince che la risposta corretta è D
35. Indicare la serie che riporta gli atomi dei seguenti elementi: Be, B, Mg, Al, in senso crescente di raggio atomico:
A) Be < B < Mg < Al
B) B < Be < Al < Mg
C) Mg < Be < Al < B
D) Al < Mg < B < Be
soluzione
per raggio atomico si intende la metà della distanza che intercorre tra i nuclei di due atomi uniti da un legame covalente.Si misura il raggio atomico in pico metri (pm=10-12 m) o in Angstrom (1A = 10-8 cm)
Il raggio atomico diminuisce all’aumentare della carica efficace che non è altro che la carica di cui risentono gli elettroni più esterni di un atomo a causa dello schermo creato dagli altri elettroni(Z*eff = Znucleo – S dove S è il numero medio di elettroni che si interpone tra il nucleo e l’elettrone considerato.
Nella tavola periodica il raggio atomico diminuisce lungo un periodo ed aumenta lungo un gruppo Da ciò si evince che la risposta corretta è B < Be < Al < Mg infatti
Mg 150 pm Al 143 pm Be 112 pm B 85 pm
36. Indicare l’esperimento che meglio ha supportato l’ipotesi che gli elettroni abbiano natura ondulatoria: A) diffrazione B) effetto fotoelettrico C) spettri di emissione D) deflessione di un raggio catodico mediante un magnete
soluzione
la diffrazione è un fenomeno che si osserva quando un fascio di luce incontra un’ostacolo lungo il cammino in linea retta. Se la luce possiede una lunghezza d’onda paragonabile alle dimensioni dell’ostacolo che incontra, il fenomeno diviene molto evidente come ad esempio avviene per la luce visibile di λ intorno a 500 nm.
Se l’ostacolo ha una o più fenditure si possono osservare le onde diffratte su uno schermo posto oltre l’ostacolo.
in figura vi sono due fenditure che vengono attraversate dalle onde che tra loro interferiscono.
Dell’effetto fotoelettrico abbiamo già discusso e dimostra chela luce si comporta anche da particella(fotone)
La deflessione di un raggio catodico dimostra che gli elettroni hanno carica negativa e la luce non ha nulla a che vedere con l’esperimento.
Gli spettri di emissione invece dimostrano solo l’evidenza dell’esistenza di livelli elettronici di energia e la radiazione luminosa che si osserva è dovuta esclusivamente a salti quantici.
La risposta corretta è A
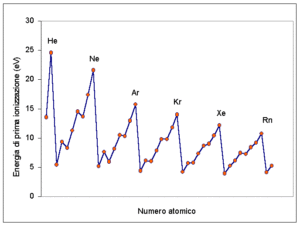
37. Indicare l’atomo con minor valore di energia di prima ionizzazione: A) Na B) K C) Mg D) Ca
soluzione
L’energia di prima ionizzazione è una proprietà periodica infatti aumenta lungo un periodo cioè da sinistra verso destra mentre diminuisce scendendo in uno stesso gruppo cioè dall’alto in basso. L’andamento dell’Energia di prima ionizzazione è mostrato nella figura:
38. Indicare l’atomo che, nel legarsi covalentemente, può avere più di otto elettroni di valenza (legame + non legame):
A) H B) N C) C D) S
soluzione
H 1S1
N 1s2 2s2 2p3
C [He] 2s2 2p2
In base alla struttura elettronica, non può essere l’idrogeno
L’azoto forma tre legami covalenti e possiede un doppietto di non legame
il Carbonio si può legare covalentemente con 2 elettroni
lo zolfo che possiede 6 elettroni nel guscio più esterno può unirsi a 6 elettroni per formare legami covalenti quindi lo S legandosi può avere 12 elettroni. di cui 8 di legame e 4 di non legame (due doppietti )
risposta corretta D
39. Indicare lo ione che, in fase gassosa, ha il maggior numero di elettroni disaccoppiati: A) Cr3+ B) Mn3+ C) Fe3+ D) Co3+
soluzione
la struttura del cromo è Cr
40. Indicare la classe di composti solidi che presenta mediamente il punto di fusione più basso:
A) ionici B) metallici C) molecolari D) a reticolo covalente
soluzione
Il punto di fusione è quel valore di temperatura e pressione in cui coesistono sia la fase liquida che quella solida in equilibrio termodinamico. Poiché la pressione è quella atmosferica che è praticamente costante, il punto di fusione viene indicato solamente con il valore della temperatura.
Tra i composti indicati, solo i composti molecolari cioè quei composti in cui le molecole sono formate da legami covalenti fondono per primi, per gli altri composti che possiedono forze reticolarti occorre maggior energia per la fusione.
QUI FINISCONO I TEST COMUNI ALLE CLASSI A E B. DI SEGUITO CONTINUANO QUELLI DELLA CLASSE A FINO AL N°60. DOPO SI COMPLETANO QUELLI DELLA CLASSE B.
41. Un legame covalente si dice doppio se: A) 2 atomi condividono 2 elettroni B) 2 atomi condividono 4 elettroni C) un atomo cede due elettroni all’altro D) un atomo cede due coppie di elettroni all’altro
soluzione
Nel legame covalente due atomi si uniscono mettendo in comune 2 elettroni che si muovono nella zona di legame che è compresa nello spazio tra i due atomi rendendo l’unione stabile.Due atomi si possono unire mettendo in comune 2 coppie di elettroni oppure 3 coppie per formare rispettivamente un legame doppio o triplo.
Ne consegue che la risposta corretta è B
42. Indicare tra le seguenti coppie di composti quella in cui entrambi i componenti possono formare un legame a idrogeno con l’acqua: A) CH4, Na+ B) HF, NH3 C) CH3COCH3, CH3CH3 D) Na2SO4, H2
soluzione
Il legame a idrogeno detto anche ponte idrogeno è una forza che si stabilisce tra molecole che possiedono un atomo di idrogeno legato ad un elemento molto elettronegativo ad es. Fluoro, Ossigeno, Azoto i quali attraggono a sé gli elettroni del legame originando pertanto , una carica parziale (δ-) su di sè ed una parziale carica positiva (δ+) sull’ idrogeno. Come conseguenza, l’idrogeno può essere attratto da un atomo elettronegativo di una molecola vicina. L’acqua è un esempio tipico di legame idrogeno
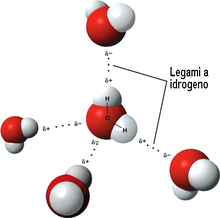
Nell’esempio dato, la coppia CH4 Na+ non forma legami idrogeno, e nemmeno CH3COCH3 e CH3CH3 ed analogamente Na2SO4, H2 perché CH4,CH3CH3 e H2 non sono polari. La coppia con momento dipolare è HF ed NH3 che quindi è l’unica coppia in grado di formare legami idrogeno.
risposta corretta B
43. Indicare la formula del composto che si può formare tra gli ioni Ca2+ e O2- : A) Ca2O2 B) CaO2 C) Ca2O D) CaO
soluzione
Sappiamo che per la formazione dei composti binari dagli elementi A+x e B-y
l’esponente di A che è x diviene l’indice di B cioè si forma Bx e l’ esponente di B che è y diviene l’indice di A cioè Ay
la formula del composto binario è Ay Bx
Per quanto riguarda la formazione del composto binario tra Ca ed O sappiamo che Ca+2 mentre O-2
Da quanto abbiamo detto sopra il composto binario tra Ca ed O è quindi Ca2O2
tuttavia essendo gli indici uguali si può scrivere Ca1O1
e poichè 1 si sottintende si può scrivere CaO
la risposta corretta è D
44. I metalli alcalini per reazione con l’acqua formano:
A) i rispettivi idrossidi con una reazione più o meno violenta e sviluppo di idrogeno che si incendia
B) i rispettivi idruri con una reazione che sviluppa ossigeno
C) acidi idrici
D) idrossidi di natura anfotera
soluzione
Gli elementi del gruppo 1 della tavola periodica sono molto reattivi in quanto cedono facilmente un elettrone per assumere una carica positiva ad es Na+ Li+ K+.Reagiscono facilmente con aria ed acqua e per questo vengono conservati in olio infatti
la reazione tra un metallo del 1 gruppo e l’acqua è:
metallo alcalino + acqua ![]() Metallo idrossido + idrogeno.
Metallo idrossido + idrogeno.
2Me(s) + 2H2O(l) ![]() 2MeOH(aq) + H2(g)
2MeOH(aq) + H2(g)
Il sodio in acqua si scioglie e forma una pallina galleggiante di metallo che si muove sulla superficie dell’acqua a causa del gas idrogeno che si forma e fa saltellare il metallo.
Il litio è meno reattivo del sodio e non si scioglie ma reagisce rapidamente con acqua fredda e produce idrogeno. Il potassio è il più reattivo di tutti i metalli del 1 gruppo. Si scioglie e reagisce violentemente e brucia con una fiamma lilla in quanto produce idrogeno. Il potassio è pericoloso e può esplodere quando entra in contatto con l’acqua.
La risposta corretta è A
45. I catalizzatori sono sostanze che partecipano a una reazione: A) e si ritrovano alla fine chimicamente e fisicamente inalterati B) e si ritrovano alla fine chimicamente ma non necessariamente fisicamente inalterati C) e se questa è di equilibrio spostano l’equilibrio verso i prodotti D) e se questa è di equilibrio spostano l’equilibrio verso i prodotti o i reagenti, se catalizzatori inibitori
soluzione
Un catalizzatore è una specie chimica che produce un abbassamento dell’energia di attivazione di una reazione aumentandone quindi la velocità ma rimanendo praticamente inalterato al termine della stessa.Nel corso della reazione, però, il catalizzatore può perdere progressivamente la sua efficacia a causa di degradazione termica (sintering) cioè per agglomerazione di più particelle di catalizzatore che ne fanno diminuire irreversibilmente la superficie disponibile per la reazione.Può perdere efficacia anche per invecchiamento (ageing) o per un fenomeno chiamato avvelenamento che consiste nell’adsorbimento chimico o fisico non voluto di un composto chimico (veleno) che ne diminuisce in modo irreversibile (avvelenamento chimico) o reversibile (avvelenamento fisico) i siti disponibili alla catalisi e ciò dipende dalla quantità e dal tipo di impurezze presenti.Sebbene in genere sia un fenomeno non voluto, qualche volta l’avvelenamento viene causato di proposito al fine di aumentare la selettività del catalizzatore (a discapito della sua attività).
Da quanto detto un catalizzatore si riscontra alla finedi una reazione, in generale chimicamente inalterato, ma può essere alterato fisicamente, quindi la risposta corretta è B e non A
46. La condizione quantica di Bohr: A) stabilisce la posizione in cui un elettrone può ruotare attorno al nucleo senza emettere energia B) stabilisce che l’energia di un elettrone può assumere qualsiasi valore senza che l’elettrone cada sul nucleo C) permette ancora oggi di calcolare la posizione e la velocità di un elettrone con contemporanea precisione alta a piacere D) viene oggi utilizzata per descrivere il moto e la velocità degli elettroni
soluzione
La teoria di Bohr ha specificato che l’elettrone si muove intorno al nucleo senza perdere progressivamente energia come previsto dalla meccanica classica e quindi non cade sul nucleo, muovendosi in livelli di energia ben definiti. L’emissione di energia sotto forma di radiazione luminosa (spettri atomici) si ha solamente per salti quantici in cui l’elettrone assorbendo energia dall’esterno (ad esempio sotto forma di calore), passa da un livello di energia più basso ad uno più alto e la riemette sotto forma di radiazione luminosa quando ritorna al livello di energia iniziale.
L’energia del livello fondamentale dell’elettrone dell’idrogeno è
dove m è la massa dell’elettrone h la costante di Plank ed e è la carica dell’ elettrone.
La risposta corretta è A
47. Indicare la quantità chimica di CuSO4 · 5 H2O presente nella massa di 1 kg di sale: A) 4 · 6,02 ·1023 molecole B) 4 · 250 mol C) 4 · 22,414 mol D) 4 mol di CuSO4 · 5 H2O
soluzione
1 Kg =1000 g pertanto le moli in esso contenute sono 1000/ 249,7= 4,0 moli di CuSO4.5H2O
la risposta corretta è D
48. La mole è: A) una grandezza chimica sinonimo di quantità chimica B) un numero che correla gli atomi alle molecole degli elementi C) un numero che permette al chimico di non usare le bilance e di contare le molecole per metterle a reagire D) un’unità di misura della quantità di sostanza
soluzione
Così come una cinquina di una qualunque specie corrisponde a 5 unità, una dozzina corrisponde a 12 unità così una mole corrisponde a 6,02 x 1023 unità.
Una cinquina di elefanti , una cinquina di uova pesano in modo diverso ma la quantità è sempre 5
Una dozzina di caramelle ed una dozzina di panettoni pesano in modo diverso ma la quantità è sempre 12 unità.
In chimica non si usano nè la cinquina nè la dozzina bensì la MOLE
Pertanto la mole è una unità misura della quantità di sostanza.
Una mole di atomi pesa in modo diverso da una mole di un composto chimico o una mole di elettroni, ma il numero è sempre 6,02 x 1023 unità..
Una mole di un qualunque elemento corrisponde al suo peso atomico ed è costituita da 6,02 x 1023 atomi.
una mole di un composto chimico corrisponde al suo peso molecolare ma contiene sempre un numero di atomi o molecole pari al numero di Avogadro 6,02 x 1023 molecole
una mole di elettroni è costituita da 6,02 x 1023 elettroni
risposta corretta D
49. Una mole di atomi e una mole di molecole dello stesso elemento sono: A) termini che indicano le stesse quantità B) termini che indicano quantità anche differenti e non vanno confuse C) quantità corrispondenti a masse diverse ma a pesi uguali D) quantità corrispondenti allo stesso numero di atomi
soluzione
Prendiamo come esempio l’atomo di idrogeno H e la molecola di idrogeno H2
1 mole di atomi di idrogeno è costituita da 6,02 x 1023 atomi di idrogeno e pesa 1,008 g
1 mole di molecole di idrogeno è costituita da 6,02 x 1023 molecole ma pesa 2,016 g
questo dimostra che una mole di atomi ed una mole di molecole sono costituite da quantità differenti tra loro infatti una mole di atomi pesa 1,008 g ed una mole di molecole pesa 2,016 g pur contenendo la stesse quantità, di atomi nel primo caso e di molecole nel secondo caso (6,02 x 1023 unità).
risposta corretta B
50. La mole è: A) l’unità di misura della grandezza quantità di materia n B) l’unità di misura della grandezza quantità di sostanza n C) una grandezza, come la dozzina per le rose, la risma per i fogli di carta, che si applica alla quantità di materia quando di essa si vuol conoscere il numero di unità semplici D) l’unità di misura della massa delle molecole.
soluzione
come si è visto la mole è una misura della quantità di sostanza e si indica generalmente con n .
risposta corretta B
51. La tavola periodica degli elementi è importante perché permette: A) di rappresentare in modo sintetico le proprietà chimiche degli elementi correlandole alla configurazione elettronica del guscio energetico esterno B) di rappresentare in modo sintetico gli elementi con un simbolo lasciando liberi spazi per quelli non ancora noti C) di rappresentare in modo sintetico le proprietà chimiche degli elementi correlandole alla loro massa atomica D) di rappresentare in modo sintetico le proprietà chimiche degli elementi correlandole alla loro configurazione elettronica interna o core
soluzione
La tavola periodica degli elementi è lo schema con cui sono raggruppati ed ordinati gli elementi chimici sulla base del numero atomico Z e del numero di elettroni presenti negli orbitali s, p, d, f.
risposta corretta A
52. Il semplice raggiungimento di una configurazione elettronica esterna stabile a otto elettroni nella trasformazione degli atomi di Na e Cl negli ioni Na+ e Cl- : A) giustifica, da un punto di vista energetico, la formazione del composto ionico NaCl B) giustifica la formazione del legame ionico in quanto gli ioni, già prima di legarsi, hanno energia minore degli atomi da cui derivano C) non è sufficiente a giustificare, da un punto di vista energetico, la formazione del legame ionico di NaCl D) giustifica la formazione del legame ionico in quanto ciascuno ione, prima di legarsi possiede energia minore del proprio atomo libero
soluzione
da un punto di vista energetico lo ione Na+ è una entità più stabile del Na libero in quanto assume la struttura elettronica del Neon.
Na 1S2 2S2 2P6 3S1
Na+ 1S2 2S2 2P6 che è una struttura stabile quindi con minor energia di Na
a sua volta il Cl 1S2 2S2 2P6 3s2 3p5
ha una struttura esterna con 5+2 elettroni per cui lo ione Cl- è energeticamente più stabile che non Cl libero
è quindi agevole per Na+ e Cl- formare un reticolo cristallino con legame attrattivo ionico.
La risposta corretta è D
53. L’energia termica fornita a un solido durante la sua fusione: A) non provoca alcun aumento di temperatura B) provoca un aumento di temperatura C) provoca un latente aumento di temperatura D) provoca una parziale evaporazione della parte già liquefatta
soluzione
quando ad un solido viene ceduta energia sotto forma di calore, questa viene utilizzata esclusivamente per spezzare i legami degli atomi o molecole nel solido e quindi non si osserva aumento di temperatura che rimane costante sino a che tutto il solido non fonde. Solo dopo la completa fusione si ha un aumento di temperatura.
risposta corretta A
54. Il passaggio diretto di un solido nella fase vapore è detto: A) brinamento B) sineresi C) sublimazione D,) osmosi
soluzione
il processo è detto SUBLIMAZIONE . Un esempio è rappresentato dai cristalli di I2 che passano direttamente allo stato di vapore
55. Se una specie chimica, fondendo, aumenta di volume: A) un aumento di pressione aumenta il punto di fusione B) un aumento di pressione diminuisce il punto di fusione C) un aumento di pressione non ha alcuna influenza sul punto di fusione D) un aumento di pressione trasforma la fusione netta in un intervallo di rammollimento
soluzione
In generale nel corso di una fusione il volume del sistema varia poco e quindi la temperatura di fusione varia di poco al variare della pressione, ma se il volume aumenta sufficientemente, all’aumentare della pressione aumenta il punto di fusione poiché la pressione tende a ricompattare la struttura.
risposta corretta A
56. Indicare il soluto che si scioglie meglio nell’acqua: A) un sapone B) un grasso C) il sale da cucina D) il solfato di calcio diidrato (gesso)
soluzione
essendo l’acqua un solvente polare i saponi costituiti dai sali degli acidi grassi si sciolgono poco ed i grassi non si sciolgono,mentre il sale NaCl sale di cucina essendo formato da cristalli ionici di Na+ e Cl- subisce l’azione di solvatazione degli ioni da parte dell’acqua molto più che il solfato di calcio che è poco solubile.
Risposta corretta C
57. Indicare la reazione che forma un composto con una forma trigonale planare:
A) N2 + 3 H2 →
B) 2 CO + O2 →
C) PCl3 + Cl2 →
D) 2 SO2 + O2 →
soluzione
nella reazione A si forma NH3 con struttura tetraedrica

nella reazione B si forma CO2 con struttura lineare

nella reazione D si forma SO3
nella reazione C si ha
PCl3 + Cl2 → PCl5 si forma la seguente struttura:

risposta corretta C
58. Nella reazione da bilanciare: Na + Cl2→ NaCl indicare la quantità di NaCl prodotta da 22,99 g di Na, ammettendo la resa quantitativa e il cloro sufficiente: A) 28,87 g B) 58,44 g C) 86,61 g D) 64,95 g
soluzione
la reazione è 2Na+Cl2 → 2 NaCl
se da 2 Na si ottengono 2 NaCl allora da 22,9 se ne ottengono X
22,9 x 2 : 58,44 x2 = 22,9 : X X = 58,44 g
risposta corretta B
59. Indicare il nome del legame che unisce l’atomo di idrogeno e quello di cloro nella molecola HCl: A) legame di idrogeno B) legame a ponte di idrogeno C) legame ionico D) legame covalente
soluzione
tra idrogeno e cloro si stabilisce un legame covalente con il doppietto elettronico spostato verso il cloro che è più elettronegativo dell’idrogeno generando un momento dipolare.

risposta corretta D
60. Una specie normalmente apolare può divenire polare per il concentrarsi casuale della nube elettronica di un atomo o di una molecola apolare in un punto. Si viene così a formare un dipolo istantaneo e attraverso di esso anche un dipolo indotto. Questi due eventi portano all’ insorgere di una forza intermolecolare detta di dispersione o di London. A proposito di essa si può dire che (indicare l’affermazione ERRATA):
A) la sua entità dipende anche dalla forma delle molecole
B) la polarizzabilità di una molecola dipende anche dalla sua massa
C) l’entità della sua attrazione dipende dalla polarizzabilità dell’atomo o della molecola
D) le forze di dispersione non sono mai comparabili o superiori di quelle dipolo-dipolo
soluzione
le forze di dispersione fanno parte della più ampia categoria detta forze di Van der Waals. Esse sono dovute ad un effetto quantistico dovuto all”interazione tra le le nuvole elettroniche che causa una loro ridistribuzione, con formazione di un dipolo a causa della perdita di simmetria tra le cariche positive e nube elettronica. Il dipolo così formato permette l’attrazione tra i due sistemi interagenti.Le forze di interazione dipolo-dipolo sono sempre superiori alle forze di dispersione da queste generate.
risposta corretta D
QUI RIPRENDONO I QUESITI DELLA CLASSE B.
41. Indicare l’affermazione corretta per ogni reazione che segua una cinetica del primo ordine: A) solo una sostanza prende parte alla reazione B) la velocità di razione è indipendente dalla temperatura C) il periodo di semitrasformazione è indipendente dalla concentrazione iniziale del reagente D) la velocità di reazione è indipendente dalla T e dalla P
soluzione
In ogni reazione chimica i prodotti si formano con una ben definita velocità ed ovviamente con la stressa velocità si consumano i reagenti.La velocità è pertanto definita dalla variazione della concentrazione di reagenti o di prodotti che avviene in un determinato periodo di tempo.
Matematicamente per una reazione del tipo A ![]() B
B
velocità media = – Δ[A]/[ΔT] = Δ[B,]/[ΔT]
la velocità può non essere costante, pertanto essa è determinata in maniera istantanea e quindi calcolata come limite del rapporto Δ[A]/Δt per l’intervallo di tempo tendente a zero, ovvero come la derivata della concentrazione del reagente A rispetto al tempo
V= – d[A]/ dt V= d[C]/dt
Se la velocità dipende dalla concentrazione di un solo reagente,come in questo caso, elevato ad un esponente pari ad 1 viene detta Reazione del Primo ordine
V= – k [A] cioè la velocità è proporzionale alla concentrazione di reagente
integrando fra t=0 e t avremo:
e risolvendo l’integrale:
- ln ( [A] / [A]₀ ) = – kt
[A]₀ è la concentrazione iniziale del composto mentre [A] quella al generico tempo t:
quando [A] / [A]₀ = 1/2 ovvero quando la concentrazione di A diviene la metà di quella iniziale, il tempo percorso è detto tempo di dimezzamento e si calcola nel seguente modo
ln (1/2) = – k x t(½)
ln(2) = k x t(½)
t(½) = ln(2) / k questa espressione ci dice che il tempo di dimezzamento NON dipende dalla concentrazione di A.
risposta corretta C
42 La soluzione acquosa di un acido 12,0 M contiene il 75% in massa di acido ed ha una densità 1,57 g/ml. ciò permette di individuare l’acido come
A) HCl B) CH3COOH C) HBr D) H3PO4
soluzione
dalla densità sappiamo che 1 litro di acido contiene 1570 g di acido
la quantità di moli di 1570 g di HCl corrisponderebbe a 1570/36.5 =43,0 moli che al 75% corrispondono a 32.2 moli /l di HCl quindi non può essere HCl
1570 g di CH3COOH corrisponderebbero a 1570 / 60= 19,6 moli /l che al 75% corrispondono a 14,7 moli/l pertanto nemmeno CH3COOH è l’acido cercato
1570 g di HBr corrisponde a 1570/80,9 = 19,4 moli che al 75% corrispondono a 14,55 moli/l e quindi non può trattarsi di HBr
1570 g di H3PO4 corrispondono a 1750/97,99 = 16,0 moli che al 75% corrispondono a
12,0 Moli/l
l’acido è quindi H3PO4
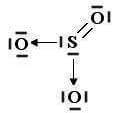
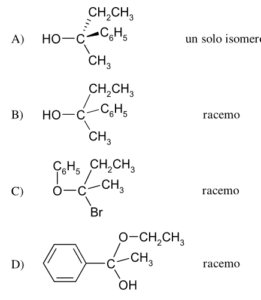
43 Dalla reazione tra 2 butanone e Bromuro di fenilmagnesio si ottiene la molecola A che per trattamento con H2O forma il prodotto X .
CH3COCH2CH3 + C6H5MgBr → A
A+ H2O → X
Indicare quale dei seguenti composti è X
Soluzione
Il gruppo carbonilico del chetone reagisce con il reattivo di Grignard in cui il gruppo C6H5- entra dalla parte opposta del CO CON UNA INVERSIONE DI CONFIGURAZIONE. In questo meccanismo R è il gruppo C6H5- e si ottengono 2 enantiomeri cioè un composto racemico costituito da una miscela in rapporto 1:1 dei due opposti enantiomeri , quindi il composto X è B
44. In una reazione, il rame reagisce con HNO3 secondo la reazione: Cu + HNO3 → Cu(NO3)2 + NO + NO2 + H2O nella quale NO ed NO2 sono formati in rapporto 2 : 3. Indicare il coefficiente del Cu quando l’equazione è bilanciata con i più semplici numeri interi: A) 2 B) 3 C) 6 D) 9
soluzione
la reazione è
9 [Cu° → Cu+2 + 2 e
2[ 2NO3- +6e + 8H+ → 2NO + 4H2O
2[3NO3- + 3e + 6H+ → 3NO2 + 3H2O
______________________________
9Cu° + 10NO3- + 28 H+ → 4NO + 6 NO2 +14 H2O
il coefficiente di Cu è 9 quindi la risposta esatta è 9
45. Indicare il composto che può essere usato sia come reagente che come indicatore in una reazione redox:
A) Fe(NH4)SO4 B) KMnO4 C) H2C2O4 D) Na2S2O3
soluzione
tra i composti indicati il reagente utilizzato anche come indicatore è il KMnO4. Infatti, in ambiente acido è un forte ossidante e si riduce secondo la reazione
MnO4- + 8 H+ +5e → Mn+2 +4H2O
viola incolore
la soluzione cambia repentinamente colore quando la reazione raggiunge il punto di equivalenza. In ambiente alcalino o neutro il KMnO4 ha meno potere ossidante e si forma MnO2 di colore nero che non permette una buona ed utile valutazione del punto di viraggio.
In chimica analitica la metodologia che usa il permanganato come indicatore viene indicata col termine di permanganometria.
46. Indicare la coppia di composti che comprende un etere e un estere:
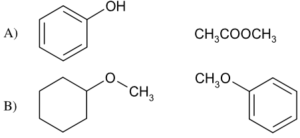
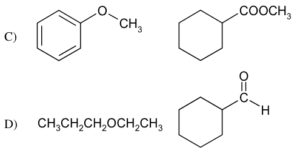
soluzione
47. Indicare l’affermazione ERRATA a proposito dell’acqua ossigenata (perossido di idrogeno):
A) l’H2O2 pura è più densa dell’acqua, bolle a 150 °C e si ottiene per distillazione sotto vuoto, a 25 °C, di soluzioni acquose diluite.
B) in fase liquida i suoi atomi di ossigeno si scambiano con quello dell’acqua
C) è circa un milione di volte più basica dell’acqua
D) è un agente ossidante relativamente forte, sia in soluzione basica che acida. Si comporta come riducente solo con MnO4 – , Cl2 e Ce4+ e pochi altri ossidanti
soluzione
la densità è 1,45 g/ml e bolle a 150,2 °C e si ottiene generalmente dal perossido di bario trattato con H2SO4 e viene concentrata per distillazione. La sua soluzione acquosa diluita a 20°C è più acida dell’acqua:
H2O2 ⇌ H+ + HO2– K = 1.5 x 10-12 a 20°C
Allo stato puro ha invece un pH di 6.2 ed è pertanto più basica dell’acqua. Agisce sia da ossidante che da riducente: nel primo caso in ambiente acido e nel secondo in ambiente basico.
48. Indicare il volume occupato da un campione di cloro gassoso (13,7 g a 45 °C e 99298,5 Pa) : A) 5,14 L B) 3,21 L C) 7,03 L D) 2,45 L
soluzione
dall’equazione generale di stato dei gas
PV =g/PM RT si ha 99298,5 x V = 13,7 /71 x 8,314 x 273+ 45 99298,5 x V =0,193x 318 x 8,314
V= 5,14 l
49. Indicare il sale che conferisce un pH acido a una soluzione acquosa: A) nitrato di potassio B) nitrato di ammonio C) bicarbonato di sodio D) cianuro di potassio
soluzione
per la soluzione del quesito occorre ricordare l’idrolisi di un sale.
Se si tratta di un sale che in acqua produce una base ed un acido ambedue forti, la soluzione che avrà origine sarà neutra. Se il sale in acqua produce una base forte ed un acido debole la soluzione sarà basica. Se il sale dà origine ad un acido forte ed una base debole la soluzione sarà acida.
Nel caso in esame NaNO3 in acqua forma NaOH ed HNO3 ambedue forti perciò la soluzione risultante sarà neutra.
[H+]=[OH-] = 10-7 moli/l
Nel caso di NaHCO3 in H2O si formano H2CO3 acido debole ed NaOH base forte quindi la soluzione sarà basica. infatti
HCO3- +H2O<==> H2CO3 + OH- [HCO3-]= Cs quindi
Ki = [OH-]² /Cs
[OH-]= √Ki Cs ma Ki=Kw/ka
[OH-]= √Kw/ka Cs
Nel caso di KCN si formerà in acqua KOH base forte ed HCN acido debole pertanto la soluzione sarà basica.
[OH-]= √Kw/ka Cs
Nel caso di NH4NO3 in acqua si formano NH4OH base debole ed HNO3 acido forte quindi la soluzione è acida
NH4+ + H2O <==> NH4OH + H+ [NH4+]=Cs Ki = [H+]² Cs Ki=Kw/Kb
[H+] =√Kw/kb Cs
La risposta corretta è A
50. Una stanza ha dimensioni 3,05 m x 3,05 m x 2,43 m e si trova alla temperatura di 25,0 °C. La pressione totale è di 101,325 kPa e la pressione parziale dell’argon è di 1,01325 kPa. Indicare la quantità chimica di argon presente nella stanza: A) 4,79 mol B) 3,87 mol C) 9,27 mol D) 6,37 mol
soluzione
La pressione parziale pi di un componente di una miscela di gas è la la pressione che questo avrebbe se occupasse, da solo, l’ intero volume occupato invece dall’intera miscela nelle stesse condizioni di temperatura T.
dove pi rappresenta la pressione parziale del componente i.
Questo significa che ogni gas presente in una miscela ideale, agisce come se tutti gli altri gas non fossero presenti e, pertanto, le pressioni parziali di ciascun gas possono essere semplicemente sommate. Si presume però che i gas non interagiscano tra loro. Se ni è il numero di moli del gas i si avrà
![]()
![]() xi è la frazione molare del gas i
xi è la frazione molare del gas i ![]()
I dati sono pertanto:
volume totale della camera è 3,05 x 3,05 x 2,43 =22,6 m³= 22.600 litri
Pt =101,325 kPa Pi= 1,01325 kPa
per cui essendo Xi = ni/∑ni = Pi/Pt si ha Xi= 1,01325 / 101,325 = 0,01 che è la frazione molare di Argon
Da questa espressione dobbiamo calcolare ni cioè il numero di moli, ed è noto solo Xi pertanto
per conoscere le moli di Argo dobbiamo calcolare ∑ni cioè le moli totali e ciò è possibile ricordando che Pt=p1+p2+…..pi e n1+n2+…ni= moli totali e quindi
applicando la legge generale di stato dei gas
PV= ∑ni RT si ha:
101,325 x 22600 = ∑ ni x 8,314 x (273+25)
P x V = ∑ ni x R x T
∑ ni = 2289945 / 2477,57 = 924,2 moli
51. Indicare tra le seguenti molecole: AsH3, OF2, AlCl4 – , I3 – , quelle con geometria lineare: A) OF2, I3 – B) I3 – C) AsH3, I3 – D) OF2
soluzione
l’ AsH3 ha la seguente struttura :
 OF2 ha la struttura
OF2 ha la struttura  AlCl4-
AlCl4-
lo ione triioduro ha struttura lineare 
52. I chimici possono aumentare la velocità delle reazioni che avvengono in fase omogenea liquida, scaldando la miscela di reazione. Ciò si spiega perché: A) molte reazioni sono endotermiche B) così diminuisce l’energia di attivazione C) così aumenta la tensione di vapore del liquido D) così aumenta l’energia cinetica media dei reagenti
soluzione
la velocità di una reazione è una funzione della temperatura infatti L’equazione diArrhemius mette in relazione la costante di velocità k con la variazione di Temperatura
dove k è la costante di velocità; k0 è un fattore sperimentale; ΔE† è l Energia di Attivazione ;
R è la costante dei Gas ; T è la temperatura assoluta (273+t) dopo riscaldamento ; T0 è la temperatura assoluta iniziale.
La temperatura è una misura del calore ceduto al sistema le cui molecole aumentano la propria energia cinetica e quindi aumenta la velocità della reazione.
Risposta corretta D
53. Una bottiglia contiene H2SO4 (1 L al 96,4 % in massa) avente densità d = 1,835 g mL-1 . Indicare il volume che contiene 1 mol di acido puro: A) 55,4 mL B) 48,0 mL C) 32,0 mL D) 12,0 mL
soluzione
dal valore della densità si ha che 1 litro di soluzione contiene 1835 g di H2SO4 che è però al 96,4 % pertanto la quantità reale è 1835 x 0,964 =1768,9 g di H2SO4
quindi se in 1000 ml (1 litro) vi sono 1768,9 g in X ml vi saranno 98 g (1 mole)
98 x 1000 / 1768,9 = 55,4 ml
54. Indicare il numero di ossidazione dello zolfo nella pirite (FeS2):
A) -2 B) -1 C) +1 D) +2
soluzione
Il n. o. di un atomo è quel numero che gli viene attribuito in funzione dell’elettronegatività dell’atomo cui è legato. Si attribuisce il valore +1 per ogni legame che lo unisce ad un atomo più elettronegativo e -1 per ogni legame che lo unisce ad un atomo meno elettronegativo.
Nel caso di FS2 lo zolfo è legato ad un atomo di zolfo – S-S- ed ambedue si legano con il Fe +2 quindi ogni atomo di Zolfo è legato al ferro (meno elettronegativo dello zolfo) con un legame. Pertanto il n.o. dello zolfo è -1 (per ogni atomo di S).
Risposta corretta B
55. La combinazione dei due atomi di un alogeno X, per formare la molecola X2 in fase gassosa, segue una cinetica del secondo ordine e ha un’alta costante cinetica di reazione: k = 7,0 ·109 M -1 s -1 a 23 °C. Se la concentrazione iniziale di X è 8,06 ·10-2 M, individuare la sua concentrazione dopo 120 s dall’inizio della reazione. Inoltre individuare il tempo di semi-trasformazione di X, quando la sua concentrazione iniziale è 6,0 ·10-1 M: A) [X] = 1,2 ·10-12 M; 1,0 ·10-2 s B) [X] = 2,0 ·10-10 M; 3,00 s C) [X] = 1,2 ·10-11 M; 5,4 ·10-2 s D) [X] = 1,2 ·10-12 M; 2,4 ·10-10 s.
soluzione
Le reazioni del secondo ordine sono quelle reazioni la cui velocità dipende dalla concentrazione di uno o più reagenti in modo tale che la somma degli esponenti sia pari a 2.
V= – k [A]²
La velocità istantanea di reazione man mano che [A] diminuisce è
– d[A]/dt = – k [A]²
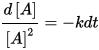
integrando fra t=0 e t generico avremo: 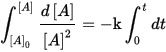 da cui si ottiene
da cui si ottiene
![]() che si può riscrivere
che si può riscrivere
[A] = 1/ kt + 1/[A]0
il tempo di dimezzamento cioè il tempo impiegato affinchè [A]0 divenga la metà è quindi
t1/2 = 1/k[A]0
pertanto essendo [A]0 = 0,0806 M
k= 7,0 x 109 /Mx s
[A] dopo 120 s dall’inizio della reazione sarà [A] = 1/( 7,0 x 109 x 120)+ 1 / 0,0806
[A]= 1/840 x 109 + 12,40 = 1/6,77 x 109
[A]= 1,2 x 10 -12 M
il tempo di dimezzamento quando [A]0 = 0,6 M è:
t1/2 = 1/ 7,0 x 109 x 0,6 = 1/4,2 x 10-9 = 2,4 x 10-10
56. Sapendo che in una soluzione satura di H2S a 25 °C, [H2S] è 1,00 ·10-1 mol L-1 , indicare la concentrazione di FeS in tale soluzione se il pH è tamponato a 2,00. Assumi K1 (H2S) = 9,00 ·10-8 e K dissoluzione di FeS = 5,00 ·10-19 alla stessa T; K è riferita alla reazione: FeS + H2O ⇄ Fe2+ + OH- + HS
A) 2,32 ·10-5 M B) 4,12 ·10-2 M C) 1,04 ·10-8 M D) 6,00 ·10-1 M
soluzione
Essendo la soluzione a PH=2 significa che [H+]= 1o-2
sappiamo inoltre che H2S<==>H+ + HS- quindi [ HS-]= k1 x [H2S] /10-2=9 x 10-8 x 0,1 /10-2= 9 x 10-7
[ HS-]= 9 x 10-7 sappiamo inoltre che
K= [Fe+2] [OH-][HS-] /[FeS] [H2O] = 5 x 10-19
5 x 10-19 = 9 x 10-7 x 9 x 10-7 x 9,x 10-7 [Fe+2] = 729 x 10-21[Fe+2]
[Fe+2] =5 x 10-19 / 729 x 10-21 = 6 x 10-1 M
57 indicare la geometria di ClF3 :
A) altalena B) forma a T C) trigonale planare D) trigonale piramidale
soluzione
La teoria V.S.E.P.R. ( Valence Shell Electron Pair Repulsion che tradotto significa repulsione delle coppie elettroniche dello strato di valenza ) è in grado di prevedere geometria di una molecola ,cioè la disposizione spaziale degli atomi che la compongono. La teoria spiega che le coppie di elettroni che si trovano nell’ ultimo livello dell’ atomo centrale tendono a respingersi in modo da disporsi il più lontano possibile tra loro, e ciò dà origine a una definita disposizione degli atomi nello spazio, quindi a un ben precisa geometria della molecola. Le regole della teoria che occorre osservare nella costruzione della geometria molecolare sono le seguenti:
- occorre considerare le coppie di elettroni dell’atomo centrale impegnate nei legami con gli altri atomi ( coppie condivise), sia quelle non impegnate ( coppie non condivise), appartenenti all’ultimo livello.
- I doppi e i tripli legami si considerano come se si trattasse di un legame semplice, in quanto ciò che interessa è la direzione della nuvola elettronica e l’effetto è come se fosse quello di un solo doppietto di legame.
Le coppie non condivise, possiedono una nuvola elettronica più espansa di quelle impegnate in un legame, per cui, rispetto a queste, la forza repulsiva è più intensa sulle altre coppie, ampliando o restringendo l’angolo di legame
Nella molecola ClF3 vi sono 3 coppie di legame e 2 non condivise
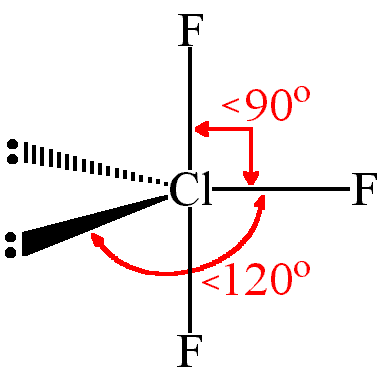 o meglio
o meglio
la struttura di Cl F3 è qundi a T
risposta corretta B
58. Il principio attivo della candeggina è l’ipoclorito di sodio: NaClO che può essere determinato mediante analisi iodometrica con le reazioni:
ClO- + 2 I- + H+ → I2 + Cl- + H2O
I2 + 2 S2O3 2– → S4O6 2– + 2 I–
Se 1,356 g di candeggina richiedono 19,50 mL di una soluzione 0,100 M di Na2S2O3, indicare la percentuale in massa dell’ipoclorito NaOCl nella candeggina:
A) 2,68 % B) 3,70 % C) 5,35 % D) 10,7 %
soluzione
dalla seconda reazione si osserva che per ogni mole di Iodio si consumano due moli di tiosolfato pertanto se abbiamo consumato 0,1 x 19,5 mmoli = 1,95 mmoli di Tiosolfato significa che vi erano 1,95/2 mmoli di Iodio cioè 0,975 Mmoli di Iodio.
Poichè dalla prima reazione si osserva che, per 1 mole di ipoclorito si consuma una mole di iodio allora le mmoli di ipoclorito sono pari a 0,068 mmoli di ClO- che corrisposndono ai milligrammi
mmoli=mg/PM mg= mmoli x PM = 0,975 x 74,44 = 72,58 mg
per ottenere la % di ipoclorito nella candeggina
se in1356 mg di Candeggina vi sono 72,58 mg di NaClO in 100 ve ne sono X
X= 100 x 72,58 / 1356 = 5,35 %
risposta corretta C
59. Indicare il numero di elettroni necessari per bilanciare la semireazione di ossidazione dell’etanolo ad acido acetico:
A) 1 B) 2 C) 3 D) 4
soluzione
nella reazione CH3CH2OH → CH3 COOH il n.o. del C del CH2OH è -1
( -2 per i legami con 2 atomi di H e +1 per un legame con l’ossigeno quindi -2 +1 = -1)
mentre il C del gruppo COOH è +3 quindi l’ossidazione del C dell’etanolo prevede l’acquisto di 4 elettroni per formare l’acido acetico.( da -1 a+3 vi sono 4 elettroni di differenza).
risposta corretta D
60. Per una cella voltaica basata sulla seguente reazione:
2 Ag+ (aq) + Cu (s) ⇄ Cu2+ (aq) + 2 Ag
la concentrazione degli ioni e la grandezza degli elettrodi possono essere variati in modo indipendente. Si indichi l’affermazione che valuta correttamente ciò che succede:
A) il raddoppio di [Cu2+] ha lo stesso effetto sul voltaggio della cella dell’ aumento di 4 volte di [Ag+ ]
B) la diminuzione di 10 volte di [Cu2+] ha lo stesso effetto sul voltaggio della cella della diminuzione di 10 volte di [Ag+ ]
C) la diminuzione di 10 volte di [Cu2+] ha minore effetto sul voltaggio della cella della diminuzione di 10 volte di [Ag+ ]
D) il raddoppio delle dimensioni del catodo ha esattamente lo stesso effetto sul voltaggio della cella del dimezzamento di [Cu2+]
soluzione
la F.e.m. di una pila è calcolabile dalla differenza dei potenziali degli elettrodi in esame
il catodo è l’elettrodo dove avviene la riduzione e nel caso specifico è l’elettrodo Ag
Ec = E° + RT/nF ln [Ag+]²
e l’anodo è l’elettrodo dove avviene l’ossidazione ed in questo caso è l’elettrodo Cu
Ea = E° + RT/nF ln [Cu+2]
la f.e.m. di questa reazione è data dalla differenza Ecatodo-Eanodo
supponiamo che inizialmente [Cu+2] sia 1 M =[Ag+]
Ea = E° + RT/nF ln [Cu+2] Ea = E° + 0,06/2 log [Cu+2] = 0,34 + 0,06/2 log 1 =0,34 V
Se diminuiamo la [Cu+2] di 10 volte cioè se riteniamo diventi 0,1 M allora
Ea = 0,34 + (0,06 /2) log 10-1 = 0,34+ (0,06/2 x -1 ) = 0,34 – 0,03 = 0,31 V
e per il catodo si ha
Ec = E° + RT/nF ln [Ag+]² Ec = E° + (0,06/2 ) ln [Ag+]² = 0,8 + 0,03 log (0,1)²
Ec = 0,8- (1x 2x 0,03 ) = 0,8 -0,06 = 0,74 V
pertanto quando [Cu+2]=[Ag+]=1 M la F.E.M. è :
F.E.M. = 0,8-0,34 = 0,46 V
se [Cu+2]= 0,1 allora
F.E.M.=0,8- 0,31 =0,49 V
Se [Ag+] =0,1 si ha
F.E.M= 0,74- 0,34 = 0,40 V
come si vede la diminuzione del [Cu+2] di 10 volte, ha minore influenza sulla F.e.m. rispetto alla [Ag+] 10 volte minore.
Gli stessi calcoli dimostrano che la risposta A è errata così come la risposta B ed ovviamente anche la risposta D.
risposta corretta C
GIOCHI DELLA CHIMICA 2013 FASE NAZIONALE CLASSE C
1. Un miscuglio di due alogenuri d’argento (AgCl e AgBr; 1,000 g) rivela all’analisi la presenza di 6,457 ·10-1 g di Ag+ . Individuare la composizione percentuale in massa del miscuglio:
A) AgCl = 60 %; AgBr = 40 % B) AgCl = 50 %; AgBr = 50 % C) AgCl = 40 %; AgBr = 60 % D) AgCl = 55 %; AgBr = 45 %
soluzione
indichiamo con X la quantità di argento proveniente da AgCl
indichiamo con Y la quantità di Ag proveniente da AgBr
quindi X + Y = 1,0 g
AgBr=187,77 AgCl= 143,35
se supponiamo che x+y =100
x + y = 100 g
x=100-y
le moli di argento saranno
moles Ag in 100 g = 65,47 g/ 107.868=0.6069
x / 143.3 + y / 187.8 = 65,47 /107,3= 0,6069
il mcm è 26916,8= 187,8 x 143,3
187.8 x + 143.3 y = 16337 ma x =100-y quindi
187.8 ( 100-y) + 143.3 y = 16337
18780 – 187.8 y + 143.3 y = 16337
(18780 – 16337) = (187,8- 143,3) Y
2443= 44,5 y y = 54,9
y = 54,9 g = massa di AgBr in 100 g di miscela
100 – 54,9 = 45,1 g
% AgCl =45,1
%AgBr= 54,9
2. Indicare, tra i fluoruri di zolfo noti: SF2, SF3, SF4 ed SF6, quelli aventi molecola polare:
A) solo SF2 B) solo SF4 C) solo SF2 e SF4 D) SF2, SF3 e SF4
soluzione
In una molecola, la distribuzione non uniforme delle nuvole elettroniche dei legami causa la formazione di dipoli elettrici ognuno dei quali è rappresentato da un vettore con intensità e direzione. La somma vettoriale di tutti i momenti di legame presenti nella molecola da origine al Momento dipolare della molecola.
Nella molecola di SF2 la cui struttura è
|
|
||
sull’atomo di S vi sono due doppietti elettronici non impegnati in legame per cui la molecola ha un momento dipolare .
La molecola SF3 non è una molecola stabile in quanto possiede un elettrone non accoppiato ed è quindi un radicale. Questa molecola ha una vita breve e la sua struttura non è stata determinata sperimentalmente ma secondo i calcoli ha una struttura a farfalla ed appartiene al gruppo di simmetria Cs
 |
3. Indicare le variabili che influenzano il comportamento di un indicatore acido-base: a) temperatura; b) forza ionica del mezzo; c) presenza di solventi organici; d) presenza di particelle colloidali; e) velocità di agitazione; f) uso di agitatori di vetro o di plastica. A) a, b B) a, b, c, d C) b, c, d D) a, e, f
soluzione
un indicatore acido base non è altro che un acido debole che in genere si indica con HIn e che si dissocia secondo la rezione:
HIn<==> H+ + In- ed ha una costante di equilibrio che viene chiamata Kind
Kind = [H+][In-] / [Hn]
l’indicatore nella sua forma indissociata HIn, quindi acida, assume il colore A e nella sua forma basica In- assume il colore B pertanto
Kind = [H+] colore B / colore A
L’occhio umano, tuttavia, quando si trova di fronte a due colori diversi A e B percepisce uno dei due colori solo quando A è 10 volte maggiore rispetto a B e recepisce il colore B solo quando B è 10 volte maggiore di A. Pertanto
Kind = [H+] 1 /10 se recepisce il colore A
Kind = [H+] 10/1 se recepisce il colore B pertanto
log Kind = log [H+] + 1 per il colore A
log Kind = log [H+] – 1 per il colore B e prendendo i valori negativi
-log Kind =-log[H+] -1 cioè PKind = PH -1
-log Kind = -log[H+] +1 cioè PKind =PH+ 1
ciò significa che percepiamo la variazione di colore quando l’indicatore si trova in un intervallo di PH di 2 unità.
Chiarito questo, vediamo quali fattori possano influenzare l’indicatore e quindi la percezione del suo viraggio.
La temperatura influenza la Kind secondo l’equazione di Arrhenius : ![]() dove ΔΕ= energia di attivazione, R la costante universale dei gas e T la temperatura assoluta.
dove ΔΕ= energia di attivazione, R la costante universale dei gas e T la temperatura assoluta.
La forza ionica del mezzo influenza l’attività degli ioni in soluzione infatti
attività= forza ionica x concentrazione a= f x C dove
f = ½ ∑ Ci Zi dove
Ci= conc. specie iesima
Zi= carica della specie iesima
L’attività ionica rappresenta la concentrazione effettiva di una specie chimica in fase liquida (solitamente acquosa). Essendo gli ioni carichi elettricamente, quando si trovano in soluzione vanno incontro ad interazioni di natura elettrostatica (di Coulomb o di Van der Waals) e quindi una certa quantità di ioni viene schermata elettricamente dal solvente e non può prendere parte al processo chimico, in questo caso l’equilibrio chimico.E ciò significa che l’attività della specie i è inferiore alla concentrazione analitica.
In una soluzione diluita ( C<10-3 M) gli ioni si trovano in pratica tutti completamente solvatati e ad una distanza r tale che le interazioni elettrostatiche risultano trascurabili tanto più quanto più è grande la costante dielettrica del solvente. Quando la concentrazione aumenta, aumenta anche il numero di ioni e pertanto le cariche elettrostatiche e di conseguenza il cammino libero medio è minore (r è piccolo) e le interazioni sono più forti.
As2O5
si dissolve rapidamente in acqua formando acido arsenico H3AsO4, scritto talvolta anche come AsO(OH)3. Si evince che si tratta di un ossido acido
Rb2O
Essendo il rubidio il primo elemento del quinto periodo della tavola periodica,con configurazione elettronica [Kr] 5s1 il suo ossido è ionico e con l’acqua forma una base RbOH idrossido di rubidio che non esiste in natura e si può ottenere dalla reazione dell’ossido con l’H2O.
- Rb2O(s) + H2O(l) → 2RbOH(aq)
RbOH è un ossido Basico
BeO
l’ossido di berillio in soluzione acida reagisce nel modo seguente:
Be(OH)2 + 2HCl → BeCl2 + 2 H2O
In soluzione basica: Be(OH)2 + 2NaOH → Na2Be(OH)
e si deduce che si tratti di un ossido anfotero.
risposta corretta A
5. Indicare il valore della f.e.m. (E) di una pila in cui un elettrodo è costituito da una lamina di rame immersa in una soluzione di ioni Cu2+ 2,50 ·10-2 M e l’altro da una lamina di Zn immersa in una soluzione di ioni Zn2+ 1,30 ·10-3 M, entrambi in condizioni standard e a 25 °C. [E°(Cu2+/Cu) = +0,342 V e E°(Zn2+/Zn) = -0,760 V]: A) -1,14 V B) 1,14 V C) 2,30 V D) 1,98 V:
soluzione
lo schema di questa pila è mostrato in figura:
E (Zn2+/Zn) = E° (Zn) + 0.059/2 log 0,0013 = – 0.76 – 0.03 x -2,88 = – 0,847 V
6. Una soluzione di rosso di metile ha una assorbanza di 0,451 a 530 nm in una cella di 5,00 mm. Indicare la molarità del rosso di metile nella soluzione. [assorbività molare del r. m. = 1,06 ·105 L mol-1 cm -1 a 530 nm]: A) 2,13 ·10-6 M B) 4,26 ·10-6 M C) 8,51 ·10-6 M D) 1,05 ·10-5 M
soluzione
Il rapporto I/Io è definito come trasmittanza del mezzo ed il logaritmo decimale del reciproco della trasmittanza prende il nome di estinzione o assorbanza:
A = log 1/T = log Io/I
La legge che mette in relazione la concentrazione di una sostanza assorbente con l’assorbanza è la legge di Lambert-Beer :
Se la concentrazione è espressa in mol/L , l’assorbanza specifica prende il nome di coefficiente di estinzione molare, e si indica con ε quindi
A = ε b c
pertanto nel caso in esame
A= 0,451
ε= 1,06 x 105
b= 0,5 cm
0,451 = 1,06 x 105 x 0,5 x C
C=0,451 / 53000
C=8,51 x 10-6 M
7. Indicare il valore del pH di una soluzione acquosa contenente 0,100 mol di acido carbossilico (Ka = 6,5 ·10-5 a 25 °C) e 0,100 mol del suo sale sodico, a cui si sono aggiunte 0,010 mol di NaOH solida, a 25 °C: A) 4,67 B) 4,23 C) 4,55 D) 4,10
soluzione
siamo in presenza di un acido debole e di un suo sale sodico quindi di un tampone
sia l’acido HA<==> H+ + A-
la concentrazione di HA sia Ca e la concentrazione del sale A- sia Cb allora
Ka= [H+] [A-] /[HA] Ka= [H+] Cb / Ca
-log Ka = -logH+ + log Ca/Cs
-log 6,5 x 10-5 = PH + log Ca/cs
Ca =0,1 -0,01 =0,09 M
Cs = 0,1 + 0,01 =1,1 M
5- log 6,5 =PH + log 0,09/ 0,11
5-0,81 =PH + 0,087 da cui
PH = 4,19 – 0,087 = 4,10
8. Indicare la pressione osmotica a 37 °C di una soluzione acquosa di urea (NH2CONH2), sapendo che essa ha un abbassamento del suo punto di congelamento di 0,52 °C e che la costante crioscopica dell’acqua vale 1,86 °C kg mol-1 . Si supponga M = m:
A) 320 kPa B) 405 kPa C) 340 kPa D) 719 kPa
soluzione
La pressione osmotica è definita quale la differenza di pressione che si esercita tra due soluzioni a diverse concentrazioni separate da una membrana semipermeabile.Se consideriamo un sistema costituito da una soluzione che contiene quindi un soluto e dal solvente puro separati da una membrana semipermeabile, le molecole di solvente attraversano la membrana per passare nella soluzione ma le particelle di soluto che si trovano nella soluzione esercitano con i loro urti sulla membrana una pressione, poichè la membrana si oppone al loro passaggio: questa pressione è appunto la pressione osmotica. Il meccanismo responsabile del passaggio del solvente verso la soluzione a maggior concentrazione è attualmente ritenuto legato alle interazioni delle molecole del soluto con la membrana e successivo trasferimento alle molecole del solvente al momento di allontanamento dalla membrana. Le particelle di soluto esercitano sulla membrana una pressione analoga a quella esercitata da un gas sulle pareti di un recipiente.La pressione osmotica,pertanto, può essere trattata come la pressione di un gas e si indica con la lettera π.
La legge che regola la pressione osmotica è stata ottenuta da Van’t Hoff:
πV = n RT
L’abbassamento crioscopico è una proprietà colligativa poichè dipende dalla massa del soluto ed è la differenza tra la temperatura di congelamento del soluto rispetto alla temperatura di congelamento del solvente puro.
ΔTc = Kc x b x i
ΔTc = Tcsolvente -Tcsoluzione
Kc = costante crioscopica
i = numero di particelle ioniche in soluzione (per es.per NaCl i=2 e per Na2SO4 i=3)
da questa espressione possiamo calcolare C, la concentrazione del soluto:
0,52= 1,86 x C x 1 da cui C = 0,279 m ed in questo caso M=m
pertanto π = n/V RT π = C x RT π = 0,279 x 0,0821 x (273+37) =0,279 x 8,314 x 310
π = 719 kPa
9. Operando in fase gassosa e in opportune condizioni, si verifica l’equilibrio cicloesano/metilciclopentano con la seguente dipendenza della Keq dalla temperatura: ln Keq = -(2059 / T) + 4,814 Individuare le variazioni di entalpia, entropia ed energia libera di reazione in condizioni standard a 298,0 K (ΔH°, ΔS° e ΔG°).
A) ΔH°= 110,9 kJ; ΔS°= 34,06 J K-1 ; ΔG°= 22,33 kJ
B) ΔH°= 241,2 kJ; ΔS°= 49,03 J K-1 ; ΔG°= 146,3 kJ
C) ΔH°= 71,19 kJ; ΔS°= 20,02 J K-1 ; ΔG°= 166,3 kJ
D) ΔH°= 17,12 kJ; ΔS°= 40,03 J K-1 ; ΔG°= 5,202 kJ
soluzione
considerato che la relazione che lega lnK alla temperatura non è altro che l’ equazione di Van’t Hoff,
lnk =-ΔH/RT + ΔS/R
lnk =-(ΔH/R) x 1/T + ΔS/R
questa è una retta y=a +bX
dove b=ΔH/R ed è la pendenza della retta che è misurabile graficamente ed a = ΔS/R cioè il punto d’incontro della retta con l’asse Y

ΔS= 4,814 x 8,314 = 40,03 J K-1
ΔH/R = -2059 ΔH=2059 x 8,314 =17,12 KJ
ΔG= ΔH -T ΔS
17120 – 298 x 40=5,2 KJ
risposta corretta D
10. L’elettrolisi di un cloruro metallico fuso di formula MeCl2 ha fatto depositare al catodo una massa di metallo pari a 0,109 g . Si indichi il peso atomico o massa atomica relativa (Ar) del metallo, sapendo che in una cella elettrolitica messa in serie alla prima si sono depositati al catodo 0,970 g di Ag, da una soluzione acquosa di AgNO3:
A) 24,2 B) 40,1 C) 87,6 D) 55,84
soluzione
Sappiamo che 96500 Coulomb depositano all’elettrodo 1 equivalente di sostanza. Essendo l’Ag depositato pari a 0,970 g gli equivalenti di Ag sono 0,970/107,8 = 9 x 10-³ equivalenti di Ag. Questi sono anche gli equivalenti del Metallo Me
pertanto essendo equivalenti=grammi /peso equivalente ed essendo il metallo bivalente il suo peso equivalente è PM/2 pertanto
0,009 = 0,109/PM/2 0,009= 0,218 /PM PM = 0,218 / 0,009 = 24,2
risposta corretta A
11. Indicare la molecola di forma ottaedrica tra le seguenti: ClF3, SF6 , XeF4, H3PO4, ciclooctatetraene:
A) H3PO4 B) XeF4 C) ciclooctatetraene D) SF6
soluzione
ClF3 ha struttura a T
12. Una soluzione di Na2S2O3 è standardizzata con KIO3 (1,210 ·10-1 g), sciolto in acqua acida per HCl, contenente KI in eccesso. Sapendo che lo iodio liberato richiede un volume di 41,64 mL della soluzione di tiosolfato per la titolazione, individuare la concentrazione del tiosolfato: A) 1,675 ·10-3 M B) 2,675 ·10-1 M C) 8,147 ·10-2 M D) 6,675 ·10-3 M
soluzione
le reazioni da considerare sono le seguenti
IO3- + 5I- + 6H+ → 3I2 + 3H2O
2S2O32- + I2 → S4O62- + 2I-l
la reazione globale da considerare è quindi
KIO3 + 6Na2S2O3 + 6H+ → 3S4O62- + I- + K+ + 12Na+ + 3H2O
sappiamo anche che volume x Molarità = numero di moli
quindi per ottenere la Molarità del tiosolfato dobbiamo calcolare il numero di moli infatti:
41,64 x Molarità= numero di moli
per calcolare il numero di moli di tiosolfato necessario per calcolare M, ricorriamo alla reazione globale
KIO3 + 6Na2S2O3 + 6H+ → 3S4O62- + I- + K+ + 12Na+ + 3H2O
da quest’ultima reazione si evince che 1 mole di KIO3 reagisce con 6 moli di Na2S2O3
poiché abbiamo 0,121 g di KNO3 iniziali cioè 0,121/214 = 0,00056542 moli possiamo calcolare le moi di Na2S2O3
se 1 mole di KNO3 reagisce con 6 moli di Na2S2O3 allora 0,00056542 moli reagiranno con X moli di Na2S2O3
1:6 = 00,00056542 :X X = 0,003394 moli o 3,394 millimoli di NaS2O3
note le moli, possiamo calcolare la Molarità di Na2S2O3 infatti:
41,64 ml x M = 3,394 da cui M= 8,147 x 10-2 M
risposta corretta C
13. Indicare la specie in cui il numero di ossidazione di H è diverso da quello delle altre tre:
A) AlH3 B) H3PO3 C) H3AsO4 D) NH3
soluzione
AlH3 è un composto tra un metallo e l’idrogeno e viene definito idruro di alluminio.
In tutti gli idruri, l’idrogeno ha numero di ossidazione -1 essendo i metalli meno elettronegativi dell’idrogeno. Secondo la nomenclatura IUPAC l’ idruro è chiamato diidruro se vi sono due atomi di H , triidruro se ve ne sono 3 e così via.. idruri sono anche la fosfina(PH3) l’arsina(AsH3) e il diborano(B2H6). Si considera il numero di ossidazione dell’Idrogeno -1 quando è legato con metalli negli idruri ionici.
Negli idruri covalenti, invece, formati dagli elementi del III, IV,V gruppo, (NH3, PH3, SiH3… e simili) si considera che H abbia numero di ossidazione +1.
In H3PO4 ed H2AsO4 il n. o. dell’idrogeno è +1
Risposta corretta A
14. Per ozonolisi riduttiva (cioè seguita da trattamento con Zn/H+ o Me2S) si può trasformare il ciclopentene in:
A) aldeide pentandioica
B) 2,4-pentandione
C) ac. pentanoico
D) ciclopentanolo
soluzione
L molecola di ciclopentene è la seguente:
 e la struttura dell’ozono può essere scritta come un ibrido di risonanza:
e la struttura dell’ozono può essere scritta come un ibrido di risonanza:
1 2
![[Immagine: ozone.gif]](http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/Images4/ozone.gif)
il doppio legame viene attaccato dall’ozono formando un molozonuro che però è instabile
 e subito dopo il legame tra i due atomi di O si spezza
e subito dopo il legame tra i due atomi di O si spezza
La successiva riduzione (Zn/H+) trasforma il gruppo COO- in CHO formando il composto
OHC –CH2-CH2 -CH2 -CHO cioè l’ aldeide pentandioica
risposta corretta A
15. Indicare il numero di composti non ciclici di formula C4H8:
A) 1 B) 2 C) 3 D) 4
soluzione
CH2=CH-CH2-CH3 CH3-CH=CH-CH3 (CH3)2C=CH2 CH2=C(CH3)-CH3
risposta esatta D
16. Indicare i coefficienti, riportati in ordine confuso, della seguente ossidoriduzione:
MnO4 – + H2O2 + H+ →Mn2+ + O2 + H2O
A) 5, 2, 2, 4, 5, 7 B) 6, 3, 2, 4, 5, 6 C) 1, 2, 4, 3, 5, 8 D) 6, 2, 2, 5, 5, 8
soluzione
2[MnO4- + 8H+ +5e → Mn+2 + 4H2O
5[H2O2 → O2 + 2 e +2H+
_____________________________
2MnO4- + 5O-2 +16 H+ → 2Mn+2 + 5O2 + 10H++ 8H2
semplificando si ha
2MnO4- + 5O-2 +6 H+ → 2Mn+2 + 5O2 + 8H2O
risposta corretta D
17. Indicare la proprietà detta colligativa di una soluzione ideale: A) il potere ottico rotatorio B) il pH C) l’indice di rifrazione D) la pressione osmotica
soluzione
Una proprietà colligativa è una proprietà di una soluzione che dipende solamente dal numero di particelle che costituiscono la soluzione e non dalla natura delle particelle stesse siano esse ioni o molecole, o aggregati supramolecolari. Da un punto di vista termodinamico una proprietà colligativa dipende dal fatto che un soluto aggiunto ad un solvente A puro ne diminuisce il potenziale chimico μa che è uguale a :
dove è la frazione molare del solvente.
L’aggiunta di un soluto non volatile ad un solvente provoca un aumento del punto di ebollizione rispetto al solvente puro (innalzamento ebullioscopico) o ne abbassa il punto di congelamento (abbassamento crioscopico) rispetto a quello del solvente puro. L’effetto è direttamente proporzionale alla concentrazione molale (m) del soluto
- T e b s o l u z i o n e − T e b s o l v e n t e = Δ T e b = Keb x m
- T c s o l v e n t e − T c s o l u z i o n e = Δ T c = K c ⋅ m }
dove: Keb rappresenta la costante ebulloscopica del solvente e Kc rappresenta la costante crioscopica molale del solvente : Keb e Kc sono costanti caratteristiche per ogni solvente.
Anche la tensione di vapore di una soluzione contenente un soluto non volatile è sempre inferiore a quella del solvente puro.
Se consideriamo due soluzioni a concentrazione diversa, separate da una membrana semipermeabile si osserva un movimento netto del solvente attraverso la membrana dalla soluzione più diluita a quella più concentrata (o dal solvente puro verso la soluzione) fino al raggiungere una situazione di equilibrio. Il processo viene definito Osmosi e la pressione che occorre applicare sulla soluzione più concentrata per riportarla al livello di quella più diluita è detta Pressione Osmotica ed è una proprietà colligativa.
La pressione osmotica (π) = CRT = π x V = (g/PM) RT x i
dove i = NUMERO DI PARTICELLE IN SOLUZIONE ed è quindi una proprietà colligativa.
né il pH né il potere rotatorio o l’indice di rifrazione sono proprietà colligative.
Il potere rotatorio è la misura dell’attività ottica di una sostanza, cioè la proprietà che hanno alcuni composti di far ruotare il piano di vibrazione di una radiazione polarizzata.
Il potere rotatorio specifico delle soluzioni è regolato dalla legge di Biot che determina la dipendenza della rotazione dalla concentrazione della sostanza otticamente attiva:
dove l è il cammino ottico (in dm) della cella in cui è contenuta la soluzione e c è la concentrazione in g/ml.
La relazione che lega il potere rotatorio alla temperatura è invece
- [
dove t è la temperatura in °C e n una costante di temperatura caratteristica per ciascuna sostanza.
Il PH dipende dalla quantità di H+ presente in soluzione ma dipende anche e soprattutto dal tipo di sostanza presente.
Da quanto esposto si evince che la risposta corretta è D
18. Indicare il gas inodore, tra i seguenti: CH4, NH3, O3, HCl: A) CH4 B) NH3 C) O3 D) HCl
soluzione
HCl, NH3 ed O3 hanno odore caratteristico. Il metano è invece inodore, tant’è vero che essendo adoperato quale gas di città, per individuare eventuali perdite altrimenti impercettibili si aggiungono al metano composti chiamati mercaptani dall’odore particolarmente pungente e tipico.
19. Il metodo di Kjeldahl è usato per determinare il contenuto di N negli alimenti. Per la farina, il campione è mineralizzato per riscaldamento in presenza di H2SO4 e di un catalizzatore che trasforma l’N in ammonio solfato. Si aggiunge quindi NaOH conc che sviluppa NH3(gas), che è quindi raccolta nella soluzione di un acido in eccesso che viene retrotitolato. Si risale infine alla % in massa dell’N e poi delle proteine moltiplicandolo per un fattore = 5,70. Nell’analisi di un campione di farina (7,121 ·10-1 g) l’NH3 formata, è distillata e raccolta in HCl(aq) in eccesso (25 mL; 4,977 ·10-2 M) che nella retrotitolazione richiede NaOH (3,970 mL; 4,012 ·10-2 M). Individuare la % in massa di proteine nella farina:
A) Proteine 12,16 % B) Proteine 10,16 % C) Proteine 13,16 % D) Proteine 8,160 %
soluzione
l’acido iniziale è calcolato da Volume(ml) x molarità = millimoli
HCl iniziale = 25 x 0,04977 =1.244 mmoli
la retrotitolazione ci indica la quantità di acido che non ha reagito con l’NH3 :
3,97 x 0,04012 =0,1593 mmoli di HCl che NON hanno reagito con NH3
ciò significa che con l’NH3 hanno reagito 1,244 0,159 = 1,085 mmoli di8 acido che corrispondono alle mmoli di NH3
La quantità di NH3 è quindi = meq x pM= mg NH3
1,085 x 17 = 18,445 mg = 0,018445 g di NH3
la quantità di N è calcolata da
PMNH3 :1N = 0,018445 g 😡 X= 14 x 0,018445 /17 = 0,01518 g di N in 0,7121 g di campione iniziale di farina
possiamo quindi calcolare la % di N nella farina :
0,7121 : 0,01518 = 100 :X X=% N= 1,518 /0,7121= 2,13 % di N
moltiplicando per 5,7 si ottiene la % di proteine nel campione di farina
2,13 x 5,7= 12,16 /%
20. Indicare la molecola che NON è un ammino acido naturale o sintetico:
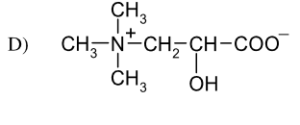
soluzione
gli amminoacidi sono composti organici che nella loro struttura presentano sia il gruppo amminico (-NH2)sia quello acido (-COOH)
Il composto A è chiamato ALANINA ed è un ammino acido
il composto B è un amminoacido ed è chiamato GABA cioè Acido Gamma Ammino Butirrico ed è un neurotrasmettitore inibitorio responsabile della eccitabilità neuronale
il composto C è un amminoacido Beta idrossiprolina
il composto D pur possedendo il gruppo trimetilamino (CH3)3 N- ed il gruppo COOH possiede anche un gruppo alcolico OH in alfa al carbossile e non si tratta di un amminoacido naturale
risposta corretta D
21. Indicare l’affermazione ERRATA a proposito della fenolftaleina (pKa = 9,7):
A) è una sostanza colorata che, in soluzione acquosa, è incolore nella forma molecolare mentre è di color rosso-fucsia nella sua forma dissociata
B) è un indicatore che si presenta come un solido rosso-fucsia, solubile in acqua ma non in etanolo
C) in una soluzione basica (pH = 11) ha colore rosso-fucsia
D) è un indicatore il cui colore rosso-fucsia, presente in soluzione moderatamente basica, tende a scomparire in soluzione fortemente basica
soluzione
La fenolftaleina (nome IUPAC: 3,3-bis(4-idrossifenile)-1,(3H)-isobenzofuranone) è un indicatore di PH usato nelle titolazioni acido-base. A temperatura ambiente la fenolftaleina è una polvere cristallina bianca inodore, insolubile in acqua e solubile in etanolo (14 g/l) viene generalmente usata in etanolo allo 0,1%.A PH inferiori a 8,2 è incolore, a pH superiori a 9,8 ha un intenso color porpora
si deduce che la risposta errata è la B .
22. Un acido grasso è indicato con la sigla C18:3 (9,12,15). Indicare il numero di atomi di idrogeno presenti nella sua molecola: A) 30 B) 28 C) 32 D) 26
soluzione:
Un acido grasso è un acido organico costituito da una catena di atomi di carbonio,(catena alifatica), con un gruppo carbossilico (-COOH) ad una delle estremità. In un acido grasso si indica precisando il numero di atomi di C di cui è composto ad es. C14 (14 atomi di carbonio) C15( 15 atomi di carbonio) C18 (18 atomi di carbonio) ecc.Nella catena alifatica possono essere presenti uno o più doppi legami e pertanto l’acido grasso è definito INSATURO, mentre se non vi sono doppi legami è definito SATURO.Il numero di doppi legami viene indicato dopo due puntini ad es. C!8:1 significa che in questo acido grasso vi è 1 doppio legame. Per indicare la posizione del doppio legame si numera la catena di atomi di carbonio attribuendo il numero 1 all’atomo di carbonio del carbossile. Quindi un acido grasso C18:1 Δ3 è un acido che ha 18 atomi di C 1 doppio legame situato sul 3° atomo di carbonio cioè il terzo atomo di C dopo il COOH. Lo stesso acido può essere indicato come C18:1 ω3 ( omega 3 )
Se la molecola contiene doppi legami -CH=CH- i due atomi di idrogeno possono trovarsi in posizione CIS (dalla stessa parte H H o dalla parte opposta H
C ===C C===C
cis H trans
in natura prevalgono gli acidi grassi Cis che invece sono presenti dopo trattamenti tecnologici vari (quali ad es idrogenazioni per ottenere le margarine). Gli acidi grassi TRANS causano nell’uomo un aumento dele lipoproteine LDL volgarmente definite colesterolo cattivo ed una diminuzione della frazione di lipoproteine HDL (colesterolo buono).L’acido C18:3 (9,12,15) o meglio C18:3 (Δ9,12,15) è un acido con 18 atomi di C e 3 doppi legami di cui il primo sul C9 il secondo sul C12 ed il terzo sul C15. Un idrocarburo saturo alifatico con 18 atomi di C contiene 38 atomi di H CnH2n+2 se contiene 3 doppi legami contiene 3x 2 =6 atomi di H in meno ed infine se ha ad una estremità al posto di CH3 il gruppo COOH contiene altri 2 atomi di idrogeno in meno.
Si deduce quindi che l’acido C18:3 (9,12,15) contiene 38-6-2 = 30 atomi di C.
risposta corretta A
23. Indicare l’energia cinetica di una mole di molecole di azoto a 25 °C:
A) 1,24 ·104 J mol-1
B) 3,72 ·103 J mol-1
C) 2,56 ·103 J mol-1
D) 5,79 ·103 J mol-1
soluzione
la teoria cinetica dei gas ci permette di ottenere l’espressione matematica relativa al calcolo dell’Energia Cinetica delle molecole. Se consideriamo un gas in un recipiente cubico di lato L è possibile calcolare la pressione esercitata dal gas dovuta agli urti delle numerosissime molecole gassose contro le pareti del recipiente che le contiene. Se consideriamo un gas perfetto, in cui le molecole sono considerate puntiformi e senza alcuna interazione tra esse, gli urti tra le particelle del gas e tra queste e il recipiente sono ritenuti elastici, per cui si applicano le leggi della conservazione dell’energia cinetica e della quantità di moto per cui le molecole del gas, quando colpiscono le pareti del recipiente, cedono loro una parte della loro quantità di moto. Se si indica con v la velocità media delle molecole del gas, la quantità di moto ceduta alla parete da ciascun urto è data da:

Se il gas è contenuto in un recipiente a forma di cubo con lato L, il tempo medio che ciascuna particella impiega nell’attraversare il recipiente (andata e ritorno) è dato da:

Quindi il numero di volte che mediamente una molecola impiega a colpire una parete nell’unità di tempo, cioè la frequenza degli urti, è dato da:

Per trovare la pressione, definita come la forza che agisce sulla parete per unità di superficie, si può ricorrere alla legge fondamentale della dinamica, scritta in termini di quantità di moto:

Dove  (mv)/
(mv)/ t è la variazione della quantità di moto della particella nell’unità di tempo. Moltiplicando la variazione della quantità di moto della particella, pari a 2mv (in quanto la particella compie un tragitto di andata e ritorno), per il numero di volte che una particella colpisce la parete nell’unità di tempo, dato dalla (1), si ottiene il valore della forza che mediamente agisce su una parete del recipiente in seguito all’urto di ciascuna particella:
t è la variazione della quantità di moto della particella nell’unità di tempo. Moltiplicando la variazione della quantità di moto della particella, pari a 2mv (in quanto la particella compie un tragitto di andata e ritorno), per il numero di volte che una particella colpisce la parete nell’unità di tempo, dato dalla (1), si ottiene il valore della forza che mediamente agisce su una parete del recipiente in seguito all’urto di ciascuna particella:

La pressione, data da questo valore diviso per la superficie della parete, L2, vale quindi:

Dove V = L3 è il volume del recipiente e  = m/V la densità del gas che occupa il recipiente. Il ragionamento esposto è stato fatto considerando solo una componente della velocità delle particelle, ma, supponendo che nelle tre direzioni le molecole abbiano uguale velocità e che solo 1/3 delle particelle si muova nella direzione considerata (poiché si suppone uguale probabilità di movimento in tutte e tre le direzioni), la pressione media in una delle tre direzioni sarà più propriamente data da:
= m/V la densità del gas che occupa il recipiente. Il ragionamento esposto è stato fatto considerando solo una componente della velocità delle particelle, ma, supponendo che nelle tre direzioni le molecole abbiano uguale velocità e che solo 1/3 delle particelle si muova nella direzione considerata (poiché si suppone uguale probabilità di movimento in tutte e tre le direzioni), la pressione media in una delle tre direzioni sarà più propriamente data da:

Se nel recipiente sono contenute N molecole, la pressione sarà data da:

Quindi, la pressione che il gas complessivamente esercita sul recipiente è proporzionale al numero totale di molecole e inversamente proporzionale al volume occupato dal recipiente. Comprimendo per esempio il gas, cioè diminuendo il suo volume, la pressione aumenta, in accordo con la legge di Boyle.
Ricordando infine che Ecin = 1/2 mv2 è l’energia cinetica media di ciascuna delle particelle del gas, la (3) si può scrivere anche come:

e, ricordando l’equazione di stato dei gas perfetti, si giunge alla relazione tra l’energia cinetica media di ciascuna particella e la temperatura assoluta del gas, ovvero:

in cui N è il numero totale di molecole contenute nel recipiente, n il numero di moli.
Pertanto Ecin = 1,5 x 8,314 x 298 =3716,58 J/mol= 3,72 x 10³
24. Da 100,0 mL di una soluzione acquosa di HCl in cui sono sciolti 2,981 ·10-1 g di un campione che contiene una % di sulfanilamide, si preleva un volume esatto (20,00 mL) e lo si tratta con KBrO3 (aq) (25 mL; 1,767 ·10-2 M), in presenza di un eccesso di KBr, in un recipiente chiuso. Dopo 10 min, la sulfanilamide è tutta bromurata
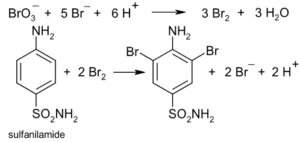
Il bromo residuo è trattato con un eccesso di KI (vedi sotto) per poter titolare l’I2 formato con Na2S2O3 (12,92 mL; 1,215 ·10-1 M). Br2 + 2 I- 2 Br + – I 2 (eccesso di KI) I 2 + 2 S2O3 2- 2 I + – S4O6 2- Determinare la % in massa dell’ammide (Mr = 172,21) nel campione iniziale: A) 21,49 % B) 23,76 % C) 45,78 % D) 80,47 %
soluzione
la quantità iniziale di Bromo può essere calcolata considerando quanto KBrO3 è stato consumato per produrlo. Infatti sono stati consumati 25 x 0,01767 = 0,442 millimoli di KBrO3 in 20 ml.Il campione iniziale però era 100 ml quindi la quantità consumata da 100 ml è data da
0,442x 5 =2,21 mmoli di KBrO3 consumati
poichè 1 mole di KBrO3 produce 3 Br2 secondo la reazione BrO3- +5Br- +6H+ →3 Br2 + 3H2O
allora la quantità totale di Br2 prodotta è calcolata dalla proporzione
1:3 = 2,21 : X X= 6, 63 mmoli di Br2 prodotto da 100 ml
Adesso calcoliamo la quantità in eccesso di Br2 che ha reagito, in 20 ml ricordando che il Bromo, identico allo iodio reagito, è 12,92 x 0,1215 = 1,569 mmoli di Na2S2O3.
Poichè però 2 moli di Na2S2O3 reagiscono con 1 mole di iodio secondo la reazione I2+ 2Na2S2O3 →2I- + S4O6-2 allora se 2:1 = 1,569 :X X= 1,569/2 = 0,77 mmoli di Br2 in eccesso (in 20 ml )
In 100 ml iniziali il Bromo in eccesso è quindi 3,85 mmoli
la differenza tra le mmoli iniziali e quelle in eccesso fornisce la quantità in mmoli di Br2 che hanno reagito con l’ammide
6,63 – 3,85= 2,78 mmoli di bromo, ma 1 mole di amide reagisce con 2 di bromo quindi le mmoli di amide sono
2,78 /2 = 1,393 mmoli di amide cioè 1,393 x 172,21 = 239,9 mg di amide cioè 0,2399 g di amide
pertanto la % di amide nel campione è calcolata da
0,2981: 0,2399 =100:X X = 23,99/0,2981=80,47 %
25. Indicare il prodotto principale della reazione dell’(S)-2-clorobutano con KCN in tetraidrofurano: A) (S)-2-cianobutano B) (R)-2-cianobutano C) 1-butene D) miscela di (E) e (Z)-2-butene
soluzione
Le reazioni degli alogenuri alchilici possono essere di sostituzione (in cui l’alogeno X viene sostituito da un gruppo nucleofilo come OH- CN- ecc.) oppure di eliminazione in cui viene eliminato HX con formazione di un doppio legame . La sostituzione dell’ alogeno X può avvenire con due meccanismi possibili che vengono indicati con SN1 ed SN2.
Con SN1 si indicano le reazioni di Sostituzione Nucleofila Monomolecolare in cui il carbonio saturo ibrido SP3 viene attaccato dal nucleofilo Z– che è legato all’alogeno X e questo vene espulsa: si ha cioè una sostituzione di X con la specie Z.
Il termine Nucleofilo deriva dal fatto che Z- attacca un orbitale vuoto del C della molecola che porta la specie X e subisce quindi l’attrazione da parte del nucleo del C che è positivo.
Il numero 1 o 2 indica che la reazione è monomolecolare oppure bimolecolare
termini che si riferiscono al meccanismo di reazione, in cui nel primo caso è implicata una sola molecola cioè quella che porta l’alogeno il che significa che dipende solo dalla concentrazione di RX nello stadio lento della reazione
e quindi cinetica di reazione è del primo ordine v = k [RX] e non è influenzata né dalla concentrazione di Z–, né dalla sua natura. Le reazioni SN1, avvengono in due stadi distinti, il primo dei quali è lento e determina la velocità di reazione, al quale partecipa solo la specie RX, ( infatti Z- è utilizzato in forma diluita ed in soluzione non troppo basica affinché non possa intervenire nel primo stadio) ed uno veloce nel quale interviene il nucleofilo Z–. Il primo passaggio, lento, consiste nella formazione di un carbocatione, R-CH+ R1 e tanto più stabile è il carbocatione che si forma tanto più facilmente avviene la sostituzione, infatti reagiscono meglio gli alogenuri terziari, allilici e benzilici mentre avvengono meno facilmente con gli alogenuri secondari, primari vinilici e fenilici.
CH3-CH2-CH2-CH2+ carbocatione primario
+ CH3-CH2-CH-CH3 carbocatione secondario
+
CH3-C-CH3
| carbocatione terziario
CH3
I carbocationi hanno una struttura planare trigonale con il carbonio che porta la carica positiva ibrido sp2 più stabile rispetto a quella sp3. Infatti, un carbocatione sp2 usa un orbitale 2p vuoto che è meno stabile di un orbitale vuoto SP3 che ibridizza anche un orbitale 2s più stabile che invece un ibrido SP2 utilizza solo per i tre legami ibridi planari e stabili con angolo di a 120°.
Se l’alogenuro di partenza è chirale, la reazione SN1 provoca, nella soluzione finale, una quasi totale perdita di attività ottica, cioè si ottiene una quasi totale racemizzazione.
Il meccanismo SN2 è invece Sostituzione Nucleofila Bimolecolare.
il che indica che nello stadio lento della reazione sono coinvolte due molecole Z- ed RX e quindi la reazione ha una cinetica del secondo ordine. v = k [Z–] [RX] cioè la velocità dipende sia dalla concentrazione della specie RX sia dalla concentrazione del nucleofilo Z– e dal tipo di nucleofilo.
Le reazioni SN2 avvengono facilmente in quelle molecole che non possiedono ingombro sterico sul carbonio SP3 che porta la specie X quindi negli alogenuri metilici, primari, allilici, benzilici ma anche se in e in minor misura in quelli secondari, mentre non avvengono con gli alogenuri terziari .
Se si riscalda un alogenuro alchilico con una soluzione di KCN l’alogeno è sostituito dal gruppo CN .
La scelta del solvente è importante, in quanto la presenza di tracce di acqua porta alla sostituzione dell’alogeno con OH e non con CN quindi la reazione è effettuata in tetraidrofurano.
La reazione di sostituzione è una reazione SN2 in cui la formazione del legame con CN è contemporanea all’allontanamento del Cl- : si tratta quindi di un meccanismo che prevede un unico stadio. L’attacco del CN- avviene dalla parte opposta a quella del Cl e si forma un intermedio in cui il C su cui avviene la sostituzione cambia la sua ibridizzazione da SP3 ad SP2. Nell’esempio sotto riportato R1 è H R2 è il gruppo CH3-CH2- ed R3 è il gruppo -CH3
LG è Cl mentre Nu (il nucleofilo) è CN-
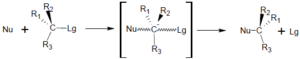
la reazione avviene quindi con inversione della configurazione (inversione di Walden).
Dal composto (S)-2- clorobutano si forma pertanto il composto (R)-2-cianobutano.
26. Indicare l’affermazione corretta a proposito delle reazioni intramolecolari:
A) seguono tutte una cinetica del secondo ordine
B) vanno effettuate ad alta diluizione (principio della massima diluizione o di Rugli) perché così la reazione (cinetica del primo ordine) è favorita rispetto ad altre reazioni bimolecolari (cinetica del secondo ordine)
C) vanno effettuate a elevate concentrazioni perché così la reazione (cinetica del primo ordine) è favorita rispetto ad altre reazioni bimolecolari (cinetica del secondo ordine)
D) seguono una cinetica di ordine 0
soluzione
Una reazione intramolecolare è una reazione in cui due siti reattivi presenti nella stessa molecola reagiscono tra loro. Un esempio di reazione intramolecolare è una reazione di condensazione: in una reazione di condensazione intramolecolare la reazione di condensazione avviene tra due gruppi funzionali presenti nella stessa molecola dando spesso luogo alla ciclizzazione della molecola con eliminazione di una molecola a basso peso molecolare. Un esempio di reazione intramolecolare è la Formazione di β-chetoesteri ciclici infatti in presenza di un alcossido NaOET i diesteri danno luogo a una condensazione intramolecolare nota come condensazione di Dieckmann per dare un un β-chetoestere e un alcol
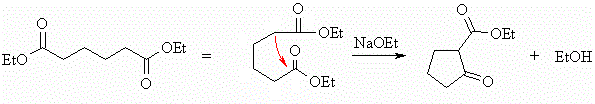
28. Indicare le grandezze che hanno la stessa unità di misura: A) energia termica, lavoro e pressione B) energia termica, lavoro e temperatura C) energia termica, lavoro e PV = K della legge di Boyle D) lavoro, TV ed energia elettrica
Soluzione
sappiamo che l’energia termica per il primo principio della termodinamica è E= Q + lavoro
Poichè il lavoro è dato dal prodotto PΔV è evidente che sia l’energia che il lavoro e quindi PΔV sono espressi nelle stesse unità di misura.
Risposta corretta C
29. La reazione di conversione dei chetoni in esteri per azione dei perossiacidi è detta reazione di: A) Diels-Alder B) Baeyer-Villiger C) Wittig D) Cannizzaro
soluzione
la reazione è la seguente:

la reazione di Wittig permette la preparazione di un alchene da un’aldeide o chetone con un ilide generato da un sale di fosfonio:



la reazione di Cannizzaro è una reazione di disproporzione di un’aldeide in presenza di OH- per formare un acido ed un alcol
30. Una miscela racemica è formata da quantità uguali di: A) isomeri cis-trans B) diastereomeri C) enantiomeri D) isomeri costituzionali
soluzione
Il termine cis o Trans si riferisce a stereoisomeri che hanno una disposizione degli atomi in molecole contenenti un doppio legame oppure in strutture ad anello. Le strutture cis possiedono gli atomi dalla stessa parte rispetto al piano del doppio legame e trans dalla parte opposta
i diastereoisomeri sono due isomeri due che non sono l’uno l’immagine speculare dell’altro, infatti, possiedono la stessa formula molecolare e connettività fra gli atomi ma hanno un orientamento nello spazio diverso, pur non essendo immagini speculari
31. Indicare l’elemento che è prevalentemente ottenuto dall’acqua di mare. Il suo nome deriva dal greco e vuol dire puzza. L’elemento viene utilizzato per preparare fumogeni, sostanze ignifughe, composti per la depurazione delle acque, coloranti, medicinali, disinfettanti, sali inorganici per pellicole fotografiche e per preparare un emulsionante presente in varie bevande al sapore di limone:
A) iodio B) zolfo C) bromo D) piombo
soluzione
Il bromo è l’elemento con n.atomico 35 il cui simbolo è Br. Il suo nome deriva dal greco βρόμος, bròmos, che significa «fetore, puzza ». Fa parte del gruppo degli alogeni assieme a iodio, fluoro e cloro.
risposta corretta C
32. Calcolare la variazione ΔG303 nel processo di solubilizzazione di 100,0 kg di etanolo in 1,00 m3 di acqua, ammettendo che la soluzione ottenuta sia a comportamento ideale: A) -2,348 · 107 J B) -7,745 ·107 J C) 7,745 ·104 J D) -4,687 ·107 J
soluzione
33. Lo studio cinetico della reazione tra gas: A (g) → B (g) + C (g) condotto valutando la pressione totale in funzione del tempo, a 50 °C, ha fornito i seguenti risultati:
determinare il valore della costante cinetica: A) 3,000 ·10-4 min-1 B) 6,000 ·10-4 min-1 C) 3,000 ·10-3 min-1 D) 6,000 ·10-5 min-1
la cinetica del primo ordine ci dice che P = Po e-kt mettendo in grafico sull’asse X il tempo e sull’asse Y ln(P) si ottiene una retta il cui valore della pendenza è -k dove k è la costante di velocità. Facendo i calcoli ln ( P/ P₀ ) = – kt
Po = 1000 P2= 1003 quando t= 5,00 Po = 1000 P3= 1012 quando t= 20 Po = 1000 P4= 1020 quando t= 33,33 Po = 1000 P5= 1039 quando t=66,66 Po = 1000 P6= 1095 quando t= 166,7 Po = 1000 P7= 1259 quando t=500 Po = 1000 P2= 1451 quando t= 1000 Po = 1000 P2= 1599 quando t= 1500 Po = 1000 P2= 1699 quando t= 2000
(P/Po) t ln(P/Po)
1,003 5 0,00299 0,000598
1,012 20 0,0119 0,000595
1,020 33,33 0,0198 0,000594
1,039 66,66 0,0382 0,000573
1,095 166,7 0,090 0,0005398
1,259 500 0,230 0,004600
1,451 1000 0,372 0,00372
1,599 1500 0,469 0,0033
dai dati si evince che K= 5,9 x 10-4 min–1
34. Un composto A di formula molecolare C8H10 forma un solo composto di mono-nitrazione e tre composti di di-nitrazione. Se ne può dedurre che A è: A) etilbenzene B) 1,2-dimetilbenzene C) 1,3-dimetilbenzene D) 1,4-dimetilbenzene
soluzione


Dimetilbenzene, C6H4(CH3)2, C8H10 esiste in tre forme isomere, che si differenziano per la posizione dei due gruppi metilici CH3 nell’anello aromatico. l’etilbenzene C6H5C2H5. è un isomero degli xileni. Per nitrazione, con una miscela di acido nitrico e solforico, si ottengono i nitroxileni.
La mononitrazione dell’1-2 dimetil benzene fornisce il prodotto orto
 ma non i tre prodotti di nitrazione
ma non i tre prodotti di nitrazione
anche il meta Xylene fornisce solo un prodotto di nitrazione.

Il paraxylene 1-4 dimetilbenzene fornisce sia il mono nitrato che 3 composti dinitrati


 questa molecola dinitrata possiede i due gruppi nitro in posizione 2-3 .
questa molecola dinitrata possiede i due gruppi nitro in posizione 2-3 .
le altre due molecole dinitrate possiedono, la prima 2 gruppi nitro in posizione 2-5 e l’altra in posizione 2-6
risposta corretta D
35. L’ossidazione dell’ossido nitrico (NO) a diossido di azoto:
2 NO (g) + O2 (g) → 2 NO2 (g) ΔH°298 = -113,1 kJ
è un passaggio chiave nella formazione dello smog. Immaginando che 6 moli di NO reagiscano con 3 mol di O2, a 101,325 kPa e 25 °C per formare NO2, indicare il lavoro effettuato dal sistema contro la P esterna e il ΔE per la reazione, immaginando che sia quantitativa. A) 4,39 kJ; 311,9 kJ B) 6,39 kJ; -111,9 kJ C) 7,39 kJ; -331,9 kJ D) 2,39 kJ; 318,9 kJ
soluzione
dal primo principio della termodinamica sappiamo che il lavoro compiuto da un gas contro una pressione esterna P è: L= -P(V2-V1) mentre la variazione di energia del sistema è:
ΔΕ = ΔΗ – P(V2-V1)
Per calcolare V2-V1 sappiamo che nella reazione 6NO +3O2→ 6NO2
le moli di gas sono inizialmente 9 (6+3) ed alla fine della reazione sono solo 6 moli di NO2 alla pressione di 101,325 kPa (1 atmosfera) e 298K .
la variazione di volume è calcolata dalla 9-6 =3 moli quindi il volume è V=3 =ΔV
PV= nRT V= 3 x 0,0821 x 298=3 x 24,4 essendo P= 1 atm P ΔV= 73,2 litri
il valore di ΔV è però negativo in quanto il volume finale ( V2=6 m0li di NO2 e V1 =9 moli) quindi
ΔV= V2-V1= – 73,2 litri
essendo pertanto L=- PΔV= (-73,2 ) litri atm cioè L = 73,2 litri atm
sappiamo però che 1 litro-atm =101 J quindi
L=- PΔV= 73,2 x 101 J = 7393,2 J cioè 7,39 kJ
essendo la allora essendo la reazione data 6NO +3O2→ 6NO2 essa è 3 volte la reazione
2NO +O2→ 2NO2 ΔH = -113,1 x 3 quindi per la reazione 6NO +3O2→ 6NO2 ΔH = -113,1 x 3 = 339,3
pertanto essendo
ΔΕ = ΔΗ – PΔV ΔΕ = 339,3-7,39 = 331,9 kJ
risposta corretta C
36. Il quarzo è un minerale che presenta una elevata resistenza agli attacchi chimici. Per sciogliere il quarzo occorre: A) una soluzione di 3 parti di H2SO4 conc. e 1 parte di H2O2, al 30 % (soluzione Piranha) B) una soluzione di 3 parti di HCl conc e 1 parte di HNO3 conc (acqua regia) C) una miscela di una parte di H2SO4 conc e 1 parte di HNO3 conc. (miscela solfonitrica) D) NaOH fuso
soluzione
la prima soluzione così come la seconda e la terza sono costituite con una parte di HNO3, che è un forte ossidante per cui, le soluzioni proposte non sono adeguate a sciogliere SiO2 in quanto il silicio si ossiderebbe formando sempre SiO2, si deduce quindi che l’ NaOH fuso è il solvente ideale per il quarzo:
SiO2 + 2 NaOH → Na2SiO3 + H2O.
risposta corretta D
37. Il trizio è un isotopo radioattivo dell’idrogeno con tempo di semi trasformazione di 12,3 anni. Ciò significa che in un sistema chiuso: A) trascorsi 24,6 anni, tutto il trizio si è decomposto B) trascorsi 36,9 anni, la massa di trizio si è ridotta a un terzo di quella iniziale C) trascorsi 49,2 anni, rimane meno del 7 % della massa iniziale di trizio D) trascorsi 4,1 anni, si è decomposto un terzo del trizio iniziale
soluzione
Il trizio il cui simbolo è 3H o T, possiede un nucleo formato da un protone e due neutroni. Il trizio decade emettendo particelle β– (che sono elettroni) e si trasforma in elio
-
- T → 3 2He + e− + νe
essendo il tempo di dimezzamento il tempo che impiega per ridursi della metà, supponendo che inizialmente sia 100 g dopo 12,3 anni si riduce a 50 g e dopo 24,6 anni si riduce a 25 , dopo 36,9 si riduce a 12,5 e dopo 49,2 anni si riduce a 6, 08 g mentre dopo 4,1 anni è ridotto a 100-33,3 = 66,6 anni .
La risposta corretta è C infatti dopo 49,2 anni si riduce a meno del 7% (6,08 %)
38. Un composto di formula C4H7O2Cl mostra un forte assorbimento a 1749 cm -1 . Nello spettro HNMR il composto mostra i seguenti segnali: un quartetto a d 4,47 ppm di area relativa 1; un singoletto di area relativa 3 a d 3,75 ppm, un doppietto di area relativa 3 a 1,73 ppm. Indicare quale struttura, tra le seguenti, può essere attribuita al composto:
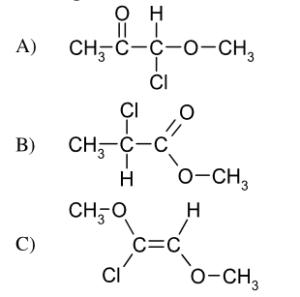
soluzione
il forte assorbimento a 1749 cm-1 fa propendere per un estere. Il singoletto a 3,75 corrisponde ad un legame CH3-O-C , un doppietto ad 1,73 corrisponde ad un carbonio terziario.Il quartetto a 4,47 corrisponde al legame CH-Cl. Questo ci fa concludere per la molecola B .
39. Una titolazione richiede due letture sequenziali di una buretta. Se la deviazione standard per la lettura della buretta è ±0,02 mm, la deviazione standard per il volume della titolazione è: A) ± 0,01 B) ± √0,0002 mL C) ± √0,0008 mL D) ± 0,02
soluzione
il calcolo da fare è σ =±√ (0,02)² + (0,02)² = ±√0,0008
la risposta corretta è C
40. Indicare l’alogenuro che non può funzionare da acido di Lewis.
A) SnCl4 B) SbCl5 C) BF3 D) CCl4
soluzione
Un acido di Lewis è una qualsiasi molecola o ione che è in grado di accettare una coppia di elettroni.
|
|
||
SbCl5 è un acido di Lewis molto forte ed accetta facilmente ioni cloruro, infatti, con adatti donatori di Cl– forma composti ionici contenenti lo ione esacloroantimoniato, SbCl6–
- AlCl3 + SbCl5 → [AlCl2]+[SbCl6]–
Il trifloruro di Boro
è un acido di Lewis e forma addotti con basi di Lewis . Rispetto a BCl3 e BBr3 ha un caratterre acido di Lewis più basso a causa della debolezza del legame che si forma con l’addotto L.
41. Indicare l’affermazione corretta per ogni reazione che segua una cinetica del primo ordine: A) solo una sostanza prende parte alla reazione B) la velocità di razione è indipendente dalla temperatura C) il periodo di semitrasformazione è indipendente dalla concentrazione iniziale del reagente D) la velocità di reazione è indipendente dalla T e dalla P
42. La soluzione acquosa di un acido (12,0 M) contiene il 75 % in massa di acido e ha una densità di 1,57 g mL-1 .Ciò permette di individuare l’acido come:
A) HCl B) CH3COOH C) HBr D) H3PO4
soluzione
dalla densità sappiamo che 1 litro di acido contiene 1570 g di acido
la quantità di moli di 1570 g di HCl corrisponderebbe a 1570/36.5 =43,0 moli che al 75% corrispondono a 32.2 moli /l di HCl quindi non può essere HCl
1570 g di CH3COOH corrisponderebbero a 1570 / 60= 19,6 moli /l che al 75% corrispondono a 14,7 moli/l pertanto nemmeno CH3COOH è l’acido cercato
1570 g di HBr corrisponde a 1570/80,9 = 19,4 moli che al 75% corrispondono a 14,55 moli/l e quindi non può trattarsi di HBr
1570 g di H3PO4 corrispondono a 1750/97,99 = 16,0 moli che al 75% corrispondono a
12,0 Moli/l
l’acido è quindi H3PO4
Da questo punto in poi,gli esercizi della classe C sono identici a quelli della CLASSE B con lo stesso numero (dal n. 41 al n.60) visti poco sopra in questo stesso lavoro, pertanto ad essi si rimandano.
Per migliore conoscenza degli studenti diamo quì le tracce
43. Dalla reazione tra 2-butanone e bromuro di fenilmagnesio si ottiene la molecola A che, per trattamento con acqua, si trasforma nel prodotto X. Indicare il composto X:
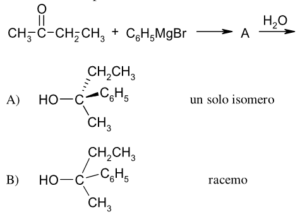
44. Il rame reagisce con HNO3 secondo la reazione: Cu + HNO3 ® Cu(NO3)2 + NO + NO2 + H2O nella quale NO ed NO2 sono formati in rapporto 2 : 3. Indicare il coefficiente di Cu quando l’equazione è bilanciata con i più semplici numeri interi: A) 2 B) 3 C) 6 D) 9
45. Indicare il composto che può essere usato sia come reagente che come indicatore in una reazione redox: A) Fe(NH4)SO4 B) KMnO4 C) H2C2O4 D) Na2S2O3
46. Indicare la coppia di composti che comprende un etere e un estere
47. Indicare l’affermazione ERRATA a proposito dell’acqua ossigenata (perossido di idrogeno): A) l’H2O2 pura è più densa dell’acqua, bolle a 150 °C e si ottiene per distillazione sotto vuoto, a 25 °C, di soluzioni acquose diluite B) in fase liquida i suoi atomi di ossigeno si scambiano con quello dell’acqua C) è circa un milione di volte più basica dell’acqua D) è un agente ossidante relativamente forte, sia in soluzione basica che acida. Si comporta come riducente solo con MnO4 – , Cl2 e Ce4+ e pochi altri ossidanti
48. Indicare il volume occupato da un campione di cloro gassoso (13,7 g a 45 °C e 99298,5 Pa) :
A) 5,14 L B) 3,21 L C) 7,03 L D) 2,45 L 49. Indicare il sale che conferisce un pH acido ad una soluzione acquosa: A) nitrato di potassio B) nitrato di ammonio C) bicarbonato di sodio D) cianuro di potassio
50. Una stanza ha dimensioni 3,05 m x 3,05 m x 2,43 m e si trova alla temperatura di 25,0 °C. Al suo interno, la pressione totale è di 101,325 kPa, mentre la pressione parziale dell’argon è di 1,01325 kPa. Indicare la quantità chimica di argon presente nella stanza: A) 4,79 mol B) 3,87 mol C) 9,27 mol D) 6,37 mol
51. Indicare tra le seguenti molecole: AsH3, OF2, AlCl4 – , I3 – , quelle con geometria lineare: A) OF2, I3 – B) I3 – C) AsH3, I3 – D) OF2
52. I chimici possono aumentare la velocità delle reazioni, che avvengono in fase omogenea liquida, scaldando la miscela di reazione. Ciò si spiega perché: A) molte reazioni sono endotermiche B) così diminuisce l’energia di attivazione C) così aumenta la tensione di vapore del liquido D) così aumenta l’energia cinetica media dei reagenti
53. Una bottiglia contiene H2SO4 (1 L al 96,4 % in massa) avente densità d = 1,835 g mL-1 . Indicare il volume che contiene 1 mol di acido puro: A) 55,4 mL B) 48,0 mL C) 32,0 mL D) 12,0 mL
54. Indicare il numero di ossidazione dello zolfo nella pirite (FeS2): A) -2 B) -1 C) +1 D) +2 55. La combinazione dei due atomi di un alogeno X, per formare la molecola X2 in fase gassosa, segue una cinetica del secondo ordine ed ha un’alta costante cinetica di reazione: k = 7,0 ·109 M -1 s -1 a 23 °C. Se la concentrazione iniziale di X è 8,06 ·10-2 M, individuare la sua concentrazione dopo 120 s dall’inizio della reazione. Inoltre individuare il tempo di semi-trasformazione di X, quando la sua concentrazione iniziale è 6,0 ·10-1 M: A) [X] = 1,2 ·10-12 M; 1,0 ·10-2 s B) [X] = 2,0 ·10-10 M; 3,00 s C) [X] = 1,2 ·10-11 M; 5,4 ·10-2 s D) [X] = 1,2 ·10-12 M; 2,4 ·10-10 s
56. Sapendo che in una soluzione satura di H2S a 25 °C, [H2S] è 1,00 ·10-1 mol L-1 , indicare la concentrazione di FeS in tale soluzione se il pH è tamponato a 2,00. Assumi K1 (H2S) = 9,00 ·10-8 e K dissoluzione di FeS = 5,00 ·10-19 alla stessa T; K è riferita alla reazione: FeS + H2O ⇄ Fe2+ + OH- + HSA) 2,32 ·10-5 M B) 4,12 ·10-2 M C) 1,04 ·10-8 M D) 6,00 ·10-1 M
57. Indicare la geometria di ClF3: A) altalena B) forma a T C) trigonale planare D) trigonale piramidale
58. Il principio attivo della candeggina è l’ipoclorito di sodio: NaClO che può essere determinato mediante analisi iodometrica con le reazioni: ClO- + 2 I- + H+ ® I2 + Cl- + H2O I2 + 2 S2O3 2– ® S4O6 2– + 2 I– Se 1,356 g di candeggina richiedono 19,50 mL di una soluzione 0,100 M di Na2S2O3, indicare la percentuale in massa dell’ipoclorito NaOCl nella candeggina: A) 2,68 % B) 3,70 % C) 5,35 % D) 10,7 %
59. Indicare il numero di elettroni necessari per bilanciare la semireazione di ossidazione dell’etanolo ad acido acetico: A) 1 B) 2 C) 3 D) 4
60. Per una cella voltaica basata sulla seguente reazione: 2 Ag+ (aq) + Cu (s) ⇄ Cu2+ (aq) + 2 Ag la concentrazione degli ioni e la grandezza degli elettrodi possono essere variati in modo indipendente. Si indichi l’affermazione che valuta correttamente ciò che succede: A) il raddoppio di [Cu2+] ha lo stesso effetto sul voltaggio della cella dell’aumento di 4 volte di [Ag+ ] B) la diminuzione di 10 volte di [Cu2+] ha lo stesso effetto sul voltaggio della cella della diminuzione di 10 volte di [Ag+ ] C) la diminuzione di 10 volte di [Cu2+] ha minore effetto sul voltaggio della cella della diminuzione di 10 volte di [Ag+ ] D) il raddoppio delle dimensioni del catodo ha esattamente lo stesso effetto sul voltaggio della cella del dimezzamento di [Cu2+]
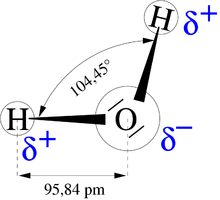




![{\displaystyle {\frac {d\left[A\right]}{\left[A\right]}}=-kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ad717b48d29c475014081be49e9bff97020cf393)
![{\displaystyle {\frac {d\left[A\right]}{dt}}=-k\left[A\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d99a1a854d8fafe83bd0a7d184c46c974480f72e) integrando fra t=0 e t avremo:
integrando fra t=0 e t avremo:![{\displaystyle \int _{\left[A\right]_{0}}^{\left[A\right]}{\frac {d\left[A\right]}{\left[A\right]}}=-k\int _{0}^{t}dt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18a7abc57fc770db6bf467aaf58c793c3ddf9b12)
![{\displaystyle \left[A\right]=\left[A\right]_{0}e^{-kt}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6a505680e73f178880ded3e4e783053cad71140f)




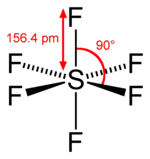


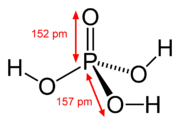


![{\displaystyle {[\alpha ]_{D}}^{20}={\frac {\alpha }{l\cdot c}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d9831966cedf4095efdeb3d9538a8f44b1c1b6bf)
![{\displaystyle \operatorname {[} \alpha ]^{t}=[\alpha ]^{20}+n(t-20)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98b4c23c97430cb2db7919b225896022df2c661f)





Lascia un commento