Giochi della chimica-Fase Regionale-Veneto-classe C
1. La distillazione coinvolge:
A) filtrazione ed evaporazione
B) evaporazione e condensazione
C) condensazione e decantazione
D) decantazione e filtrazione
E) evaporazione e precipitazione
soluzione
La distillazione viene utilizzata per separare due o più composti volatili con differenti punti di ebollizione. Un apparato di distillazione di laboratorio è indicato in figura
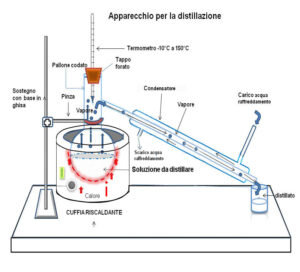
per separare due composti A e B in cui A possiede un punto di ebollizione più basso, è chiaro che per riscaldamento, questo evapora per primo. I suoi vapori vengono raffreddati e condensati e pertanto A viene separato da B che evapora successivamente.
Le fasi della distillazione sono quindi evaporazione e condensazione.
risposta corretta B
2. Un solido ha una solubilità dell’80% in acqua a 100 °C, del 20% in acqua a 20°C. Se 90 g di una soluzione satura di tale sostanza vengono raffreddati da 100 a 20 °C, quale massa di soluto si separa?
A) 65 g
B) 35 g
C) 85 g
D) 54 g
E) 70 g
soluzione
Indicando con S la solubilità (g soluto/100 g solvente) alla temperatura alla quale si effettua la cristallizzazione, Msr la massa di soluto residuo ancora in soluzione (cioè non presente nel solido cristallizzato) e con Msolv la massa di solvente residua dopo la cristallizzazione si può scrivere:
Msr= S x Msolv/ 100
sostituendo nell’equazione di bilancio di massa del soluto: Ms= C + Msr
Ms= C + SxMsolv/100 C= Ms – S Msolv/100 C= 100Ms – S x Msolv/100
cioè (Solubilità a T1 – solubilità a T2 ) x massa soluto/100 = Quantità precipitata
valida per cristallizzazione effettuata mediante raffreddamento,
C= 100Ms – SxMf / 100 se si effettua una evaporazione di solvente
dove Mf è la massa di solvente finale espressa da: Mf = Msolv iniziale – Msolvente evaporata
Tali equazioni consentono il calcolo di C, cioè della quantità di soluto cristallizzato prodotto.
il rendimento (resa) di cristallizzazione η espresso come %: è η =(C/ Ms) x 100
nel caso del nostro quesito si ha quindi
C = ( 80 -20 ) x 0,9 = 54 g
risposta corretta D
3. Un minerale contenente solo gli elementi X, Y e Z è composto per il 50 % da X e per il 33,3 % da Z. Cinque allievi hanno analizzato il materiale ottenendo i risultati riportati sotto. Quale allievo ha ottenuto risultati NON in accordo con la reale composizione del campione?
A) 6 g di minerale contiene 3 g di X e 2 g di Z
B) 9 g di minerale contiene 4,5 g di X e 3 g di Z
C) 6 g di minerale contiene 1 g di Y e 2 g di Z
D) 6 g di minerale contiene 3 g di X e 2 g di Y
E) 9 g di minerale contiene 3 g di Z e 1,5 g di Y
soluzione
se 50 % è formato da X e per il 33,3 % da Z allora Y =100- (33+50)= 17 % .
si vede che in B X= 4,5/9= 50% e per Z= 3/9 = 33,33% in accordo con la composizione reale
con lo stesso metodo vediamo che in A X=50% Z= 33,33% in accordo con la composizione reale
In C Y=1/6= 17% Z =2/6= 33% in accordo con la composizione reale
in E X= 3/9=50% Y= 1,5/9= 17% in accordo con la composizione reale
invece in D X = 3/6=50% Y= 2/6=33,33% Y dovrebbe essere 17% quindi questo risultato NON è in accordo con la composizione reale
come si vede D non è in accordo con i dati di composizione del campione
4. L’analisi chimica mostra che un idrocarburo contiene 81,80 % di carbonio e 18,20 % di idrogeno. A tale idrocarburo si può attribuire la formula:
A) C2H6
B) C3H8
C) C2H4
D) C3H6
E) C4H8
soluzione
Dividiamo per il peso atomico ed otteniamo:
C= 81,80/12= 6,82 e H = 18,2/1,008 = 18
dividendo per il numero più piccolo si ha il rapporto C:H 1 : 2,64
dobbiamo però trovare il rapporto tra numeri interi e per ottenerli dobbiamo moltiplicare per 3
otteniamo il rapporto 1 : 7,9 cioè 1:8
pertanto la formula del composto deve essere C3 H8
risposta corretta B
5. 135 g di alluminio si possono combinare con:
A) 178 g di cloro
B) 240 g di ossigeno
C) 120 g di zolfo
D) 5 g di idrogeno
E) 1200 g di bromo
soluzione
l’alluminio si comporta da trivalente quindi
se 1 di Al reagisce co 3 Cl allora 135 g reagiranno co X di Cl
si avra’ la proporzione scritta in A, Ovviamente lo stesso ragionamento si può fare per la reazione con l’Ossigeno con lo zolfo, con l’idrogeno e col bromo e quindi si avranno le restanti proporzioni B,C,D
A) Al: 3Cl = 135 : X
B) 2Al: 3O = 135 :X
C) 2Al:3S = 135 : X
D) Al : 3H = 135 : X
E) Al : 3Br = 135 : X
dalla relazione Al : 3Br = 135 : X 27 : 3×80 = 135 : X X= 135 x 240 / 135 = 1200
La risposta corretta è E
6. Se un elemento ha massa atomica 24 e numero di ossidazione +2, la % di ossigeno nel suo ossido è:
A) 12
B) 20
C) 40
D) 24
E) 60
soluzione
se il n.o. è 2 allora il composto è XO quindi se XO :O = 100 :X
X= 100 x 16 / 16+24= 1600/ 40 = 40
Risposta corretta C
7. Il componente principale della carta è la cellulosa. Alle macromolecole di cellulosa si può assegnare la formula (C6H10O5)n. Mettendo ad essiccare in stufa un filtro di carta del peso di 1,00 g, accadde di trovarlo, dopo qualche ora, carbonizzato. Quanto pesava ciò che restava del filtro?
A) 0.66 g
B) 0,55 g
C) 0,44 g
D) 0,22 g
E) 0,33 g
soluzione
se chiamiamo con X la quantità di C che si forma dalla combustione. Per conoscere quanto è il peso del carbone ottenuto basta fare la proporzione
se da una molecola di cellulosa C6H12O5 si ottengono 6 x 12 g di C da 1 g se ne ottengono X
164g :72g = 1g : Xg X = 0,44 g
risposta corretta C
8. Quanti grammi di un elemento monovalente di massa atomica 133 si combinano con 10 g di ossigeno?
A) 5 g
B) 266 g
C) 20 g
D) 166 g
E) 13,3 g
soluzione
essendo l’elemento monovalente, la formula dell’ossido è A2O pertanto per ogni atomo di O (cioè 16 g) reagiscono 2 x 133 g di A (2di A) quindi per 10 g di ossigeno occorrono X g di A. La proporzione da fare è 16 :2 x 133 = 10 : X X = 266 x 10/16 = 166,25 g tuttavia essendo 3 il massimo delle cifre significative il risultato viene espresso con solo 3 cifre significative cioè 166 g.
Risposta corretta D
9- 100 mL di un gas a 273 K vengono portati a 273 °C e la pressione viene raddoppiata. Il volume finale
del gas sarà:
A) 100 mL
B) 200 mL
C) 273 mL
D) 50 mL
E) 173 mL
soluzione
per un gas che si trova in due diversi stati di temperatura e pressione esiste la relazione
P1V1/T1 = P2V2/T2
se la pressione raddoppia cioè se P2=2P1 ed anche la T2 =2 T1 dalla realzione scritta sopra deve necessariamente essere
V2=2V1
pertanto essndo V1=100 ml allora V2 = 2 x 100 = 200 ml
risposta corretta B
10. Il volume di ossigeno necessario per produrre dagli elementi 100 litri di SO2 alla stessa temperatura e pressione è:
A) 32 L
B) 50 L
C) 64 L
D) 120 L
E) 100 L
soluzione
dalla reazione S+O2 –>SO2 si evince che da 1 mole di O si ottiene 1 mole di SO2 pertanto dalle rispettive equazioni di stato dei gas PV=nRT essendo P e T uguali per i due gas O ed SO2 possiamo scrivere
P1V1 =n1 RT1 quindi V1/n1 = RT1/P1 e P2V2=n2RT2 da cui V2/n2 = RT2/P2
ed essendo RT2/P2= RT1/P1 si può scrivere
V1/n1=V2/n2 e poichè da 1 mole di O si ottiene 1 mole di SO2 si ha
100 /n1 = V2/ n2 100 / 1 = V2 /1 V2 = 100 L
rispsta corretta E
11. Quale delle seguenti affermazioni a proposito dell’acido solforico concentrato è FALSA?
A) assorbe umidità dall’aria essendo un disidratante
B) può comportarsi da ossidante a caldo
C) è un acido diprotico
D) può essere usato per essiccare l’ammoniaca gassosa
E) è fortemente corrosivo
soluzione
le risposte A BC ed E sono vere mentre non può essere utilizzato per essiccare l’ammoniaca percè con NH3 forma (NH4)2SO4
risposta corretta D
12. Quale tra le seguenti sostanze non è accomunabile con le altre quattro?
A) biossido di carbonio
B) biossido di zolfo
C) biossido di silicio
D) cloruro di potassio
E) cloruro di idrogeno
soluzione
I primi tre composti sono degli Ossidi mentre l’ultimo è un acido HCl . Il cloruro di potassio è invece un sale che non può essere accomunato agli altri.
risposta corretta D