1. Quando un sale si scioglie in acqua:
A) l’acqua è la soluzione
B) l’acqua è il soluto e il sale il solvente
C) l’acqua è il solvente ed il sale il soluto
D) l’acqua è satura
E) l’acqua è una sospensione
soluzione
Le molecole di acqua (H2O) sono formate da due atomi di H e un atomo di O : gli atomi di idrogeno tendono a spingere gli elettroni che lo legano sempre più verso l’ossigeno assumendo perciò una debole carica positiva , mentre l’atomo di ossigeno tende ad attrarre gli elettroni .Questa caratteristica che possiedono gli atomi in un legame è detta elettronegatività. Quindi la molecola di acqua presenta una debole carica positiva (δ+) in corrispondenza degli atomi di idrogeno e una debole carica negativa (δ-) in corrispondenza dell’atomo di ossigeno: ne risulta un dipolo elettrico (δ+ δ-) . Ovviamente se l’acqua si avvicina ad uno ione positivo gli si avvicina dalla parte dell’ossigeno mentre se si avvicina ad uno ione negativo si avvicina dalla parte dell’idrogeno.(infatti cariche di segno opposto si attraggono)
Il cloruro di sodio (NaCl), allo stato solido , è invece formato da ioni sodio (Na+) e ioni di cloro (Cl–), in rapporto 1:1 e disposti secondo un cubo i cui vertici sono occupati da Na+ e da Cl-

quando il sale NaCl viene messo a contatto con l’H2O questa si avvicina al sodio dalla parte dell’ossigeno creando una forza attrattiva tale che a poco a poco lo tira fuori dal reticolo cubico, e man mano che lo tira fuori altre molecole di acqua lo circondano in modo tale che il sodio si trova al centro di una sfera formata da molecole di acqua:

questa attività è definita SOLVATAZIONE. In questo caso la sostanza che scioglie il sale si dice SOLVENTE mentre NaCl il sale che si scioglie è detto SOLUTO e ciò che ne risulta è una SOLUZIONE ed ogni soluzione ha la caratteristica di possedere proprietà chimiche e fisiche uguali in ogni punto .(Infatti se misuriamo la concentrazione di Na+ o Cl- in un beker sia in alto che in basso che in qualunque altro punto della soluzione troveremo sempre lo stesso valore).
Da quanto abbiamo detto si evince che la risposta corretta è C
2. L’alcool etilico e l’acqua non possono essere separati completamente per distillazione perché:
A) i loro punti di ebollizione sono troppo vicini
B) ambedue sono liquidi
C) il punto di ebollizione dell’alcool etilico è troppo alto
D) essi formano un miscuglio omogeneo
E) essi formano un miscuglio azeotropico
soluzione
sappiamo che per separare due o più composti volatili con differenti punti di ebollizione viene usata la DISTILLAZIONE e in figura è rappresentato un apparecchio distillatore di laboratorio.
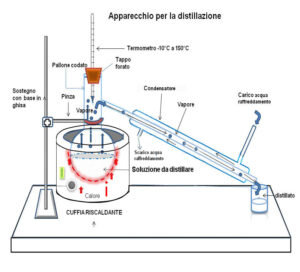
la miscela viene posta nel palloncino e riscaldata. il composto con punto di ebollizione più basso passa allo stato di vapore e viene raffreddato nel condensatore trasformandosi in liquido. Successivamente evapora il composto con punto di ebollizione più alto e viene anch’esso separato. Se poniamo in un grafico concentrazione della miscela in funzione della temperatura questo ha la seguente forma:
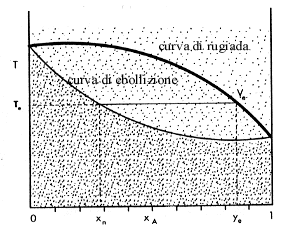
A B
in questo grafico la curva superiore rappresenta la concentrazione del vapore e quella inferiore la concentrazione del liquido. Se prendiamo una miscela dei due liquidi A e B di cui B con concentrazione Y0 (sulla destra nella curva) che è più ricco del componente B rispetto ad A e la riscaldiamo nel distillatore, il vapore avrà una concentrazione V0. Se condensiamo il vapore ottenuto, il liquido risultante sarà X0 che è più ricco del componete A indicato sulla sinistra nel grafico e si conosce la sua composizione semplicemente tracciando una retta parallela all’asse delle X. Se sottoponiamo questo liquido ottenuto a ulteriore riscaldamento (la T aumenta ) ad esso corrisponderà un valore V1 (non mostrato nel grafico) che si ottiene tracciando la parallela all’asse delle Y . Raffreddando il vapore si ottiene un liquido sempre più ricco del composto A sino a che si ottiene il composto A puro. Tuttavia per alcune miscele la curva di distillazione non risulta così semplice in quanto, ad un certo punto la miscela liquida risultante ha sempre la stessa concentrazione il che impedisce di avere un composto puro. Questa miscela con queste caratteristiche è detta Miscela Azeotropica
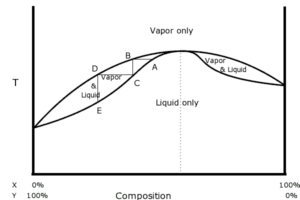
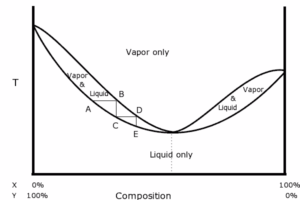
In queste curve di distillazione quella a sinistra è detta curva di un azeotropo altobollente ed il punto è dato dall’incrocio delle due curve mentre la seconda curva è quella di un azeotropo bassobollente come nel caso specifico acqua ed alcol che distilla alla composizione 95,6 di alcol e 4,4 di H2O. La temperatura di ebollizione è 74,1 per l’alcol e 100° per H2O ma la miscela azeotropica ha punto di ebollizione 73,1.(quando il p.e. è inferiore alle temperature di ebollizione dei due composti puri l’azeotropo è detto di minima, al contrario, se è più alta è detto di massima. Da quanto esposto sembrerebbe impossibile ottenere alcol puro per distillazione ma non è così perchè nella distillazione azeotropica si introduce un altro composto che influenza la volatilità di uno dei costituenti della miscela. Si ha quindi la formazione di un azeotropo ternario a partire da un azeotropo binario. Un esempio di distillazione azeotropica si ha con l’addizionamento di benzene o cicloesano a una miscela etanolo-acqua. L’azeotropo ternario risultante è composto dal 7% di acqua, 17% di etanolo e 76% di cicloesano, e bolle a 62,1 °C. In pratica viene aggiunto cicloesano in una quantità tale da imprigionare tutta l’acqua nell’azeotropo ternario. Allontanando l’azeotropo ternario per evaporazione si produce un residuo di etanolo quasi puro al 100%.
Pertanto la risposta al quesito è E
3. La percentuale di ossigeno presente nell’aria disciolta in acqua è maggiore della percentuale di
ossigeno trovata nella atmosfera. Questo sta ad indicare che:
A) l’ossigeno è meno solubile dell’azoto
B) l’ossigeno è più solubile dell’azoto
C) l’ossigeno ha la stessa solubilità dell’azoto
D) l’ossigeno è molto solubile in acqua
E) l’ossigeno è insolubile in acqua
soluzione
L'ossigeno (O2) e l'azoto (N2) sono i due gas più abbondanti nell'atmosfera terrestre e hanno proprietà
fisiche generalmente simili, tuttavia l'O2 è due volte più solubile in acqua dell'N2, una caratteristica che
ha conseguenze fisiologiche e biologiche.
La solubilità della frazione molare di O2 in numerosi solventi diversi da H2O supera sempre quella di N2,
con rapporti di solubilità O2 / N2 che vanno da 1,20 in n-dodecano a 2,31 in nitrometano. La maggiore
solubilità dell'O2 è particolarmente sconcertante poiché la polarizzabilità (non la polarizzazione!) moleco-
lare dell'N2, una caratteristica normalmente associata a una maggiore solubilità, è maggiore di quella
dell'O2.
Si potrebbe ipotizzare che N2, attraverso la sua anche se debole interazione con il suo guscio di solvatazione
acquosa, causi una maggiore distorsione della rete di legami idrogeno rispetto a O2, portando a una diffe-
renza di 2 volte nella solubilità. L'effetto principale della differenza di distorsione si manifesta nella
entalpia di solvatazione, cioè in un piccolo indebolimento dei legami idrogeno H2O-H2O, più da N2 che da
O2. Una spiegazione molto più plausibile per la differenza nelle solubilità di O2 e N2 riguarda i volumi effet-
tivi dei due gas nell'acqua e l'influenza di questi volumi sui termini di formazione della cavità della soluzione
e pertanto, si può concludere che O2 è più solubile dell'N2 in acqua (e altri solventi) perché ha un volume
minore e quindi richiede meno energia per formare una cavità nei solventi .
La risposta corretta è B
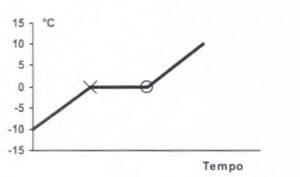
4. Un pezzo di ghiaccio è scaldato e la temperatura è registrata ad intervalli regolari. Lungo il tratto X‒O, sul grafico seguente
A) il calore ceduto è uguale al calore acquistato
B) il ghiaccio è tutto sciolto
C) il ghiaccio si sta sciogliendo ed è in equilibrio con l’acqua che così si è formata
D) non si sta fornendo abbastanza calore al ghiaccio
E) è stato arrestato il rifornimento di calore
soluzione
In un determinato range di tremperatura e pressione ogni sostanza può trovarsi in uno dei tre stati di aggregazione, solido, liquido e gassoso, considerati anche come fasi di equilibrio. Con opportune variazioni di temperatura o pressione, la materia può passare da uno stato ad un altro attraverso un processo durante il quale le molecole modificano il proprio moto e le loro mutue distanze o moto e distanza contemporaneamente.Le molecole di una sostanza che si trovano ad una certa temperatura sono in continuo movimento, indipendentemente da quale sia lo stato di aggregazione. Questi moti di agitazione termica dipendono direttamente dalla fase della sostanza infatti all’aumentare della temperatura aumenta la velocità media delle molecole e quindi la corrispondente energia cinetica e fa che la molecolesi allontanino le une dalle altre. La forza attrattiva tra molecole invece prevale per distanza grandi rispetto alle dimensioni molecolari e la forza repulsiva inizia invece a manifestarsi quando la distanza tra le molecole tende a zero. I cambiamenti di stato che avvengono fornendo energia termica alla sostanza sono: fusione, vaporizzazione e sublimazione. La fusione del ghiaccio quindi avviene fornendo energia utilizzando calore . In un primo momento il calore ceduto al ghiaccio provoca un sempre maggiore movimento delle molecole di acqua e questo provoca un aumento di temperatura ma nel momento in cui il ghiaccio inizia a fondere questo calore serve esclusivamente per scindere i legami tra le molecole e la temperatura quindi rimane costante ed in questo caso il liquido rimane in equilibrio col solido, ma quando tutto il ghiaccio diventa liquido a questo punto aumenta l’energia cinetica e quindi anche la temperatura. Infatti se poniamo in grafico la variazione di temperatura nel tempo si osserva proprio la curva

Da quanto esposto si osserva che la risposta corretta al quesito è C
5. Quale dei seguenti NON è un processo chimico?
A) la formazione di solfuro ferroso da limatura di ferro e zolfo quando si scalda il miscuglio
B) la formazione di calce viva quando si scalda il carbonato di calcio
C) la formazione di cloruro di sodio quando si mescolano soluzioni di idrossido di sodio ed acido cloridrico diluito
D) la formazione di zolfo cristallino da zolfo plastico
E) l’elettrolisi dell’acqua acidificata con acido solforico
soluzione
Un processo chimico indica una sequenza di una o più operazioni che realizzano, naturalmente o artificialmente, la trasformazione d sostanze chimiche .Un processo chimico implica una trasformazione da un tipo di molecola ad un’ altro e vediamo che le trasformazioni A,B,C, E, sono trasformazioni chimiche. La trasformazione D invece è una trasformazione fisica infatti il cambiamento da stato cristallino a zolfo plastico è solo una trasformazione dello stato fisico di una medesima sostanza e non vi è alcuna trasformazione.
La risposta corretta al quesito è D
6. Un pallone riempito di idrogeno può “galleggiare” perché:
A) l’idrogeno pesa meno dell’aria
B) l’idrogeno è più pesante dell’aria
C) la densità dell’idrogeno è minore della densità dell’aria
D) l’idrogeno è un gas
E) la pressione dell’idrogeno del pallone è minore della pressione atmosferica
soluzione
Per ogni gas il rapporto grammi / volume rappresenta la sua densità che si calcola da
d= g/V = PV /RT
da questa si evince che essendo l’aria una miscela di gas ed essendo l’idrogeno meno pesante di questa la densità tra i due gas è molto diversa e ne consegue che l’idrogeno è meno denso dell’aria per cui un palloncino pieno di idrogeno risulta più leggero dell’aria e quindi si muove verso l’alto.
La risposta corretta è C
7. L’affermazione che “volumi uguali di gas alla stessa temperatura e pressione contengono lo stesso numero di molecole” è conosciuta come:
A) legge di Dalton
B) legge di Gay-Lussac
C) ipotesi di Avogadro
D) la legge delle proporzioni definite
E) la legge degli equivalenti
soluzione
E’ nota come Legge di Avogadro. Infatti una mole di un qualunque gas nelle stesse condizioni di temperatura e pressione contiene sempre un numero di molecole pari alla costante di Avogadro cioè
6,02214129 x 1023 molecole.
risposta corretta C
8. Quando l’acqua è elettrolizzata, l’ossigeno e l’idrogeno si formano nel rapporto:
A) 1 vol. idrogeno : 1 vol. ossigeno
B) 3 vol. idrogeno : 2 vol. ossigeno
C) 2 vol. idrogeno : 3 vol. ossigeno
D) 1 vol. idrogeno : 2 vol. ossigeno
E) 2 vol. idrogeno : 1 vol. ossigeno
soluzione
l termine “elettrolisi” è un termine di origine greca e significa “scissione mediante l’elettricità“, infatti sottoporre ad elettrolisi una sostanza significa scomporla negli elementi che la compongono. La figura mostra come si scinde l’acqua nei suoi componenti H2 ed O2

i cationi (ioni positivi) si muovono verso il polo negativo (catodo) e gli ioni negativi (anioni) si muovono verso il polo positivo (anodo)
L’elettrolisi dell’acqua è un processo elettrolitico nel quale il passaggio di corrente elettrica causa la scomposizione dell’acqua in ossigeno ed idrogeno gassoso.
La corrente elettrica dissocia la molecola d’acqua negli ioni H+ e OH-.
Al catodo gli ioni idrogeno (H+) acquistano elettroni in una reazione di riduzione che porta alla formazione di idrogeno gassoso
All’anodo gli ioni idrossido (OH–) subiscono ossidazione, cedendo elettroni:
Si formerà quindi un volume di idrogeno quasi doppio del volume di ossigeno, pertanto la risposta corretta è E
9. Un atomo è:
A) la più piccola particella indivisibile di un elemento che può prendere parte ad una reazione chimica
B) la più piccola particella della materia conosciuta
C) la più piccola particella di un gas
D) una emissione radioattiva
E) nessuna di queste definizioni
soluzione
Sappiamo che ogni singola specie chimica o elemento, è rappresentata da un insieme di particelle dette atomi della specie chimica in esame.
Le particelle atomiche possono essere classificate in due grandi categorie: ADRONI e LEPTONI
ADRONI SONO:il protone,il neutrone
LEPTONI SONO :elettrone,positrone,neutrino
GLI ADRONI sono a loro volta costituiti da particelle piu’ piccole dette QUARKS
I LEPTONI sono invece considerati “puntiformi”
La risposta corretta è A
10. 2.25 g di un elemento trivalente, X, si combinano con 2 g di ossigeno. La massa atomica relativa di
X è:
A) 4,5
B) 9,0
C) 18,0
D) 27,0
E) 54,0
soluzione
essendo X trivalente il composto che si ottiene deve essere X2O3
vi sono quindi per ogni molecola di X2O3 2 atomi di X cioè 2 x PA di X e 3 x 16 di O
i g atomi di X sono mertanto 2,25 / 2PAx e 2/ 3 x 16PAo quindi possiamo scrivere che :
2.25 /2PA= 2/3 x 16 2PA = 48 x 2,25 /2 2PA = 108/2 = 54 PA= 54/2= 27,0
risposta corretta D
11. Il valore di y nell’equazione
y K + 2 H 2O → 2 KOH + H2 vale:
A) 1
B) 2
C) 3
D) 4
E) 5
soluzione
Le quantità di atomi che reagiscono devono essere uguali alla quantità di atomi ottenuti nella reazione., e quindi perchè la reazione sia bilanciata è necessario che la reazione sia :
2K + 2 H 2O → 2 KOH + H2
risposta corretta B
12. La massa di sodio in 11,7 g di NaCl è:
A) 2,3 g
B) 3,55 g
C) 4,6 g
D) 6,9 g
E) 7,1 g
soluzione
se in NaCl vi è un atomo di Na in 11,7 g ve ne sono X e passando ai grammi :
58,44 : 22,99 = 11,7 : X X = 11,7 x 22,99 / 58,44= 4,6 g di Na
risposta corretta C
13. La formula empirica di un composto è:
A) la sua giusta formula
B) la formula più semplice che mostra il numero di atomi di una molecola di un composto
C) la formula più semplice che mostra il rapporto degli atomi dei differenti elementi nel composto
D) la formula semplice che mostra il peso molecolare del composto
E) la formula molecolare
soluzione
Sappiamo che conoscendo le percentuali degli elementi in un composto e dividendo per i rispettivi pesi atomici si ottengono dei numeri e dividendo ognuno di essi per il numero più piccolo trovato si hanno i rapporti minimi tra gli atomi nel composto considerato.
Per esempio dopo aver effettuato il procedimento sopra indicato per un composto che contiene C.H.O si trova il rapporto tra atomi che ad es è C1H2O1 o CH2O . Questa è la cosiddetta formula empirica che indica esclusivamente i rapporti tra gli atomi che nell’esempio sono 1:2:1 . La formula reale della molecola la si può ottenere solo conoscendo il peso molecolare. Nell’esempio dato la formula potrebbe corrispondere sia a HCHO cioè l’aldeide formica sia a C6H12O6 glucosio .Solo se conosciamo il PM possiamo dire con certezza di quale dei due composti si tratti.
Pertanto la risposta corretta è C
14. La % in volume di ossigeno nell’aria è:
A) 5%
B) 21%
C) 25%
D) 33%
E) 75%
soluzione
L’aria secca è composta da circa il 78 % di azoto, il 21 % di ossigeno e l’1 % di argon.Nell’aria è anche presente vapore acqueo, che costituisce una percentuale compresa tra lo 0,1 % e il 4 % della troposfera.
Risposta corretta A
15. Per ottenere sale secco libero da sabbia, da un miscuglio di sale e sabbia, sono necessari i seguenti
processi:
1. filtrare
2. aggiungere acqua al miscuglio ed agitare
3. evaporare il filtrato a secco in un essiccatore
4. scaldare il miscuglio con acqua finché il sale si scioglie
5. rimuovere il sale dall’essiccatore
L’ordine in cui questi processi vanno eseguiti è:
A) 5, 2, 1, 4, 3
B) 5, 2, 4, 1, 3
C) 4, 1, 5, 2, 3
D) 2, 4, 1, 3, 5
E) 1, 2, 3, 4, 5
soluzione
sappiamo che solo il sale si scioglie in acqua quindi occorre:
1 – trattare con acqua ed agitare (si solubilizza solo il sale)
2 riscaldare per aumentare la solubilità del sale in modo che si sciolga completamente
3 filtrare per separare il liquido contenmente il sale sciolto e la sabbia che rimane sul filtro
4 evaporare il filtrato in essiccatore eliminando l’acqua
5 prelevare idall’essiccatore l sale che abbiamo separato
ne conseque che la sequenza di operazioni è la D 2,4,1,3,5
16. Quale dei seguenti NON è un processo fisico?
A) la condensazione di un vapore
B) la formazione di zolfo plastico da zolfo cristallino
C) la combustione del carbonio
D) la cristallizzazione del nitrato di potassio da una soluzione satura
E) la distillazione frazionata di etanolo ed acqua
soluzione
sappiamo che un processo chimico è un processo in cui si ha una trasformazione di una sostanza in un’altra e tra le trasformazioni indicate solo la combustione del Carbonio rappresenta un fenomeno chimico infatti il C si trasforma in CO2 mentre tutte le altre sono trasformazioni fisiche infatti la natura delle sostanze indicate non cambia.
risposta corretta C
17. L’acqua a 100 °C che passa a vapore a 100°C è una trasformazione fisica perché:
A) è stato assorbito calore
B) non si ha cambiamento di temperatura
C) la trasformazione è reversibile
D) la trasformazione è irreversibile
E) non si forma una nuova sostanza
soluzione
Abbiamo visto nell’esercizio precedente che in una trasformazione chimica si formano nuove sostanze mentre nelle trasformazioni fisiche la natura della sostanza è sempre uguale.
risposta corretta E
18. L’aria è considerata un miscuglio perché:
A) la sua pressione può variare
B) la sua temperatura può variare
C) il suo volume cambia in condizioni differenti
D) la sua composizione può variare
E) ci sono più di due elementi presenti
soluzione
Un miscuglio è una miscela di più sostanze ed ovviamente la composizione piò variare . Infatti la quantità di ossigeno nell’aria varia in funzione dell’altezza. La composizione dell’aria nella troposfera varia continuamente. Alcune delle sostanze presenti nell’aria sono altamente reattive; in altre parole hanno una maggiore propensione ad interagire con altre sostanze per formarne di nuove.
risposta corretta D
19. Quali delle seguenti voci sono composti?
1. diossido di zolfo
2. grafite
3. piombo
4. acido solforico
5. gesso
A) 1, 4 e 5
B) 1 e 4
C) 2, 3 e 5
D) 2 e 3
E) tutti
soluzione
Il Piombo è un elemento cosè come la grafite che è uno stato del Carbonio. SO2 biossido di zolfo, H2SO4 acido solforico e gesso CaSO4 sono dei composti.
risposta corretta A
20. Un volume di idrogeno si combina con un volume di cloro per formare 2 volumi di acido cloridrico, misurando tutti i volumi alla stessatemperatura e pressione. Da questo si può dedurre che se la formula dell’idrogeno è Hy, allora il minimo valore di y è:
A) 1
B) 2
C) 3
D) 4
E) 0
soluzione
il valore deve essere 2 perchè se 1 volume di H + 1 volume di Cl produce 2 volumi deve necessariamente
essere H2 + Cl2 —> 2 HCl
risposta corretta B
21. Il rame forma due ossidi nei quali il rapporto della massa di ossigeno combinata con una data massa di rame è 2:1. Questo illustra:
A) la legge della composizione costante
B) la legge della conservazione della massa
C) la legge delle proporzioni definite
D) la legge delle proporzioni multiple
E) la legge di Gay-Lussac
soluzione
“quando due elementi si combinano in modi diversi per formare diversi composti, mantenendo sempre uguale la quantità di uno dei due elementi, la quantità dell’altro elemento necessaria a reagire per formare un diverso composto risulterà essere un multiplo o sottomultiplo di se stessa, in rapporti esprimibili con numeri piccoli ed interi”. Questa legge è la legge di Dalton delle proporzioni multiple che si osserva nel caso in esame in cui il rame forma i due ossidi Cu2O e CO .
Risposta corretta D
22. Le masse atomiche relative di alcuni elementi non sono numeri interi perché:
A) non possono essere determinate molto accuratamente
B) gli atomi ionizzano durante la determinazione
C) esistono degli isotopi
D) esistono impurità
E) le moderne tecniche non permettono misure molto accurate
soluzione
sappiamo che la massa atomica di un elemento non è altro che il valore medio delle masse di tutti gli isotopi di quell’elemento, che sono presenti in natura in varie percentuali, e ciò comporta che il valore non sia esattamente intero. Infatti
Mat = Massa isotopo1 x % in natura + Massa isotopo2 x % in natura +—+Massa isotopo i / 100
per esempio in natura vi sono gli isotopi
O16 presente al 99% O17 presente allo 0,038% O18 presente alo 0,1 %
la massa atomica dell’Ossigeno (che è riposrtata nelle tavole) è:
Massa atomica O = 16 x 99,762 + 17 x 0,038 + 18 x 0,1 / 100 =1596.19 + 0,646 + 1,8 / 100 =15,9864 u
che nei calcoli viene arrotondato a 16 u
L’unità di massa atomica u è uguale a 1/12 della massa dell’atomo di . 12C.
Pertanto la risposta corretta è C
23. N2 + 3H2 –> 2NH3 se tutti i volumi sono misurati alla stessa temperatura e pressione, il volume di ammoniaca formato quando 500 dm3 di azoto si combinano con l’idrogeno è:
A) 1500 dm3
B) 250 dm3
C) 1000 dm3
D) 2500 dm3
E) 5000 dm3
soluzione
dall’equazione scritta sopra, si osserva che da 1 volume di N2 si ottengono 2 volumi di NH3 pertanto da 500 dm3 si devono ottenere 1000 dm3 infatti
1 : 2 = 500 : X X = 500 x 2 /1 = 500
risposta corretta C
24. La massa di 11,2 dm3 di ammoniaca alle STP è:
A) 8,5 g
B) 4,25 g
C) 0,425 g
D) 0,85 g
E) 17,6 g
soluzione
STP sta per Standard Temperature and Pressure cioè condizioni normali (273° C e 1 atm). Sappiamo anche che 1 mole di qualunque sostanza a c.n. occupa un volume di 22,414 litri quindi 11,2 litri di costituiscono 1/2 di mole e poichè 1 mole di NH3 pesa 17 g 1/2 mole è costituita da 8,5 g
risposta corretta A
25. Un composto consiste di 47,8 % in peso di zinco e 52,2 % in peso di cloro. La sua formula empirica è ZnxCly dove x e y possono avere il valore di: x y
A) 1 1
B) 1 2
C) 2 1
D) 2 3
E) 1 3
soluzione
dividiamo la % per il peso atomico dello Zn e la % per il peso atomico del Cl
47,8 / 65,4 = 0,73 %52,2 / 35,45 = 1,48
dividendo per il numero più piccolo si ha Zn1 Cl2 la formula del composto è pertanto ZnCl2
risposta corretta B
26. La formula dell’acqua è H2O perché:
A) l’idrogeno è diatomico e l’ossigeno monoatomico
B) due volumi di idrogeno combinano con un volume di ossigeno
C) la valenza dell’idrogeno è 1 e la valenza dell’ossigeno è 2
D) la massa molecolare relativa dell’idrogeno è 2 e quella dell’ossigeno è 1
E) due molecole di idrogeno si combinano con una molecola di ossigeno
soluzione
Per rispondere al quesito, ricordiamo la struttura atomica sia dell’idrogeno che dell’ossigeno
O 1S2 2S2 2Px1 2Py1
H 1S1
come si può osservare, se mettiamo a reagire ossigeno ed idrogeno 1 solo atomo di H NON può completare l’accoppiamento dei due elettroni Px e Py dell’ossigeno perchè ne rimarrebbe uno non accoppiato, quindi per completare l’accoppiamento dei due elettroni liberi dell’ossigeno è necessario un altro atomo di H
O 1S2 2S2 2Px1 2Py1
H 1S1 1S1 H
questo comporta che la formula dell’acqua deve necessariamente essere H2O .
Poichè il numero di elettroni spaiati veniva indicato col termine valenza è chiaro che la valenza dell’ossigeno è 2 mentre quella dell’idrogeno è 1
Risposta corretta C
27. La più probabile disposizione degli elettroni negli atomi di un elemento di numero atomico 11 è:
A) 8, 2, 1
B) 2, 8, 1
C) 2, 6, 3
E) 5, 6
F) 2, 3, 6
soluzione
Usando il principio aufbau la struttura atomica dell’atomo con n.a. 11 (il sodio Na) è la seguente:
1S2 2S2 2Px2 2Py2 2Pz2 2S1
cioè 2,8,1
Risposta corretta B
28. Quale delle seguenti coppie è costituita da isotopi:
A) ossigeno ed ozono
B) ghiaccio e vapore
C) ossido di azoto e diossido di azoto
D) idrogeno e deuterio
E) etanolo e metanolo
soluzione
dalle coppie indicate si evince che solo idrogeno e deuterio (idrogeno pesante cioè un atomo di idrogeno con un neutrone ) sono una coppia di isotopi e si indicano rispettivamente con H e D .
(ricordiamo che esiste un yterzo isotopo dell’idrogeno con 2 protoni che è chiamato tritio)
risposta corretta D
29. In un nuovo mondo si scoprono una serie di nuovi elementi dei quali si determinano le energie
di ionizzazione. Eccone i valori:
Energia diI ioniz.kcal/mole Energia di II ioniz kcal/mole Energia di III ioniz kcal/mole
M 127 260 1500
N 500 750 1000
O 150 250 1200
P 125 2000 2800
Q 138 460 640
Quali di questi elementi apparterebbero a uno stesso gruppo della Tavola Periodica?
A) fanno parte dello stesso gruppo M ed N
B) fanno parte dello stesso gruppo M ed O
C) fanno parte dello stesso gruppo N ed O
D) fanno parte dello stesso gruppo O e P
E) fanno parte dello stesso gruppo P e Q
soluzione
L’energia di ionizzazione di un atomo o di una molecola è l’energia minima richiesta per allontanare un elettrone e portarlo a distanza infinita, allo zero assoluto, e in condizioni di energia cinetica nulla. Quindi l’E.I. è l’energia necessaria per far avvenire il seguente processo: X → X⁺ + e⁻ + I₁
L’energia di ionizzazione viene spesso indicata con EI1 o più spesso semplicemente I1; dove il pedice 1 sta ad indicare che si tratta dell’energia di prima ionizzazione cioè relativa all’allontanamento del primo elettrone.
In maniera analoga si definiscono le successive:
-
- X+(g) → X2+(g) + e− I2
-
- X2+(g) → X3+(g) + e− I3
L’energia di prima ionizzazione è una proprietà periodica . Muovendosi lungo un periodo della tavola periodica da sinistra verso destra I1 aumenta, mentre scendendo in uno stesso gruppo diminuisce. Vi è molta regolarità in questo andamento nei blocchi principali.
da quanto detto, i valori delle energie di prima ionizzazione indicano che se consideriamo l’atomo N 500 Kcal/mole scendendo nel gruppo di M potrebbero esservi Q oppure M, O e P ma se guardiamo le energie di II e III ionizzazione notiamo che le similitudini esistono solo tra O ed M, infatti
O 150 250 1200
M 127 260 1500
possiamo dedurre che M ed O appartengono allo stesso gruppo e O appartiene ad un poeriodo più piccolo di quello di M
la risposta corretta al quesito è B
30. Considera le seguenti proprietà di un elemento:
1. reagisce con l’idrogeno nel rapporto 1:1
2. si presenta solido a temperatura ambiente
3. reagisce con l’acqua liberando idrogeno
4. fra gli elementi del proprio gruppo possiede la massima energia di ionizzazione e il minimo volume atomico
L’elemento descritto si identifica con:
A) Br
B) Li
C) Mg
D) P
E) S
soluzione
se l’elemento reagisce con H in rapporto 1:1 possiamo escludere P, S ed Mg . Rimangono Li e Br
Essendo inoltre l’elemento solido a temperatura ambiente si può escludere anche il Br perchè a temperatura ambiente. è un iquido (di colore rosso bruno). Inoltre l’energia di ionizzazione del litio è maggiore rispetto agli altri elementi del gruppo.
Rispposta corretta B
31. Un doppio legame tra due atomi di carbonio è formato da:
A) trasferimento di due elettroni da un atomo di carbonio ad un altro
B) trasferimento di un elettrone da un atomo di carbonio ad un altro
C) due coppie di elettroni messi in comune
D) due elettroni messi in comune
E) tre elettroni messi in comune
soluzione
Un doppio legame si forma quando due atomi mettono in comune 2 coppie di elettroni. Se consideriamo ad esempio due atomi di carbonio nel composto “etilene ” ognuno degli atomi utilizza orbitali cosiddetti ibridi perchè formati dal mescolamento di un orbitale s e 2 orbitali P cioè Py e Px (orbitali ibridi SP2) lasciando inalterato il terzo orbitale Pz puro. Gli orbitali ibridi giaggiono sullo stesso piano ad un angolo di 120° tra loro mentre l’orbitale Pz puro è perpendicolare ai primi due . Le figure mostrano rispettivamente la struttura di un atomo di C, l’orientamento nello spazio degli ibridi sP2 ed infine la molecola di etilene H2C=CH2


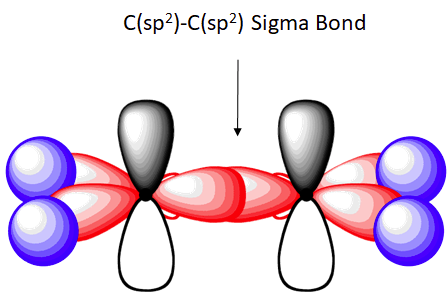
il legame formato tra due ibridi sP2 diretti verso i nuclei degli atomi di C è detto orbitale sigma σ ed è un legame molto forte, mentre quello che si forma per la sovrapposizione dei due orbitali Pz è debole in quanto la sovrapposizione è parziale ed il legame si chiama legame pi greco π.
risposta corretta C
32. I composti ionici sono di solito:
A) solidi con bassi punti di fusione
B) solidi con alti punti di fusione
C) gas
D) liquidi volatili
E) composti organici
soluzione
I composti ionici sono formati da ioni in cui il legame è di tipo elettrostatico e sono disposti secondo reticoli cristallini. Nei nodi del reticolo cristallino dei solidi ionici si alternano, con regolarità, ioni positivi e negativi. Possiedono le seguenti caratteristiche : a)Temperatura di fusione relativamente alta b)Fragilità alla trazione c)Sfaldamento diagonale rispetto ai piani reticolari d)Allo stato fuso conducono la corrente elettrica e) Solubili in acqua f)In soluzione acquosa conducono la corrente.
La risposta corretta è B
33. Quale combinazione delle seguenti affermazioni indica che il legame in HCl è covalente:
1. una soluzione acquosa di HCl forma H2 reagendo con metalli
2. l’HCl è un gas
3. l’HCl non manifesta le sue proprietà acide in assenza di acqua
4. l’HCl secco non conduce corrente elettrica
5. in acqua l’acido cloridrico diventa un acido forte
A) 1, 3, 4
B) 1, 2, 3
C) 1, 5
D) 1, 3, 5
E) 1, 2, 3, 4, 5
soluzione
L’HCl in soluzione acquosa forma con un metallo M idrogeno gassoso H2
2 HCls + Me+2 —> MeCl2 + H2
2HCl +2 Me+ —> 2MeCl + H2
se non si trova in soluzione non presenta caratteristiche acide ( non si scinde in H+ + Cl-) tanto è vero che in acqua forma un acido forte cioè si scinde completamente in H+ e Cl-.
Si deduce che la risposta corretta è A
34. Il termine più corretto per descrivere la forma della molecola dell’acqua è:
A) lineare
B) piegata a V
C) piramidale
D) tetraedrica
E) triangolare piana
soluzione
quì il quesito pone la differenza lessicale tra forma e struttura. Infatti la struttura dell’acqua è tetraedrica con l’ossigeno che utilizza ibridi SP3 di cui due soli formano legame con due atomi di H gli altri due possiedono cisascuno un doppietto elettronico libero tanto che essendo carichi negativamente si respingono provocando una diminuzione dell’altro angolo di legame che diviene da 109,8° (angolo di un tetraedro) circa 104,5 °
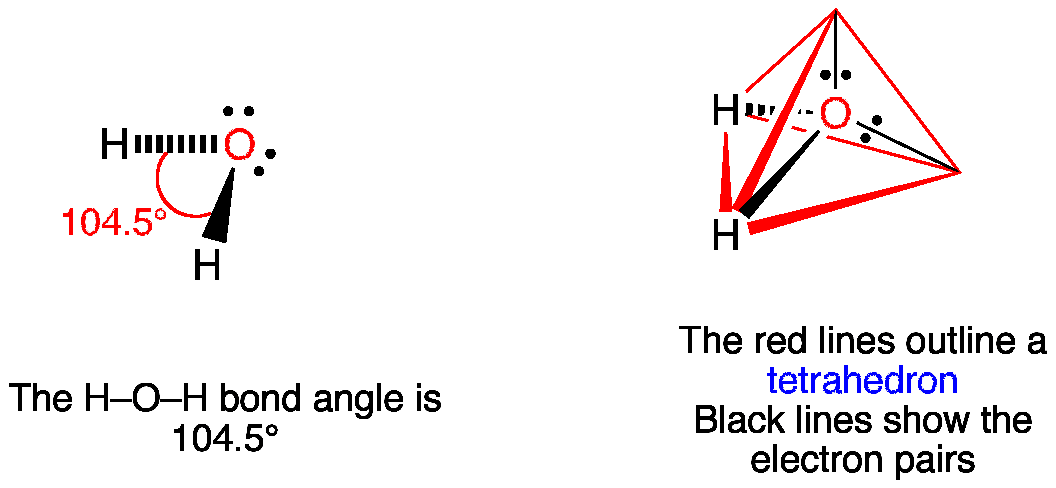
come possiamo vedere la FORMA della molecola è a V piegata, ma la sua STRUTTURA è tetraedrica.
Pertanto in questo quesito la risposta corretta è B e non D
35. Quali delle sostanze elencate in tabella possono formare solidi con legami prevalentemente ionici?
sostanza Tfus °C Teb °C
elio -269,7 -268,9
cloruro di sodio 800,4 1413
anidride carbonica Liquefa solo sotto pressione -78,5
anidride silicica 1425 2230
diamante > 3550 »4200
metano -182,5 -161,5
idrossido di potassio 380 1320
acido fluoridrico -83 19,4
acqua 0 100
A) elio, anidride carbonica e metano
B) acqua e acido fluoridrico
C) cloruro sodico e idrossido potassico
D) diamante e anidride silicica
E) nessuna delle combinazioni sopra indicate
soluzione
l’elio è un gas nobile, la CO2 ha legami covalenti come SiO2, l’acido fluoridrico non è solido, il diamante è costituito da atomi di C , ed il metano è un gas.Tra le sostanze elencate , solo il cloruro di sodio e l’idrossido di sodio possono formare solidi ionici.
risposta corretta C
36. Quali sostanze della tabella precedente formano legami idrogeno?
A) elio, anidride carbonica e metano
B) acqua e acido fluoridrico
C) cloruro sodico e idrossido potassico
D) diamante e anidride silicica
E) nessuna delle combinazioni sopra indicate
soluzione
solo H2O ed HF possono formare legami idrogeno.

il legame idrogeno è un legame direzionale ed anche HF forma legami idrogeno ma più deboli che H2O; l’atomo di fluoro è ibridizzato sp, il che significa che solo una delle coppie di elettroni liberi (quella a 180 gradi dal legame H-F) è abbastanza direzionale da essere un accettore per il legame idrogeno. Le altre due coppie rimangono non ibridate e quindi non sono sufficientemente direzionali.
risposta corretta B
37. L’elemento con numero atomico 6:
A) forma composti ionici con valenza 2
B) forma composti ionici con valenza 3
C) forma composti covalenti con valenza 2
D) forma composti covalenti con valenza 4
E) non forma composti ed ha valenza 0
soluzione
L’atomo con 6 elettroni (numero atomico 6 ) è il Carbonio la cui struttura è 1S2 2S2 2Px1 2Py1
questo atomo dovrebbe formare composti con valenza 2, tuttavia quasi sempre utilizza la struttura con valenza 4 cioè
1S2 2S1 2Px1 2Py1 2pz1
in cui si presume che un elettrone dell’orbitale 2S si dispone nell’orbitale libero Pz.
il Carbonio forma quindi composti con valenza 2 (ad es. CO ) che con valenza 4 (ad es. CO2 ed i composti organici).
Risposte corrette sono sia C che D
38. Un idrocarburo è
A) un composto contenente carbonio, idrogeno ed ossigeno
B) un bicarbonato
C) un composto che può formare ioni H+ in acqua
D) un composto contenente carbonio e idrogeno
E) un derivato della benzina
soluzione
la stessa parola indica la soluzione perchè nella molecola di un idro(contenente idrogeno) carburo(contenente carbonio) vi sono solo C ed H ad es. CH4 metano. Gli idrocarburi sono i cosiddetti alcani, alcheni ed alchini.
risposta corretta D
39. La formula del benzene è:
A) CH4
B) C6H6
C) C6H12
D) C6H5OH
E) C2H6
soluzione
il benzene è un idrocarburo ciclico insaturo con un anello di 6 atomi di C
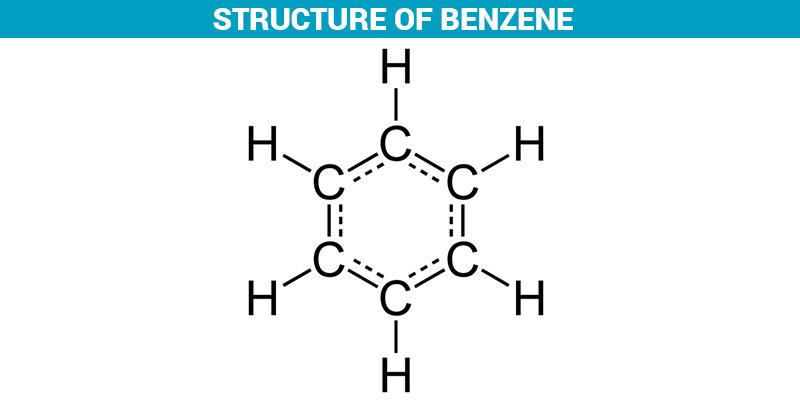
risposta corretta B
40. L’elemento idrogeno si presenta in tre forme, due naturali e una artificiale; esse sono:
A) allotropi
B) isotopi
C) isomeri
D) anidride
E) idruri
soluzione
sono isotopi e differiscono tra loro per il numero di neutroni infatti sono H idrogeno D deuterio e T tritio che hanno rispettivamente 0,1,2 neutroni.
risposta corretta B
41. Considerate le seguenti affermazioni a proposito di una miscela naturale di atomi di neon (N.A.=10, P.A.= 20,2). Quale di esse è falsa?
A) il nucleo di un atomo di neon non contiene 10 protoni
B) fuori del nucleo ci sono 10 elettroni
C) la carica presente sul nucleo del neon è +10
D) il nucleo dell’atomo (neutro) del neon non contiene 10,2 neutroni
E) devono esistere più isotopi del neon
soluzione
Ci sono 10 protoni e 10 elettroni nel neon non ionizzato. Il 90% degli atomi di neon contiene 10 neutroni. Ce ne sono alcuni con 11 neutroni e circa il 9% con 12. Quelli con neutroni extra sono chiamati isotopi, I nuclei hanno 10 protoni ma con un numero diverso di neutroni. Le risposte A,B,C,E sono corrette quindi non sono false, mentre è falsa la D perchè il neon contiene 10 neutroni. 42. La formula dell’etano è: A) C2H2 B) C6H6 C) CH4 D) C6H12 E) C2H6 soluzione l'etano è un idrocarburo saturo contenente 2 atomi di Carbonio e quindi essendo la formula generale di un idrocarburo saturo CnHn+2 la formula dell'etano è C2 H6 risposta corretta E 43. Gli alogeni formano un gruppo di elementi con proprietà simili perché: A) contengono lo stesso numero di protoni B) le loro strutture elettroniche seguono un andamento simile C) si trovano nel gruppo 17 della tavola periodica D) hanno tutti una valenza 1 E) sono tutti gas soluzione Gli alogeni (dal greco ἅλς (hàls) + γενος (ghenos), generatore di sali) o elementi del gruppo 17 della tavola periodica sono: Fluoro,Bromo,Iodio e Astato. L'astato è un elemento radioattivo molto raro. Anche l'elemento artificiale Tennesso (Ts) appartiene a questo gruppo, ma ne sono stati prodotti solo pochi atomi e le sue proprietà chimiche sono poco note.Nella nomenclatura precedente questo gruppo era denominato VIIB o VIIA a seconda di diverse convenzioni usate in Europa e negli Stati Uniti d'America. Gli alogeni hanno configurazione elettronica esterna S2P5 e tendono a formare l'ottetto esterno S2P6 e quindi ad assumere la configurazione elettronica del gas nobile che lo segue nella tavola periodica.Ciò comporta che il loro n.o. è -1 . La risposta corretta è quindi C e non D 44. Quale delle specie seguenti NON possiede lo stesso numero di elettroni dell’atomo di Xenon? A) Ba2+ B) I‒ C) Sb3‒ D) Cs+ E) I+ soluzione lo Xeno ha la seguente struttura elettronica :Kr]4d10 5s2 5p6
A) Ba2+ il Bario Ba possiede la struttura [Xe] 6S2 e perdendo 2 e diviene Ba+2 struttura [Xe] B) I‒ lo iodio I ha struttura [Kr] 4d10 5s2 5p5 e acquisendo 1 elettrone diviene [Kr] 4d10 5s2 5p6 = [Xe] C) Sb3‒ l'antimonio Sb ha la struttura [Kr] 4d105s25p35p3 e perdendo 3 e diviene [Kr] 4d105s25p6=[Xe] D) Cs+ il cesio Cs ha struttura [Xe] 6s1 e perdendo un elettrone diviene Cs+1 cioè struttura [Xe] E) I+ lo iodio I ha struttura [Kr] 4d10 5s2 5p5 e perdendo 1 e 1 diviene I+ [Kr] 4d10 5s2 5p5 da quanto esposto solo I+ non possiede la struttura dello Xeno pertant: la risposta corretta è E 45. Se le nostre estrapolazioni sono giuste, al prossimo gas nobile (non ancora scoperto) spetterebbe nella tavola periodica il numero 118. Quale delle caratteristiche seguenti NON dovrebbe possedere tale elemento? A) a temperatura ambiente l’elemento118 sarà un gas B) l’elemento 118 manifesterà fra tutti gli elementi del gruppo la più bassa energia di ionizzazione C) l’elemento 118 manifesterà fra tutti gli elementidel gruppo il punto di fusione ed il punto di ebollizione più elevati D) l’elemento 118 esisterà probabilmente in forma di molecola biatomica E) l’elemento 118 tenderà più degli altri membri del gruppo a formare composti soluzione L'elemento 118 è stato scoperto negli anni 2000 ed il primo dei nomi è stato un(1)un(1) octio(8) oggi si chiama Oganesson simbolo Og. E' un elemento radioattivo artificiale. Nel 1965 lo scienziato Aristide von Grosse scrisse un articolo ipotizzando le proprietà dell'elemento 118. Il 9 ottobre 2006 ricercatori annunciarono di aver presumibilmente ottenuto tre o quattro nuclei di oganesson-294 prima chiamato un.unoctio (118) scaturiti da una collisione tra atomi di californio-249 e ioni di calcio-48.Gli scienziati inoltre non riconoscono questo elemento come gas nobile questi sarebbe infatti in grado di formare ossidi stabili (OgO3 e simili) oltre che cloruri e fluoruri. È un elemento sintetico radioattivo ma il suo stato fisico non è noto, per alcuni probabilmente gassoso a 298 K (25 °C). Un'altra ipotesi riguarda la forma che l'oganesson assumerebbe qualora fosse presente in natura: si pensa ad uno stato solido, piuttosto che gassoso, perciò non presenterebbe le normali caratteristi- che dei gas nobili. Alla luce di quanto sopra, oggi nessuna delle risposte sembra essere corretta. 46. Quale delle equazioni illustra meglio l’espressione ”energia di ionizzazione primaria”? A) KCl(s) → K+(aq) + Cl‒(aq) + energia B) K(g) + energia → K+(g) + e‒ C) Ca+(g) + energia → Ca2+(g) + e‒ D) Na+(g) → Na+(aq) + energia E) K(g) + e‒+ energia → K‒(g) soluzione
L’energia di ionizzazione di un atomo o di una molecola è l’energia minima richiesta per allontanare un elettrone e portarlo a distanza infinita, allo zero assoluto, e in condizioni di energia cinetica nulla. Quindi l’E.I. è l’energia necessaria per far avvenire il seguente processo: X → X⁺ + e⁻ + I₁
L’energia di ionizzazione viene spesso indicata con EI1 o più spesso semplicemente I1; dove il pedice 1 sta ad indicare che si tratta dell’energia di prima ionizzazione cioè relativa all’allontanamento del primo elettrone.
La definizione B è l’energia di seconda ionizzazione , le altre non corrispondono ad energie di ionizzazione.
da questa definizione si si deduce che l’unica che corrisponde alla definizione data di EI è la B
47. Nel cloruro di ammonio il legame: A) è solo covalente B) è solo ionico C) consiste di tre legami azoto-idrogeno covalenti ed uno ionico tra la molecola di ammoniaca el’atomo di cloro D) consiste di quattro legami azoto-idrogeno covalenti ed uno ionico tra lo ione ammonio e lo ione cloruro E) consiste di tre legami azoto-idrogeno ionici ed uno covalente tra la molecola di ammoniaca e la molecola di cloruro di idrogeno soluzione la struttura di NH4Cl è:con un legame ionico NH4+ Cl- e 4 legami covalenti co l'N ibrido SP3 (tetraedrico) e 4 atomi di idrogeno. Si evince che la risposta corretta è D 48. Quale degli elementi seguenti ritenete debba combinarsi con l’ossigeno dando origine a legami dotati della maggiore ionicità: A) Li B) Be C) B D) C E) N soluzione Tra gli atomi citati,il litio Li appartiene al primo gruppo mentre gli altri appartengono al 2,3,4,5 gruppo e come sappiamo la caratteristica di ionicità diminuisce man mano che il gruppo aumenta. Ciò significa che la risposta corretta è A 49. Per rispondere tenete presente le rappresentazioni orbitaliche degli elettroni di valenza dei seguenti elementi, appartenenti alla seconda ed alla terza riga della Tavola Periodica:
Quale fra gli elementi dati può costituire, fra i propri atomi, legami a carattere covalente? A) solo 1 e 2 B) solo 1, 2 e 3 C) solo 3, 4 ed 5 D) qualche altra combinazione degli elementi dati E) nessuno tra gli elementi dati formerebbe legami covalenti soluzione Sappiamo che un legame covalente è dovuto alla sovrapposizione di elettroni e dai dati mostrati si evince che gli elettroni spaiati disponibili per il legame covalente sono solo 3,4,5. L'elemento del secondo gruppo contiene, è vero,un elettrone ma questo forma prevalentemente legami ionici. La risposta corretta è C 50. Quali fra le proprietà sotto elencate si accordano, in generale, con le caratteristiche metalliche? 1. conducibilità elettrica e termica 2. elettroni delocalizzati 3. ioni positivi in un mare di elettroni 4. capacità di riflettere la luce visibile di ogni lunghezza d’onda 5. bassa energia di ionizzazione A) 1, 3 e 5 B) 1, 3, 4 e 5 C) 1, 2, 3 e 5 D) 1 e 3 E) Tutte soluzione l'unica tra le proprietà elencate che non risponde allo stato metallico è 4, infatti i metalli non riflettono la luce visibile di tutte le lunghezze d'onda. la risposta corretta è C E) Tutte 51. Quale dei seguenti composti non è formato dall’azione del cloro sul metano? A) C2H5Cl B) CH3Cl C) CH2Cl2 D) CHCl3 E) CCl4 soluzione La clorurazione del metano è una reazione radicalica. Una reazione di sostituzione radicalica è una reazione chimica di sostituzione in cui compaiono dei radicali come intermedi di reazione. I radicali sono composti o elementi che presentano un elettrone spaiato : questo elettrone rende il radicale estremamente reattivo, in grado di reagire con altri radicali o di sottrarre un elettrone ad altre molecole vicine.La prima fase della clorurazione del metano è fornire energia fotochimica ad una molecola di cloro che provoca la scissione del legame lasciando su ogni atomo un elettrone e quindi formando due radicali cloro.La rottura del legame è omolitica che significa scissione uguale. Cl—Cl + hv ----> Cl• + •Cl Uno di questi radicali, reagisce con un atomo di idrogeno del CH4 formando un radicale libero CH3• CH4 + Cl• ----> CH3• + HCl CH3• + Cl2 ---> CH3Cl + Cl• questo radicale reagisce ulteriormente con CH3Cl CH3Cl + Cl2 +hv --> CH2Cl2 + Cl• la reazione prosegue ulteriormente CH2Cl2 + Cl2 + hv ---> CHCl3 + Cl• CHCl3 + Cl2 +hv --> CCl4 + Cl• Cl• a questo punto reagisce con altro CH4 in un ciclo di reazioni a catena sino ad esaurimento del CH4 oppure quando si ha la reazione tra due radicali o per urto dei radicali contro le pareti del recipiente. La clorurazione del metano porta quindi ad una miscela di composti CCl4 CHCl3 CH2Cl2 CH3Cl. e la loro separazione viene effettuata basandosi sui diversi punti di ebollizione. E' evidente che nel quesito proposto CH3CH2Cl è il cloruro di etile che nulla a che vedere col metano. Risposta corretta A
52. Per saggiare la presenza di anidride carbonica di solito si prova se: A) fa virare al rosso la cartina al tornasole B) ha densità maggiore dell’aria C) spegne un fuscello che brucia D) non ha odore E) fa diventare lattiginosa una soluzione limpida diacqua di calce soluzione Il modo più efficace per verificare la presenza di anidride carbonica è far passare il gas attraverso una soluzione diluita di idrossido di calcio (calce idrata). Si forma un precipitato di carbonato di calcio, che è insolubile in acqua ed è di colore bianco. La risposta corretta al quesito è E 53. Quale dei seguenti metalli, in presenza di un cido, NON porta alla formazione di idrogeno molecolare? A) alluminio B) calcio C) mercurio D) potassio E) zinco soluzione Questi elementi, tranne il mercurio, portano alla formazione di idrogeno. Il mercurio reagisce con acidi concentrati ad es. HNO3 ed H2SO4 ma non si ossida con altri acidi quindi non forma idrogeno. risposta corretta C 54. Un’ossidazione può essere definita come: A) l’addizione di elettroni ad un atomo o ione B) la sottrazione di elettroni da un atomo o ione C) la spartizione di elettroni da parte di due ioni D) il cambio di valenza di un elemento E) la sottrazione di ossigeno risposta Ossidazione di un elemento significa che l'elemento aumenta il proprio numero di ossidazione ciò significa che deve cedere elettroni ad es Fe+2--> Fe+3 +e ad un accettore. Non può esistere un'ossidazione se non è presente un accettore di elettroni che quindi riduce il proprio numero di ossidazione.Nel complesso la reazione si dice di ossidoriduzione. Risposta corretta B
55. Un acido è una sostanza che:
A) se disciolta in acqua fa diventare la cartina al tornasole blu
B) se disciolta in acqua forma ioni H+
C) ha sapore amaro
D) è corrosiva
E) contiene idrogeno
soluzione
Nella teoria di Arrhenius gli acidi sono definiti come sostanze che, sciolte in acqua, liberano ioni H+ (ioni H3O+).
Nella teoria di Brønsted–Lowry, gli acidi e le basi sono definiti in base a come reagiscono l’uno con l’altro. La definizione viene proposta sotto forma di formula:
- acido + base
 base coniugata + acido coniugato.
base coniugata + acido coniugato.
Nel caso di un generico acido HA, l’equazione può essere scritta come:
- HA + B
 A− + HB+
A− + HB+
L’acido, HA, può donare un protone e convertirsi nella corrispondente base coniugata, A−. Analogamente la base, B, accettando il protone si trasforma nel suo acido coniugato, HB+.Una sostanza si comporta come acido soltanto quando è in presenza di un’altra sostanza capace di comportarsi come base nei suoi confronti e viceversa. La definizione di Brønsted e Lowry introduce pertanto il concetto di complementarità tra acido e base, dato che una sostanza ha bisogno della presenza dell’altra per manifestare il proprio comportamento acido o basico. Più in generale oggi definiamo un acido come una qualunque sostanza in grado di accettare elettroni mentre una base è donatrice di elettroni.
Da quanto detto la risposta corretta al quesito è B
56. Quando l’acqua acidificata viene elettrolizzata, ossigeno e idrogeno si formano nel rapporto x:y in
volume, dove x e y sono:
x y
A) 2 1
B) 1 2
C) 2 3
D) 1 1
E) 3 2
soluzione
questo quesito è identico al quesito n.8 . In ogni caso ripetiamo le considerazioni fatte sopra.
l termine “elettrolisi” è un termine di origine greca e significa “scissione mediante l’elettricità“, infatti sottoporre ad elettrolisi una sostanza significa scomporla negli elementi che la compongono. La figura mostra come si scinde l’acqua nei suoi componenti H2 ed O2

i cationi (ioni positivi) si muovono verso il polo negativo (catodo) e gli ioni negativi (anioni) si muovono verso il polo positivo (anodo)
L’elettrolisi dell’acqua è un processo elettrolitico nel quale il passaggio di corrente elettrica causa la scomposizione dell’acqua in ossigeno ed idrogeno gassoso.
La corrente elettrica dissocia la molecola d’acqua negli ioni H+ e OH-.
Al catodo gli ioni idrogeno (H+) acquistano elettroni in una reazione di riduzione che porta alla formazione di idrogeno gassoso
All’anodo gli ioni idrossido (OH–) subiscono ossidazione, cedendo elettroni:
Si formerà quindi un volume di idrogeno doppio del volume di ossigeno, pertanto la risposta corretta è A
57. L’anidride solforosa e l’acqua:
A) formano acido solforoso
B) formano acido solforico
C) formano anidride solforica
D) formano acido solfidrico
E) non reagiscono
soluzione
La reazione è la seguente : SO2 + H2O —> H2SO3
l’acido che si forma è l’acido solforoso
Risposta corretta A
58. La ruggine è:
A) un ossido di ferro idrato
B) una miscela di ferro e acqua
C) una miscela di ferro e aria
D) ossido ferroso (di ferro II)
E) un composto di ferro e acqua
soluzione
Vi sono diverse forme di ruggine, alla quale corrispondono diverse reazioni e prodotti finali.La reazione principale è una redox dove l’ossigeno si riduce ed il ferro si ossida:
A causa della formazione di anioni ossidrili questo processo è largamente influenzato dalla presenza di acidi o basi . Gli elettroni per la riduzione dell’ossigeno sono forniti dal ferro:
La complessità delle varie reazioni in gioco poi si esplica con la formazione di numerose reazioni correlate, ad esempio:
Anche la presenza di SO2 e CO2 può avere un ruolo in queste reazioni, ad esempio:
La composizione della ruggine è quindi molto variabile a seconda dei materiali e delle condizioni di ossidazione (pH , ossigeno, acqua, anidride carbonica).
Se l’ossigeno è abbondante, quasi tutto il Fe(II) si ossiderà a Fe(III). Se invece è in difetto il Fe(II) in forma di FeO e dei suoi idrati sarà più abbondante (ma sempre minoritario).
La presenza (o meno) di acqua ha un effetto anche sulle seguenti reazioni di equilibrio:
Di fatto la composizione della ruggine può contenere, in ordine di importanza:
- Fe2O3 (oltre il 30-40%, anche fino al 97%)
- Fe(OH)3, FeO(OH), Fe3O4, FeO, Fe(OH)2
- Fe3+ e Fe2+ ionici e tracce di altri metalli e derivati.
risposta corretta A
59. Quale delle seguenti sostanze NON si combina direttamente con l’ossigeno?
A) oro
B) mercurio
C) carbonio
D) zolfo
E) idrogeno
soluzione
Tra gli elementi del quesito B,C,S,H reagiscono facilmente con Ossigeno (Hg2O,CO2,SO3,H2O) mentre l’oro è dififcilmente attaccato dall’ossigeno Inattaccabile dalla maggior parte dei composti chimici, reagisce in pratica solo con l’acqua regia e con lo ione cianuro.
risposta corretta A
60. Gli ossidi di non-metalli sono spesso:
A) gas che fanno diventare blu la cartina di tornasole rossa
B) gas che fanno diventare rossa la cartina di tornasole blu
C) gas che non hanno alcun effetto sulla cartina al tornasole
D) solidi che, se solubili, fanno diventare rossa la soluzione al tornasole
E) solidi che, se solubili, fanno diventare blu la soluzione al tornasole
soluzione
Il tornasole è un colorante di origine vegetale ottenuto in genere per estrazione di licheni. E una miscela complessa di varie sostanze la principale è il 7-idrossi2-fenazinone.
Vira al rosso in ambiente acido (pH < 4,4) e al blu in ambiente basico (pH > 8,0). Data la sua capacità di cambiare colore in funzione del PH dell’ambiente in cui viene posto. Nel caso degli ossidi dei non metalli sappiamo che formano acidi in ambiente con acqua, quindi nell’aria a causa del vapore acqueo presente fa cambiare in rosso il tornasole.
La risposta corretta è B
61. La massa di acido acetico (C2H4O2) in 250 cm3 di una soluzione 0,1 M di acido acetico è:
A) 1,5 g
B) 3,0 g
C) 6,0 g D) 12,0 g E) 18,0 g
soluzione
0,1 molare significa che in 1000 ml vi sono 0,1 moli . Sappiamo che dalle moli si può risalire ai grammi ricordando che moli= g/PM e quindi g= moli x PM
Pertanto essendo il PM di C2H4O2 = 60 si ha che in 1 litro (1000 ml) vi sono g = 0,1 x 60=6,0 g
quinsi se in 1000 ml vi sono 6 g in 250 ml ve ne sono X X = 6 x 250 /1000 = 1,5 g
62. Nella reazione: 2 Na + HNO3 → NaNO2 + NaOH l’acido nitrico agisce da:
A) ossidante
B) acido
C) nitrante
D) catalizzatore
E) disidratante
soluzione
si tratta della formazione di un sale pertanto l’HNO3 è un acido forte.
1[NO3- + 2 e + H+ —> NO2- + OH-
2[ Na —-> Na+ + e
__________________________________
NO3- + 2 Na + H+ —-> NO2- + 2Na+ + OH-
quindi HNO3 + 2 Na+ —-> NaNO2 + NaOH
la reazione è un’ossidoriduzione in cui il sodio metallico si ossida e l’azoto dell’acido nitrico si riduce dal numero di ossidazione +5 a +3 nel nitrito NO2-.
La risposta corretta è A
63. L’acido acetico diluito è un debole conduttore di elettricità perché è:
A) parzialmente solubile in acqua
B) parzialmente ionizzato in acqua
C) completamente ionizzato in acqua
D) dissociato in acqua
E) associato in acqua con molecole d’acqua
soluzione
l’acido acetico è un acido debole e si dissocia debolmente in H2O
CH3COOH<==> CH3COO- + H+
la conducibilità o conduttanza di una soluzione (simbolo λ è definita come l’inverso della sua resistenza R)L’unità di misura della conducibilità è il Siemens (simbolo S) e dalla definizione su scritta si deduce che 1 S = 1Ω -1 (ohm-1).Se alla soluzione viene applicato un campo elettrico, gli ioni si muovono sotto l’azione di talecampo. Essendo gli ioni particelle cariche, il loro movimento determina una corrente elettrica. Tutti i conduttori elettrici in cui la corrente è data dal movimento di ioni (e non di elettroni) vengono detti conduttori ionici o elettrolitici nei quali il passaggio dell’elettricità è dovuto ad un doppio flusso, in direzioni opposte, di ioni positivi e negativi, ed è quindi accompagnato da trasporto di materia.
L’ acido acetico essendo poco dissociato produce pochi ioni in soluzione e da questo la sua bassa conducibilità.
risposta corretta B
64. Il ΔH (variazione di entalpia) della reazione:
N2(g) + 3 H2(g) → 2 NH3(g) è -22 kcal/mole di H2.
Ciò significa che la reazione:
A) è esotermica ed avviene con cessione di calore all’ambiente
B) è endotermica ed avviene con cessione di calore all’ambiente
C) avviene solo in un calorimetro o in un thermos
D) è esotermica ed avviene con assorbimento di calore dall’ambiente
E) è endotermica ed avviene con assorbimento di calore dall’ambiente
soluzione
il ΔH di una reazione è il risultato della differenza tra ∑ H prodotti – Σ H reagenti .
Da questa relazione si evince che se i contenuto termico dei reagenti è superiore a quello dei prodotti il ΔH è negativo e quindi si sviluppa calore cioè la reazione è esotermica mentre se il ΔH è positivo significa che i prodotti possiedono un contenuto termico maggiore dei reagenti quindi bisogna fornire calore e la reazione è quindi endotermica.
Nel caso in esame il ΔH = -22 Kcal/mole quindi la reazione è esotermica
risposta corretta al quesito A
65. Nella reazione precedente, la resa in NH3 è favorita da:
1. un aumento di temperatura
2. una diminuzione di temperatura
3. un aumento della pressione
4. una diminuzione della pressione
Quale di queste affermazioni è esatta?
A) 1
B) 2
C) 2 e 3
D) 1 e 4
E) 3
soluzione
in una reazione chimica che sviluppa calore il calore deve essere considerato come una qualunque sostanza .Per esempio in una reazione A+B —> C + calore
Se sottraiamo calore la reazione si sposta verso destra, non solo ma se A e B sono sostanze gassose, è evidente che un aumento di pressione favorisce gli urti tra le molecole per cui viene favorita la reazione nella formazione dei prodotti. Si deduce che nella reazione in esame
N2(g) + 3 H2(g) → 2 NH3(g) è -22 kcal/mole
una diminuzione di calore comporta uno spostamento a destra della reazione così come avviene se si aumenmte la pressione.
Si deduce che la risposta corretta è C
66. Quando una lamina di zinco è posta in una soluzione di solfato di rame:
A) gli atomi di rame si ionizzano e si deposita dello zinco
B) gli ioni solfato perdono la loro carica
C) gli atomi di zinco si ionizzano e si deposita del rame
D) si forma acido solforico
E) non accade nulla
soluzione
per rispondere a questa domanda bisogna considerare i potenziali elettrochimici di riduzione standard. La tabella mostra che
Cu2+(aq) + 2 e- ==> Cu(s) E°= 0,337 V
Zn2+(aq) + 2 e- ==> Zn(s) E°= -0,763
sappiamo che gli elementi che sono più positivi (o meno elettronegativi) agiscono sempre da ossidanti, quindi se lo zinco si trova allo stato metallico, viene ossidato dagli ioni rame, infatti
Cu2+(aq) + 2 e- ==> Cu(s)
Zn ==> Zn+2 +2e
si deduce che la risposta corretta è C
67. Un agente riducente:
A) forma sempre idrogeno
B) toglie sempre idrogeno
C) è un donatore di elettroni
D) è un accettare di elettroni
E) è un composto che contiene idrogeno
soluzione
Una sostanza riducente nel momento in cui riduce un’ altra sostanza cedendogli elettroni, nello stesso tempo si ossida cioè aumenta il numero di ossidazione poichè perde elettroni .
Risposta corretta C
68. Quale delle seguenti reazioni rappresenta l’azione dell’acido solforico diluito sullo zinco?
A) Zn + H2O + H2SO4 → Zn(OH)2 + H2S + O2
B) 2 Zn + 2 H2SO4 → 2 ZnS + 2 H2O + 3 O2
C) 4 Zn + H2SO4 → 4 ZnO + H2S
D) Zn + H2SO4 → ZnSO4 + H2
E) Zn + H2SO4 → ZnH2 + SO2 + O2
soluzione
un metallo che reagisce con un acido produce un sale + idrogeno quindi la reazione corretta è
Zn + H2SO4 → ZnSO4 + H2
la risposta corretta è D
69. Il pH di un liquido è un indice:
A) della concentrazione dello ione idrogeno del liquido
B) della massa dell’idrogeno nel soluto
C) della massa dello ione idrogeno in 1L di liquido
D) del numero di atomi di idrogeno presenti
E) della valenza del radicale acido
soluzione
Il PH = – log [H+] e quindi la risposta corretta è A
70. Un liquido con pH = 8 è:
A) alcalino
B) acido
C) neutro
D) anfotero
E) organico
soluzione
essendo PH = 8 la soluzione è basica infatti sappiamo che PH+POH = 14 da cui POH= 14- 8 =6
Più basso è il POH più basica è la soluzione . Più alto è PH più basica è la soluzione.
la risposta è A











Lascia un commento