GIOCHI DELLA CHIMICA 2011 NAZIONALI CLASSE C
1. Indicare l’affermazione corretta a proposito del litio.
A) il litio ha molecola Li2, con ordine di legame 1,che esiste nei vapori del metallo
B) il litio ha una molecola Li2 con gli orbitali σ(1s) e σ*(1s) completamente occupati, σ(2s) completo e σ*(2s) con un elettrone, ordine di legame 1,5
C) il Li ha molecola monoatomica come tutti i metalli alcalini
D) il litio ha molecola Li2, con ordine di legame 2, paramagnetica, in accordo con il fatto che l’elettrone 2s è spaiato
soluzione
La risposta B è palesemente errata perchè la molecola dovrebbe avere 7 elettroni mentre la molecola ha 6 elettroni.
La rtisposta C è anch’essa palesemente errata perchè la molecola non è monoatomica ma biatomica Li2
La risposta D è errata perchè la molecola non ha elettroni spaiati e quindi n0n può essere paramagnetica.
Li2 è una molecola biatomica formata da due atomi di litio uniti da un legame covalente. Li2 ,conosciuto in forma gassosa, ha ordine di legame 1 , (l’ordine di legame è dato dal 1/2 numero di elettroni di legame – numero di elettroni di antilegame) con una separazione tra i due nuclei di circa 267,3 picometri e un’energia di legame di 101 KJ/mol.
La struttura di Li2 è la seguente:
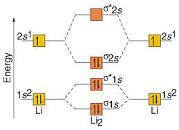
come si vede gli elettroni di legame soni 2 elettroni σ1s e 2 elettroni σ2s cioè 4 elettroni mentre quelli di antilegame sono 2 elettroni in σ1s∗ quindi l’ordine di legame è 1/2( 4-2) = 1
La risposta corretta alquesito è A
2. Indicare l’unica frase che completa in modo corretto quanto di seguito riportato. Nel prevedere empiricamente la forma delle molecole, da anni si applica la teoria Valence Shell Electron Pair Repulsion (VSEPR) di Gillespie. Secondo tale teoria, la forma delle molecole si può dedurre dalla disposizione nella specie chimica: AXmEn dove (m) è il numero di sostituenti X; (n) è il numero di coppie di elettroni di non legame attorno all’atomo centrale(A). In particolare si ha che:
A) nel caso di HgCl2, PCl5, AlF63‒ (AX2, AX5 eAX6) si hanno forme rispettivamente lineare, triangolare e ottaedrica
B) nel caso di BF4‒, NH3, H2S (AX4, AX3E e AX2E2) si hanno forme rispettivamente tetraedrica, piramidale trigonale e a V
C) nel caso di BrF3 (AX3E2) si ha forma tetraedrica distorta
D) nel caso di PbCl2 o SnCl2 (AX2E) si ha forma di piramide trigonale
soluzione
Secondo la teoria VESPR ed il metodo AXE dove A è l’atomo centrale ,X i legandi ed E il numero di coppie solitarie (lone Pair) si hanno le seguenti strutture
La risposta A è errata perchè AX5 non è una molecola triangolare ma è una bipiramide Trigonale (vedi la prima figura al numero 5 in quanto non vi sono elettroni spaiati)
La risposta C è errata perchè la forma AX3E2 dovrebbe essere a T e non tetraedrica distorta
La risposta D è errata in quanto la forma AX2E deve essere angolare e non a forma di piramide trigonale.
La risposta corretta è B perchè AX2, AX5 eAX6 hanno forme rispettivamente lineare, triangolare e ottaedrica.
3. Indicare come varia la conducibilità di una soluzione acquosa di solfato di magnesio (20 mL, 0.2 M) quando si aggiunge gradualmente una soluzione acquosa di idrossido di bario (0.5 M).
A) diminuisce
B) aumenta
C) prima diminuisce poi aumenta
D) prima aumenta poi diminuisce
soluzione
la conducibilita’ di una soluzione viene misurata in una cella conduttimetrica .
In pratica, una porzione di soluzione viene confinata tra due elettrodi (generalmente di platino). Uno strumento ( conduttimetro) fa circolare una corrente alternata di elevata frequenza fra gli elettrodi e misura la resistenza della soluzione compresa fra essi. L’inverso di tale resistenza e’ naturalmente la conducibilita’.
L’impiego della corrente alternata invece che continua e’ essenziale. Invertendo rapidamente e continuamente la polarita’ degli elettrodi si impediscono infatti fenomeni di elettrolisi che cambierebbero la concentrazione delle specie ioniche in soluzione. La conducibilità di una soluzione dipenda anche dalle caratteristiche della cella che vengono inglobate in una costante detta costante di cella.
K =costante di cella
dove ![]() viene chiamata concentrazione equivalente dell’elettrolita ed e’ la concentrazione totale di cariche di un dato segno.
viene chiamata concentrazione equivalente dell’elettrolita ed e’ la concentrazione totale di cariche di un dato segno.
per una soluzione infinitamente diluita contenente ![]() ,
, ![]() e
e ![]() , si ha:( legge di Kohlrausch)
, si ha:( legge di Kohlrausch)
Nel caso in esame,all’inizio abbiamo 20ml 0,2M in cui vi sono 0,2 x 20 = 4 moli . cioè le specie Mg++ ed SO4-2
Se aggiungiamo Ba(OH)2 si forma il solfato di Bario per cui diminuisce la quantità di SO4-2 e la conducibilità diminuisce.Quando tutto SO4-2 viene precipitato lo ione OH- aggiunto sarà la specie ionica che condurrà la corrente e la conducibilità a questo punto aumenterà progressivamente con l’aggiunta di Ba(OH)2 .
Risposta corretta C
4. Una soluzione acquosa contiene uno ione metallico X. Trattando la soluzione con acido cloridrico si forma un precipitato bianco che però, diluendo con acqua calda, si scioglie completamente Se si gorgoglia H2S nella soluzione iniziale si forma un precipitato nero Se si tratta la soluzione iniziale con ioduro di sodio si forma un precipitato giallo ad aghi,Se si tratta la soluzione iniziale con solfato di sodio si forma un precipitato bianco. Indicare a quale gruppo della tavola periodica appartiene lo ione X
A) 7° gruppo (VII B)
B) 11° gruppo (I B)
C) 14° gruppo (IV A)
D) 15° gruppo (V A)
soluzione
L’elemento X deve essere il Piombo. Infatti con HCl si forma PbCl2 che si solubilizza in H2O calda. Con lo iodio forma un precipitato giallo di PbI2 ed infine con H2S forma PbS di colore nero.
Il piombo appartiene a gruppo 14 (IV) .
Risposta corretta C
5. In natura esistono due isotopi del bromo, 79Br e 81Br, entrambi con abbondanza relativa di circa il 50%. Indicare la massa molecolare più probabile per una molecola di Br2.
A) 158 u
B) 160 u
C) 162 u
D) non si può sapere se non si conosce la densità
soluzione
Sappiamo che il PA tabulato nella tavola periodica è il risultato del valore medio tra il Pa dell’isotopo moltiplicato per la sua abbondanza in natura.
Nel caso in esame essendo l’abbondanza in natura pari al 50% per ambedue gli atomi quindi possiamo ritenere il PA = 79+81/2= 80
La molecola di Br2 ha quindi una massa molecolare pari a 160 u
risposta corretta B
6. La decomposizione termica del carbonato di calcio porta alla formazione di ossido di calcio e anidride carbonica. Per decomporre una quantità nota (100,09 g) di carbonato di calcio a 600 °C e a 101,3 kPa sono necessari esattamente 1,78 ∙105J.
Calcolare la variazione dell’energia interna del sistema costituito da 1,00 g di CaCO3 nelle stesse condizioni di temperatura e pressione.
A) DU = 1,71 ∙103J
B) DU = 1,80 ∙103J
C) DU = 1,91 ∙103J
D) DU = 0,00 J
soluzione
100,09 corrisponde ad 1 mole di CaCO3 mentre 1,og corrispondono a 1/100,09= 0,00999 moli
1 :1,78 x 105 = 0,00999 moli :X X = 1778 J = 1,778 x 103 J
risposta corretta A
7. Si vuole preparare una soluzione acquosa di glicole etilenico (250 mL) al 37,4% in massa, avente densità d = 1,048 g/mL, miscelando due soluzioni acquose A e B di glicole etilenico, di cui sono note le percentuali in massa e le rispettive densità. Ritieni i volumi additivi. A: 28,0 % in massa, d = 1,035 g/mL B: 40,1% in massa, d = 1,052 g/mL .Indicare i volumi necessari di A e B.
A) 57 mL di A e 193 mL di B
B) 193 mL di A e 57 mL di B
C) 91 mL di A e 168 mL di B
D) 17 mL di A e 128 mL di B
soluzione
La soluzione finale deve contenere in 250 ml 97,988 g (250 x 1,048 x 0,374)
X 0,28 x 1,035 + Y 0,401 x 1,052 = 250 x 1,048 x 0,374
X=250- Y
250 -Y ( 0,28 x 1,035) + Y 0,401 x 1,052 = 97,988
(250-Y)0,2898 + Y 0,4218 = 97,988
72,45 – 0,2898Y + 0,4218Y = 97,988
25,538 =0, 132Y Y= 193,46 ml
X= 250- 193,46 = 56,53 ml
Dovremo mescolare 56,53 di soluzione A e 193,46 di soluzione B per ottenere 250 ml di soluzione richiesta
Risposta corretta A
8. Indicare il valore della solubilità molare di CaC2O4 (Kps = 2,3 ∙10‒9 M, a 25 °C) in una soluzione
1,5 ∙10‒1 M di CaCl2 a 25 °C.
A) 1,5 ∙10‒2 M
B) 2,3 ∙10‒9 M
C) 1,5 ∙10‒8 M
D) 2,5 ∙10‒3 M
soluzione
La solubilità di CaC2O4 si ottiene ricordando che Kps= [Ca+2] [C2O4-2] = S x S =S2
S= √Kps= 4,8 x 10-5 M
Poichè però ci troviamo in presenza di CaCl2 1,5 x 10-1 M allora Kps= (S + 1,5 x 10-1)S
da cui Kps= S2 + 1,5 x 10-1 S S2 + 1,5 x 10-1 S – 2,3 ∙10‒9 M,=0
da cui S= 1,5 x 10-8 M
risposta corretta C
9. Indicare il valore del pH a 25 °C di una soluzione ottenuta sciogliendo acido acetilsalicilico (HC9H7O4; aspirina ; 0,235 g) in acqua (0,500 L) a 25 °C. La Ka dell’acido è 3,3 ∙10‒4, a 25 °C.
A) 1,50
B) 3,03
C) 5,49
D) 4,23
soluzione
L’aas è un acido debole HA che si dissocia in HA<=> H+ + A-
la [HA] =Ca = 2 x 0,235 g in 1000 cc di H2O quindi 0,470/ 180,15= 2,6 x 10-3 M
Dalla relazione che fornisce Ka = [H+]2 /Ca otteniamo [H+]= √ KaCa = √ 3,3 x 10-4 x 2,6 x 10-3
[H+]= 9,26 x 10-4 PH= 4- log 9,26 = 4- 0,73 = 3,03
risposta corretta B
10. Una soluzione acquosa di acido nicotinico (HC6H9NO2) 1,20 ∙10‒2 M ha pH 3,39 a 25 °C. La
sua costante di ionizzazione acida e il grado di ionizzazione dell’acido sono, nell’ordine:
A) 2,8 ∙10‒3 1,34
B) 1,4 ∙10‒5 3,4 ∙10‒2
C) 1,5 ∙10‒4 1,2
D) 1,2 ∙10‒4 1,0
soluzione
Sappiamo che [H+]= 10-ph quindi [H+]= 10 -3,39= 0,61 x 10-4 = 4,07x 10-4
Ka=[H+]2 / CA Ka= (4,07 x 10-4)2 / 1,2 x 10-2 = 16,6 x 10-8 / 1,2 x 10-2 = 13,8 x 10-5 = 1,4 x 10-5
il grado di ionizzazione quantità dissociata all’equilibrio/ quantità iniziale
la quantità di A che si dissocia da HA è uguale a quella di H+ quindi [a-]=[H+] = 4,07 x 10-4 M pertanto
grado di ionizzazione = α = 4,07 X 10-4 /1,2 X 10-2 = 3,4 x 10-2
risposta corretta B
11. Indicare la sequenza che riporta le specie in ordine decrescente di forza di legame:
A) O2 > O2‒> O22‒
B) O2‒> O22‒> O2
C) O22‒> O2‒> O2
D) O22‒> O2 > O2‒
soluzione
la forza di un legame viene misurata dall’energia necessaria a separare gli atomi che lo formano.
Ciò detto analizziamo le strutture delle molecole

questa struttura e abbastanza stabile ed occorre una energia di 494 Kj/mol.
La struttura di O2- possiede una carica negativa in più che si localizza nell’orbitale π di antilegame. Questa struttura chiaramente necessita di una minore energia rispetto alla molecola di ossigeno
La molecola O2-2 è una molecola che corrisponde al radicale dell’H2O2 ed il legame tra gli atomi di O richiede solo 192 Kj/mol .
Da quanto detto si deduce che l’ordine decrescente della forza di legame è: O2 > O2‒> O22‒
Risposta corretta A
12. Indicare le specie paramagnetiche (P) e diamagnetiche (D): O2 , O2‒ , O2 2‒
A) P: O2‒; O2 ; D: O22‒
B) P: O22‒; D: O2 ; O2‒
C) P: O2; D: O22‒; O2
Se consideriamo gli O.M. della molecola di O2 nell’esempio precedente,vediamo che O2 possiede 2 elettroni spaiati (che si trovano nei due orbitali i π di antilegame) che conferiscono alla molecola la proprietà del paramagnetismo (subisce l’influenza di un campo magnetico esterno).
Analogamente O2- possiede 1 elettrone in più rispetto ad O2 e quindi ha 2 elettroni in uno degli orbitali π di antilegame accoppiati ed 1 elettrone spaiato nell’altro orbitale di antilegame e quindi anch’esso è paramegnetico (possiede 2 elettroni π di antilegame accoppiati ma rimane 1 elettrone non accoppiato) mentre la molecola O2-2 avendo 2 elettroni in più rispetto ad O2 possiede gli orbitali molecolari π di antilegame senza elettroni spaiati (vi sono 2 elettroni in pià rispetto all’ossigeno.
si deduce che O2 ed O2- sono Paramagnetici (P) mentre O2-2 è diamagnetico (D)
risposta corretta A
13. In un equilibrio solido-liquido, al crescere della pressione il sistema evolve verso il solido. Ciò
permette di affermare che:
A) la densità del solido è maggiore di quella del liquido
B) la densità del solido è minore di quella del liquido
C) il liquido e il solido sono di natura metallica
D) si tratta di zolfo fuso o solido
soluzione
Con il termine “freezing” ci si riferisce al passaggio di stato tra la fase liquida e la fase solida.Durante la solidificazione, le particelle che compongono il liquido diminuiscono la propria mobilità e all’atto della solidificazione ogni particella assume una posizione fissa all’interno del reticolo cristallino.L’energia interna del sistema diminuisce e contemporaneamente viene liberata
energia sotto forma di calore rendendo di conseguenza il processo esotermico. Questo significa che se si diminuisce la temperatura si favorisce il processo di solidificazione.Pertanto la solidificazione di un liquido si può ottenere sia per variazione della pressione che per una combinazione della variazione di pressione con il raffreddamento o col solo raffreddamento. In ogni caso, il solido presenta una densità maggiore rispetto al liquido (ricordiamo che la densità =massa /unità di volume ) in quanto nel processo di solidificazione del liquido il volume diminuisce con la sola eccezione dell’acqua che passando da liquido a solido (ghiaccio) diminuisce la propria densità (infatti il ghiaccio galleggia sull’acqua liquida).
Ne consegue che la risposta corretta è A
14. Indicare tra le seguenti specie quelle con geometria planare quadrata: IF4‒, HPO42‒, NO2‒, BF3
A) NO2‒ ; BF3
B) IF4‒ ; HPO42‒
C) IF4‒
D) IF4‒ ; NO2‒
soluzione
tra i composti presentati l’unico ad avere una struttura planare quadrata è IF4- in quanto vi sono 2 coppie solitarie e se utilizziamo il metodo AXE della teoria VESPR sappiamo che la struttura è planare quadrata mentre BF3 ha struttura trigonale NO2- ha anch’essa struttura trigonale e gli atomi si trovano tutti sullo stesso piano mentre HPO4-2 ha struttura tetraedrica.

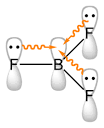

La risposta corretta è C
15. Indicare la temperatura alla quale è termodinamicamente possibile che il carbonio grafitico riduca l’ossido di ferro(III) a ferro metallico, mediante la reazione:
2 Fe2O3 (s) + 3 C (grafite) → 4 Fe (s) + 3 CO2 (g)
Si considerino i seguenti valori, costanti al variare della T:
∆fH° (CO2 (g)) = -393,5 kJ mol‒1; x 3 =- 1180,5 kJ/mol
∆fH° (Fe2O3 (s)) = -824,2 kJ mol‒1; x2 =- 1648,4 KJ/mol diff= -467,9 Kj
S°m (Fe (s)) = 27,3 J mol‒1K‒1; x 4 = 109,2 109,2 + 641,1 = 750,3 – 191,1 = 0,558,9 KJ delta S
S°m (CO2 (g)) = 213,7 J mol‒1K‒1; x 3 = 641,1
S°m (Fe2O3 (s)) = 87, 4 J mol‒1K‒1; x2 = 174,8 T= deltH / deltS = 467,9/0,558 =838,5
S°m (C(grafite)) = 5,7 J mol‒1K‒1. x3= 17,1
A) T > 438 K
B) T > 138 K
C) T > 838 K
D) T > 25,0 K
soluzione
Sappiamo che la temperatura del processo è in relazione al ΔH e al ΔS della reazione, per cui calcoliamo il ΔH e poi ΔS
ΔH reaz = ∑ΔHprod – ∑ΔHreag =3 x 393,5 – -2 x 824,2 = -1180,5 + 1648,4 = 467,9 KJ/mol
ΔSreaz = ∑ΔSprod – ∑ΔSreag =
ΔSreaz =(3 x 213 ,7 + 4x 27,3 ) -( 2×87,4 + 3×5,7) = (641,1 + 109,2) – (174,8+ 17,1)= 750,3 – 192
ΔSreaz = 558 J/mol
Essendo il ΔSreaz espresso in J/mol dobbiamo trasformarlo in KJ/mol come il ΔHreaz quindi:
ΔSreaz = 0,559 pertanto T= ΔH / ΔS = 467,9/ 0,558= 839
Risposta corretta C
16. Si consideri il processo: H2O(s) → H2O(l) e si indichi la variazione di energia libera quando il
processo si svolge a 10 °C e a 0 °C. Si assuma ∆fusH° = 6,01 kJ mol‒1 e ∆fusS° = 22,0 J mol‒1 K, costanti al variare della T.
A) a 10 °C: +0,12 kJ mol‒1 ; a 0 °C: 0 kJ mol‒1
B) a 10 °C: -0,22 kJ mol‒1 ; a 0 °C: 0 kJ mol‒1
C) a 10 °C: +0,52 kJ mol‒1 ; a 0 °C: 0 kJ mol‒1
D) a 10 °C: +0,22 kJ mol‒1 ; a 0 °C: -1 kJ mol‒1
soluzione
Sappiamo che la variazione di energia libera di un processo ΔG= ΔH – T ΔS non è altro che l’energia resa disponibile per produrre lavoro ed è data dal contenuto energetico H tranne una parte di natura entropica che non è disponibile in quanto serve all’esistenza stessa del sistema. Dai dati forniti dal quesito si ha, ricordando che bisogna esprimere H ed S nelle medesime unità di misura (ad es KJ)
ΔG= 6,01 – 283 x 0,022 = – 0,22 KJ/mol a 10°C
ΔG= 6,01 – 273 x 0,022 = 6,01 -0,601 =0 Kj/mol a 0° C
risposta corretta B
17. Indicare quale fra le molecole N2H4, N2 e N2F2 presenta la minor lunghezza del legame azoto-azoto e quale la maggiore:
A) N2 N2F2
B) N2F2 N2H4
C) N2 N2H4
D) N2H4 N2F2
soluzione
Le lunghezze di legame sono misurabili in una molecola attraverso la diffrazione ai raggi X.
Tra le principali caratteristiche si possono elencare le seguenti:
- quanti più elettroni partecipano alla formazione del legame, minore sarà la lunghezza di legame;
- al diminuire della distanza di legame, aumenta l’ energia del legame e le forze attrattive fra gli atomi;
- dipende dal tipo di ibridizzazione degli atomi nella molecola e dalla natura elettronica e sterica dei sostituenti;
- per la stessa coppia di atomi, il legame triplo è più corto del doppio legame il quale è più corto del legame semplice ;
- in un legame covalente omopolare la metà della distanza di legame è uguale al raggio covalente.
La molecola di N2 presenta iun triplo legame pertanto tra le molecole indicate ha la minore lunghezza di legame.
L’idrazina N2H4 possiede 4 legami semplici ma è legata a 4 atomi di H pertanto rispetto a N2F ha lunghezza di legame più breve ma maggiore rispetto ad N2.
N2F2 è una molecola in cui i due atomi di N sono legati da un doppio legame ma l’elettronegatività del Fluoro è tale da allontanarlo dagli atomi di azoto che possiedono un doppietto elettronico libero tanto che abbiamo 2 molecole una Cis ed una trans.
Si deduce che la lunghezza minore di legame si ha per N2 ed N2H4
Risposta corretta C
18. Indicare le velocità relative di diffusione (v) tra metano e il tetradeuterometano:
A) vCH4 / vCD4 = 2,24
B) vCH4 / vCD4 = 3,06
C) vCH4 / vCD4 = 1,12
D) vCH4 / vCD4 = 3,08
soluzione
Graham, scoprì per via sperimentale che la velocità di diffusione di un gs è inversamente proporzionale alla radice quadrata della massa molecolare (peso molecolare) del gas:
Dove:
- V1 è la velocità di effusione del primo gas.
- V2 è la velocità di effusione del secondo gas.
- M1 è la massa molare del primo gas.
- M2 è la massa molare del secondo gas.
la massa molecolare del metano è : CH4= 16,04 e quella del Tetradeuterometano è CD4 = 12 + 2,014 x 4 = 20,05
Il rapporto tra le masse molecolari è 20,05 /16,04= 1,25 e quindi
V1/V2 = √1,25= 1,12
Risposta corretta C
19. Indicare in quale dei seguenti ossidi non c’è un legame diretto tra due atomi di azoto:
A) N2O
B) N2O3
C) N2O4
D) N2O5
soluzione

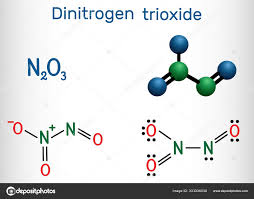
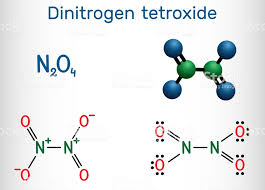
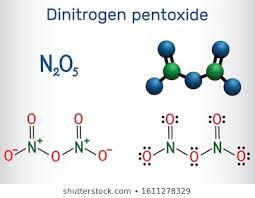
Dalle strutture mostrate sopra si evince che la molecola in cui non sono legati i due atomi di N è
N2O5 (pentossido di diazoto).
risposta corretta D
20. Indicare nell’ordine l’entropia standard di vaporizzazione e l’entropia standard di fusione dell’acqua al punto di ebollizione e di fusione. (∆vapH° = 40,7 kJ mol‒1; ∆fusH° = 6,01 kJ mol‒1)
A) ∆vapS° = -109 J mol‒1K‒1 ; ∆fusS° = 22,0 J mol‒1 K‒1
B) ∆vapS° = -10,9 J mol‒1K‒1; ∆fusS° = 2,02 J mol‒1K‒1
C) ∆vapS° = 109 J mol‒1K ‒1; ∆fusS° = 22,0 J mol‒1K‒1
D) ∆vapS° = -309 J mol‒1K‒1; ∆fusS° = -322 J mol‒1 K‒1
soluzione
come abbiamo visto in un precedente quesito, ΔS = ΔH/T quindi alla temperatura di ebollizione (100°C) si ha
ΔS = 40,7/373,15 = 0,109 KJ/mol o meglio 109 J /mol ed a =°C ΔS= 6,01 / 273,15 = 0,0220 KJ/mol cioè 22 J /mol
risposta corretta C
21. Una soluzione acquosa di NaOH (250,0 mL, 0,250 M) viene titolata con una soluzione acquosa di HCl (0,340 M). Calcolare il pH della soluzione iniziale e quello che si realizza dopo l’aggiunta di
5,00 mL di titolante.
A) 13,3; 13,1
B) 13,1; 12,4
C) 13,2; 13,5
D) 13,4; 13,4
soluzione
La concentrazione iniziale di NaOH è 0,250 M per cui [OH-] = 0,250 M POH= -log 0,250 = 0,602
PH= 14- 0,602 = 13,38
Quando si aggiungono 0,005 litri (5 ml) di HCl 0,34 M si aggiungono 0,005 x 0,34 = 0,0017 moli di HCl
Le moli iniziali di NaOH sono 0,250 Ml x 0,250 M = 0,0625 moli per cui dopo aggiunta di 0,0017 moli di HCl rimangono 0,0625 -0,0017 = 0,0608 moli in un volume di 250 + 5 ml cioè 255 ml cioè 0,255 L.
La nuova concentrazione di OH- è quindi [OH-] = 0,0608/ 0, 250 = 0,243 M da cui otteniamo POH = – log 2,43 x 10-1 = 1- 0,614 = 0.386 PH= 14 – 0,386 =13,38
Risposta corretta D
22. Un recipiente pieno d’acqua è messo a diretto contato con un fornello riscaldante, a 25 °C, e trasferisce all’acqua 100 J in modo reversibile. La variazione di entropia dell’acqua vale:
A) 0,672 J K‒1
B) 0,336 J K‒1
C) -2,315 J K‒1
D) non si può sapere, manca il valore S°(H2O) a 0 K soluzione
soluzione
sappiamo che ΔS= Q/T pertanto ΔS= 100 J / 298 = 0,356 J /K
risposta corretta B
23. Se si riporta in grafico l’energia di legame per nucleone in funzione della massa atomica si ottiene il ben noto grafico riportato in figura, dove ilmassimo è il 56Fe. Indicare a quale freccia corrisponde la fusione nucleare e quale la fissione nucleare.
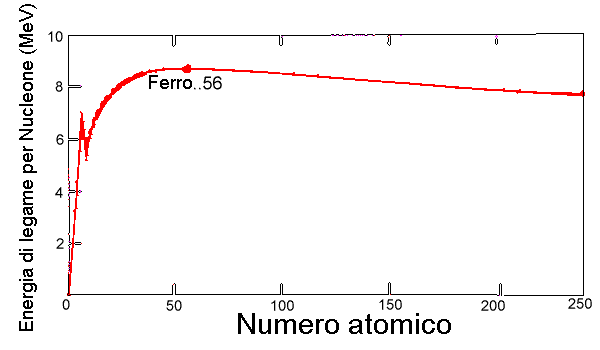
A) X e Y fusione
B) X e Y fissione
C) X fusione, Y fissione
D) X fissione, Y fusione
soluzione
Nei principali isotopi dei nuclei leggeri, come carbonio, azoto e ossigeno, il numero dei neutroni e quello dei protoni è uguale. Tuttavia, quando si considerano nuclei più pesanti, aumenta l’energia distruttiva dei protoni, poiché essi vengono ad essere confinati in un volume ristretto e si respingono l’un l’altro. L’energia dell’interazione nucleare forte, che tiene insieme il nucleo, cresce anch’essa, ma meno rapidamente, come se dentro il nucleo fossero legati strettamente tra loro soltanto i nucleoni vicini e non quelli separati da maggiore distanza.L’energia di legame netta di un nucleo è quella dell’attrazione nucleare meno l’energia distruttiva della forza elettrica. Quando i nuclei diventano più pesanti dell’elio, la loro energia di legame per nucleone netta (dedotta dalla differenza di massa tra il nucleo e la somma delle masse dei nucleoni componenti) cresce sempre più lentamente, raggiungendo il suo picco con il ferro. Questa parte di curva rappresenta la fusione nucleare. Aggiungendo degli altri nucleoni, l’energia di legame nucleare totale cresce ancora, ma l’energia distruttiva totale delle forze elettriche (i protoni positivi respingono altri protoni) cresce anch’essa e, dopo il ferro, l’energia distruttiva totale delle forze elettriche ha il sopravvento sulla prima. Si può dire che il ferro 56Fe è il nucleo con il legame più efficiente. La curva dell’energia di legame rappresenta il grafico dell’energia di legame per nucleone in funzione del peso atomico. La curva ha il suo picco principale in corrispondenza al ferro e poi decresce di nuovo lentamente, ma ha anche uno stretto picco isolato in corrispondenza all’elio che, come si è notato, è molto stabile.La seconda parte della curva rappresenta gli elementi che presentano nuclei instabili che decadono emettendo particelle e quindi questa parte di curva rappresenta la fissione nucleare.
Risposta corretta C
24. Un campione di CuSO4 ∙ nH2O viene riscaldato fino ad eliminare l’acqua di cristallizzazione e successivamente ripesato. La massa finale del campione è il 64% di quella iniziale. Indicare il numero medio di molecole di acqua di cristallizzazione n per ogni
unità di CuSO4.
A) 2
B) 4
C) 5
D) 2,5
soluzione
I grammi di CuSO4 dopo il riscaldamento sono 64 g e quindi le moli di CuSO4 sono 64/ 159,6 = 0,4 moli
Ovviamente dopo riscaldamento i grammi di H2O sono 100-64 = 36 g per cui le moli di H2O sono 36/ 18= 2
pertanto 0,4 moli vi sono 2 moli di H2O per ogni mole ve ne sono X
0,4: 2 = 1 : X X= 2/0,4= 5 moli di H2O
Per ogni mole di CuSO4 vi sono 5H2O pertanto la formula è CuSO4• 5H2O
risposta corretta C
25. Una soluzione acquosa di un elettrolita debole binario (1,00 ∙10‒1 m) presenta un innalzamento ebullioscopico di 5,27 ∙10‒2
°C. Indicare il grado di dissociazione dell’elettrolita. Keb (H2O) = 5,20 10‒1°C kg mol‒1.
A) 1,11 ∙10‒2
B) 8,2 ∙10‒2
C) 1,37 ∙10‒2
D) 3, 5 ∙10‒2
soluzione
Sappiamo che la presenza di un soluto in un solvente puro provoca una variazione della sua temperatura di ebollizione, e sappiamo che questo effetto dipende dal numero di particelle in soluzione (proprietà colligativa).
La tensione di vapore (che indica la tendenza all’evaporazione) di una soluzione è minore della tensione di vapore del solvente puro, pertanto è necessario maggior calore per far sì che la pressione del vapore del solvente provochi l’ebollizione della soluzione.
Di conseguenza si avrà un innalzamento della temperatura di ebollizione.
La variazione della temperatura di ebollizione è proporzionale alla costante ebulloscopica molale (Keb) determinata sperimentalmente, alla molalità (numero moli di soluto su Kg di solvente) e ad i (numero di moli che ogni mole di soluto libera in soluzione) secondo questa legge:
A) le batterie sono celle elettrochimiche galvaniche
B) le batterie non sono soggette ai limiti del ciclo di Carnot
C) le batterie sfruttano corrente fornita per far avvenire reazioni chimiche non spontanee
D) le batterie sfruttano reazioni redox spontanee per produrre corrente elettrica
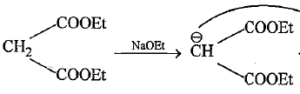
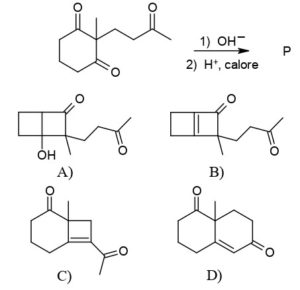
 questo reagisce con un’altra molecola di CH2=CHCOOEt per formare l’anello cicloesanico .
questo reagisce con un’altra molecola di CH2=CHCOOEt per formare l’anello cicloesanico .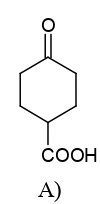
A) 1,03 ∙108 s
B) 2,05 ∙104 s
C) 2,06 ∙105 s
D) 1,03 ∙104 s
l’equazione relativa alla cinetica del primo ordine è -d[A]/[A] = Kdt dove K è espressa in (sec-1)
ln [A]/[A]0 = -K (t-t0)
(ln = logaritmo naturale) e se in questa poniamo [A] = 1/2 [A]0, (se vogliamo cioè che la concentrazione sia la metà dell’iniziale, come definito per il tempo di dimezzamento), e dato che t0 = 0 (inizio della reazione), avremo:

il tempo di dimezzamento t1/2 che è il tempo necessario perché la concentrazione iniziale di un reagente sia ridotta a metà.
29. In riferimento ad una cinetica di reazione del secondo ordine a un solo reagente (A), indicarel’affermazione ERRATA:
A) la concentrazione della specie considerata tende a zero più lentamente che nelle reazioni con cinetica del primo ordine
B) il tempo di dimezzamento della reazione varia a seconda della concentrazione iniziale della specie considerata
C) la velocità è indipendente dalla concentrazione della specie considerata
D) il grafico 1/[A] / t risulta una retta la cui pendenza rappresenta la costante cinetica
La velocità di reazione del secondo ordine è descritta dalla seguente formula:
v = k[A]2
Se si pone in grafico 1/[A] in funzione del tempo si ha una retta con pendenza pari a k (la risposta D è corretta)

![{\displaystyle {\frac {d\left[A\right]}{dt}}=-k\left[A\right]^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/097b5d35d3573f6a26f653ee09d3caf8ce96045a)
![{\displaystyle {\frac {d\left[A\right]}{\left[A\right]^{2}}}=-kdt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dd3979525b137a30c668df493ccad1e54aee229d)
![{\displaystyle \int _{\left[A\right]_{0}}^{\left[A\right]}{\frac {d\left[A\right]}{\left[A\right]^{2}}}=-\mathrm {k} \int _{0}^{t}dt}](https://wikimedia.org/api/rest_v1/media/math/render/svg/106c679a8107613d2ae95652969c5cdec4df6c72)
il tempo di dimezzamento t1/2 necessario perché una data quantità di sostanza A che si decompone secondo una reazione del secondo ordine venga ridotta della metà e cioè:
[A]= [Ao]/2
K = 1/t1/2 ( 1/ [Ao]/2 – 1/[Ao]) = 1/t1/2 ( 2/[Ao] – 1/[Ao]) = 1/t1/2( 1/[Ao])
Da cui t1/2= 1/K[Ao] e
K = 1/t1/2[Ao] la risposta b è corretta
essendo [A]2 allora la concentrazione tende a zero più lentamente che le reazioni del primo ordine come ci indica la derivata dA/A2 (risposta A corretta)
L a risposta errata è C
A) 38 g
B) 27 g
C) 19 g
D) 8,0 g
A) minore di 15,3 g per 1 kg di aria
B) maggiore di 15,3 g per 1 kg di aria
C) uguale a 15,3 g per 1 kg di aria
D) maggiore di 22,4 g per kg di aria
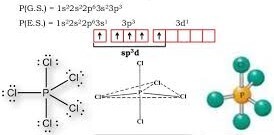
A) sp2, trigonale
B) sp3d, bipiramidale trigonale
C) sp3, tetraedrica
D) sp3d2, piramidale a base pentagonale
A) minore di quello di una soluzione acquosa di HNO3 di egual concentrazione, essendo più ionizzato
B) uguale a quello di una soluzione acquosa di HNO3 di egual concentrazione, essendo i due acidi entrambi di egual forza in soluzione
C) minore di quello di una soluzione acquosa di HNO3 di egual concentrazione, perché l’acido triflico riesce a spostare verso destra l’equilibrio acido-base dell’acqua
D) imprecisato se non si conosce il suo raggio di idratazione in acqua
A) si forma dal glucosio per ossidazione a livello del carbonio anomerico
B) si forma dal glucosio per ossidazione del suo gruppo alcolico primario
C) è implicato nella escrezione di bilirubina
D) è presente in numerosi polisaccaridi

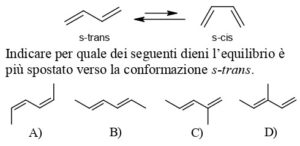
s-trans s-cis Indicare per quale dei seguenti dieni l’equilibrio è più spostato verso la conformazione s-trans.
B) fosfolipasi di veleno di serpente
C) fosfatasi acida
D) proteasi aspecifica
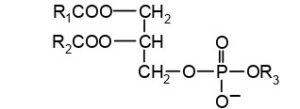
A) 2 fasi e 3 componenti
B) 1 fase e 3 componenti
C) 1 fase e 1 componente
D) 2 fasi e 1 componente
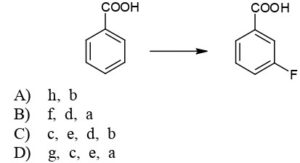
a. HF in piridina
b. HBF4
c. HNO3 in H2SO4
d. NaNO2 , HCl
e. Sn / HCl
f. AlCl3
g. NO2 in ammoniaca liquida
h. NaHSO4
Indicare l’ordine dei reattivi per trasformare l’acido benzoico nell’acido meta-fluorobenzoico:

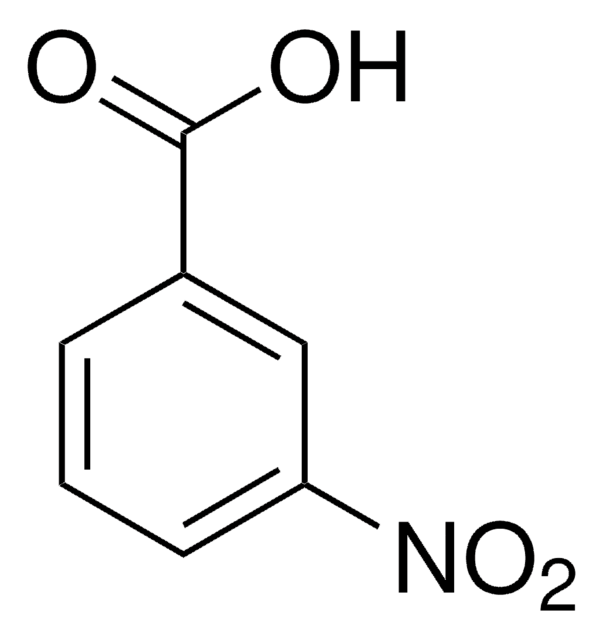
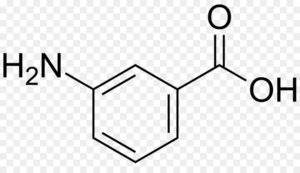
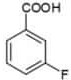 + BF3 + N2
+ BF3 + N2
4 NH3(g) + 3 O2(g) <=> 2 N2(g) + 6 H2O(g) + 1531 kJ
Se il suo stato viene perturbato dall’aggiunta di N2, il sistema, per ristabilire l’equilibrio, deve spostarsi:
A) verso sinistra e, quando il nuovo equilibrio è stato raggiunto, la concentrazione molare di H2O diminuisce
B) verso sinistra e quando il nuovo equilibrio è stato raggiunto la concentrazione molare di NH3 diminuisce
C) verso sinistra e quando il nuovo equilibrio è stato raggiunto aumentano le concentrazioni molari di NH3 , O2, H2O
D) verso destra e quando il nuovo equilibrio è stato raggiunto si ha una diminuzione della temperatura
A) la costante di equilibrio aumenta sempre
B) la costante di equilibrio diminuisce perché la reazione è esotermica
C) la costante di equilibrio aumenta perché la reazione è esotermica
D) cambia la composizione dell’equilibrio ma la Ke resta costante
A) la reazione evolve verso destra, tranne quando il catalizzatore è inibitore
B) la reazione evolve verso sinistra
C) l’equilibrio non viene alterato
D) si ha un aumento della Keq
2 H2 (g) + O2 (g) → 2 H2O (l)
A) ∆S > 0 perché le moli diminuiscono
B) ∆S < 0 perché le moli diminuiscono
C) ∆S < 0 perché si passa da 3 mol di gas a 2 mol di liquido
D) ∆S > 0 perché si passa da 3 mol di gas a 2 mol di liquido
A) ∆H = +540 kJ
B) ∆H = -879 kJ
C) ∆H = -850 kJ
D) ∆H = +102 kJ
A) come fluoruro nei minerali (F‒)
B) come composto dello xenon (XeF2)
C) come acido debole (HF(aq))
D) come elemento libero (F2)
A) catodo: 2 H2O (l) + 2 e‒ →H2(g) + 2 OH‒(aq) anodo: 2 SO42‒(aq) →S2O82‒(aq) +2 e‒
B) catodo: 2 H+(aq) + 2 e‒ → H2 (g) anodo: 2 H2O (l) → O2 (g) + 4 H+(aq) + 4 e‒
C) catodo: 2 SO42‒(aq) →S2O82‒(aq) + 2 e‒ anodo: 2 H2O (l) + 2 e‒ →H2 (g) + 2 OH‒(aq)
D) catodo: 2 H2O (l)→2 H2 (g) + O2 (g)anodo: 2 H+(aq) + 2 e‒ →H2 (g)
C6H12O6 (s) + 6 O2 (g)→6 CO2 (g) + 6 H2O (l)
indicare l’energia prodotta nel corpo da 1,00 g di glucosio. Si ammetta la reazione quantitativa.
A) 4,12 kJ
B) 38,5 kJ
C) 15,6 kJ
D) 3,72 kJ
B) cis-2-butene
C) trans-2-butene
D) 1-butene
Fe3+(aq), Cl2 (g), H2O2 (g)
quindi ordinare i seguenti: Al (s), H2 (g), Cu (s) in ordine di potere riducente crescente:
A) Fe3+(aq) < H2O2 (aq) < Cl2 (g) Cu (s) < H2 (g) < Al (s)
B) Fe3+(aq) < Cl2 (g) < H2O2 (aq) Cu (s) < H2 (g) < Al (s)
C) Fe3+ (aq) > Cl2 (g) > H2O2 (aq) Al (s) < Cu (s) < H2 (g)
D) Cl2 (g) < Fe3+(aq) < H2O2 (aq) Cu (s) < H2 (g) < Al (s)
il n° di coppie di elettroni totali di valenza,
il n° di coppie di legame,
il n° di coppie totali di non legame.
A) 24 3 9
B) 12 4 8
C) 12 3 9
D) 24 4 8

A) 181 pm
B) 108 pm
C) 127 pm
D) 157 pm
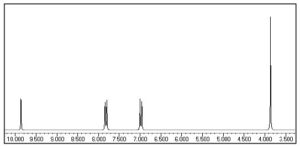
54. Indicare in quale regione dello spettro infrarosso di un composto organico si trovano gli stretching del legame C-H:
A) 1450-1315 cm‒1
B) 1600-1400 cm‒1
C) 3300-2700 cm‒1
D) 3600-3400 cm‒1
soluzione
La regione spettrale più importane per l’analisi qualitativa dei composti organici, è quella che va da 4000 cm-1 a 600 cm-1. In questa zona dello spettro abbiamo l’assorbimento dovuto alle vibrazioni fondamentali delle molecole organiche più comuni.
Un esempio di spettro con le zone di assorbimento è il seguente
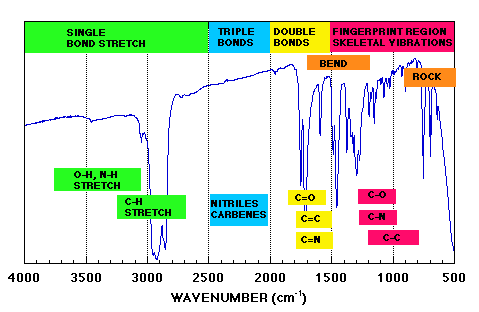
La zona delle vibrazioni fondamentali può essere suddivisa in due parti: la prima da 4100 a 1500 cm-1 sove assorbono i gruppi funzionali , la seconda da 1500 a 600 cm-1 detta zona fingerprinting . Al di sopra dei 3500 cm-1 e dei 600-100 cm-1 gli assorbimenti vengono raramente utilizzati per scopi analitici ed è caratteristica delle vibrazioni che coinvolgono i metalli. Per questi motivi gli strumenti più comuni coprono lo spettro di frequenze da 4000 cm-1 a 600 cm-1.
Da questa figura vediamo che nella zona fingerprinting vediamo che lo stretching del legame C-H cade tra 2700 e 3300 cm-1 quindi la risposta corretta al quesito è C
55. La concentrazione molare iniziale di una sostanza Y (1,386 M) si dimezza dopo 40,0 s di reazione, se la reazione segue una cinetica del primo ordine. La stessa concentrazione si dimezza in 20,0s, se segue una cinetica di ordine zero. Indicare il valore del rapporto fra le costanti di velocità k1/k0 (dove k1 è la costante di velocità per la reazione del primo ordine e k0 è la costante di velocità per la reazione di ordine zero)
A) 5,0 ∙10‒1
B) 1,0
C) 1,5
D) 2,0
soluzione
dobbiamo calcolare K per la reazione del primo e di ordine zero. Ricordiamo che per una reazione del primo ordine
T1/2 = 0,693 /k quindi K = 0,693/ 40 s = 0,0173
per una reazione di ordine zero se chiamiamo [A]o la concentrazione iniziale ed [A] la concentrazione dopo un certo tempo t in una reazione di ordine zero si ha:
[A] = [A]o – kt k è la costante di velocità.
Poiché il tempo di dimezzamento t1/2 è il tempo necessario perché la concentrazione iniziale di un reagente sia ridotta a metà
[A]= ½ [A]o sostituendo nell’equazione precedente ad [A] il valore ½ [A]o e indicando con t1/2 il tempo si ottiene:
½ [A]o = – kt1/2 + [A]o da cui: ½ [A]o = kt1/2
Pertanto t1/2 = [A]o/ 2k
t1/2 = [Conc.iniziale] / 2 k pertanto K0 = 1,386/2 x 20 = 0.03465
si deduce che il rapporto tra le due costanti di velocità è ki/Ko = 0,0173 / 0,03465 = 0,499 = 5 x 10-1
Risposta corretta A
56. Sulla base della teoria degli orbitali molecolari indicare, nell’ordine, il numero di elettroni spaiati e l’ordine di legame per lo ione superossido (O2‒).
A) 1 0,5
B) 1 1,5
C) 2 1
D) 2 2
soluzione
Gli orbitali molecolari delle forme di ossigeno sono:
Come si vede il numero di elettroni spaiati in O2- è 1 –
numero totale di elettroni = 8+8 + 1 =17
Numero totale di elettroni negli OM di legame = 10
Numero totale di elettroni negli OM di antilegame = 7
ordine di legame = 1/2 [ Numero elettroni di legame – Numero di elettroni di antilegame ]= 1/2 [ 10- 7 ]=1/2 ×3 = 1.5
risposta corretta B
57. Indicare quali, tra i seguenti reattivi, portano alla formazione di dioli partendo da un alchene.
I. OsO4
II. KMnO4 neutro, diluito, freddo
III. O3 seguito da trattamento con (CH3)2S
IV. Acido 3-nitroperbenzoico seguito da acqua e H+
A) I, II
B) I, III
C) I, II, III
D) I, II, IV
soluzione
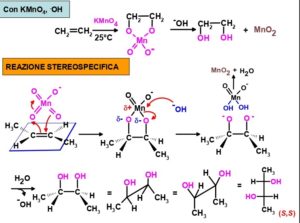
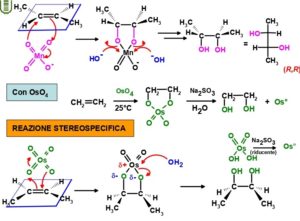
l’acido nitroperbenzoico forma i dioli con un meccanismo dei perossiacidi
Gli acidi perossicarbossilici sono più efficaci dei semplici perossidi, perchè reagiscono da una parte con un ossigeno parzialmente positivo che viene attaccato dal doppio legame, ma che poi deve perdere H+per rendere stabile l’epossido e all’altra con l’ossigeno del che riceve l’H+
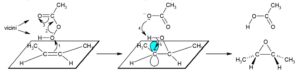
l’epossido viene idrolizzato in ambiente acido per formare il diolo.
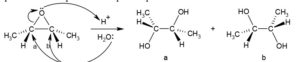
L’apertura dell’anello epossidico può ottenere mediante catalisi acida o basica. Qui è mostrata la reazione con catalisi acida . In questo caso mostrato in figura,essendo la molecola simmetrica,l’attacco può avvenire su entrambi i carboni. Con un epossido asimmetrico, l’attacco avviene preferenzialmente sul carbonio più sostituito sul quale vi è una maggior quantità di carica positiva quando l’epossido viene protonato.
La risposta corretta al quesito è D
58. Si immagini di aggiungere Pb(NO3)2 e NaCl a un definito volume di acqua fino ad ottenere, almeno teoricamente, una soluzione 5,0 ∙10‒2 M in Pb2+ e 1,0 ∙10‒1M in Cl‒ , a 25 °C. Indicare il valore del prodotto ionico (Qc quoziente della reazione con le concentrazioni iniziali) e se questo sale precipita (Kps di PbCl2 a 25 °C = 1,7 ∙10‒5).
A) Qc= 3,0 ∙10‒3 e si ha precipitazione
B) Qc = 5,0 ∙10‒4 e si ha precipitazione
C) Qc = 8,0 ∙10‒6 e non si ha precipitazione
D) Qc = 1,0 ∙10‒4 e si ha precipitazione
soluzione
Il prodotto ionico è [Pb+2][Cl-] = 5 x 10-2 x 1 x 10-1 = 5 x 10-3 che è superiore al Kps quindi si ha precipitazione del sale.
Risposta corretta B
59. Indicare il valore della f.e.m. della seguente cella elettrolitica che si trova a 25 °C:
Zn (s) / Zn2+ (1,00 ∙10‒5 M) // Cu2+ (0,100 M)/Cu (s)
A) 1,00 V
B) 1,22 V
C) 0,97 V
D) 0,89 V
soluzione
60. In laboratorio si effettua la seguente reazione:
2 AgCl (s) + Br2 (l) → 2 AgBr (s) + Cl2 (g)
Individuare l’energia standard di Gibbs della reazione (ΔG°) alla temperatura di lavoro, a partire dai seguenti dati di energia libera molare standard di formazione alla stessa temperatura:
ΔfGm°(AgCl) = -109,79 kJ mol‒1 ΔfGm°(AgBr) = -96,90 kJ mol‒1 :
A) 12,9 kJ
B) -25,8 kJ
C) -12,9 kJ
D) 25,8 kJ
soluzione
Sappiamo che ΔG° = ∑ΔG°prod – ∑ΔG°reag pertanto ΔG° = 2 x -96,9 + 0 – 2 x -109,79 = 219,58 -193,8 = 25,8 KJ/mol
Risposta corretta D














![\begin{psfrags} \psfrag{dummy}{} \psfrag{conductimeter}[c][c]{conduttimetro} \ps... ...h}{\flushright{}soluzione\\ test}} \includegraphics {cond-cell.eps}\end{psfrags}](http://www.dsch.univ.trieste.it/~balducci/lca1/appunti/appunti.old/html.d/img249.gif)

![{\displaystyle {\frac {1}{\left[A\right]}}-{\frac {1}{\left[A\right]_{0}}}=\mathrm {k} t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cea54114260d9db5864c04632cf83ff651df699)
Lascia un commento