GIOCHI DELLA CHIMICA REGIONALI 2011 CLASSE C
1. Se ad una soluzione acquosa di AgNO3 si aggiunge una soluzione acquosa di K2CrO4 (25 mL, 0,250 M), in difetto rispetto ad AgNO3, precipita al massimo una massa di Ag2CrO4 pari a:
A) 1,67 g
B) 2,07 g
C) 3,50 g
D) 27,0 g
Soluzione
le millimoli iniziali di K2CrO4 sono 25 x 0,250= 6,25 mmoli grammi di K2CrO4 =194,2 (PM) x0,00 625 = 1,2137 g
se da 1 mole di K2CrO4 si ottiene 1 mole di CrO4-2 da 0,00625 moli se ne ottengono X X= 0,00625 x 116= 0,725
se da 1 CrO4-2 si forma 1 di Ag2CrO4 allora 0,725 g di CrO4-2 formeranno X
116 : 331,7 = 0,725 :X X= 2,073 g
risposta corretta B
2. Il TiO2 è la carica bianca più usata nella produzione di vernici. La sua purificazione comporta una prima trasformazione del diossido impuro in TiCl4(g) secondo la reazione:
2 TiO2 + 3 C + 4 Cl2 →2 TiCl4 + CO2 + 2 CO
seguita da una reazione che converte TiCl4 in
TiO2 puro: TiCl4 + O2 →TiO2 + 2 Cl2
Indicare la massa di C necessaria per produrre 1 kg di TiO2 puro da TiO2 impuro.
A) 226 g
B) 113 g
C) 452 g
D) 65,0 g
soluzione
se TiO2 impuro si ottiene solo 1 TiO2 Puro pertanto da 1 Kg si ottiene 1 Kg di TiO2 puro
se per 2 TiO2 impuro servono 3 C per 1000 g ne servono X
159,8 : 36 = 1000 : X
X= 36 x 1000 / 159,8 = 226 g
risposta corretta A
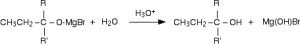
3. Indicare il prodotto della seguente reazione:
![]()
questa reazione è chiamata alchilazione di Friedel Crafts, il benzene reagisce con un alogenuro alchilico in presenza di FeCl3 (oppure AlCl3) un acido di Lewis,per formare un alchilbenzene. L’acido di Lewis strappa l’alogenuro formando un carbocatione che è un forte elettrofilo che attacca l’anello benzenico . Il carbocatione può essere solo primario secondario o terziario dato che i carbocationi vinilici e arilici sono instabili. I carbocationi hanno la tendenza a trasporsi ,(cioè da primari possono trasformarsi in secondari ed i secondari a terziari) .In questo caso, l’1-cloropropano forma un carbocatione con carica in posizione 1 quindi un carbocatione propilico primario, ma questo si traspone in carbocatione propilico secondario ( con carica sul C in posizione 2) . I due carbocationi attaccano il benzene con una reazione elettrofila e quindi si ottengono due alchilbenzeni.
Da quanto esposto è evidente che la reazione che avviene è la reazione 1
Risposta corretta A
4. Per salificare tutto l’acido acetico di una soluzione acquosa (1 L), si usano 0,64 mol di NaOH a 25 °C. Calcolare il pH iniziale della soluzione acida e quello dopo aggiunta della base:
A) 4,0 e 7,9
B) 2,5 e 9,3
C) 5,4 e 13
D) 2,5 e 7,0
soluzione
L’acido acetico CH3COOH è un acido debole e le moli di acido sono 0,64 in 1 litro di soluzione quindi Ca = 0,64 M
Il PH di un acido debole si ottiene dalla dissociazione dell’acido CH3COOH ⇔ CH3COO- + H+ Ka = [CH3COO-][ H+] / [CH3COOH]
quindi Ka = [H+]2 / [CH3COOH] Ka Ca = [H+]2
[H+] = √KaCa = √ 1,8 x 10-5 x 6 x 10-1 = √ 10,8 x 10-6 = 3,2 x 10-3
PH = 3 – log 3,2 = 3- 0,5 = 2,5
Poichè tutto l’acido è trasformato in sale, il PH che ne deriva è quello relativo all’idrolisi del sale .
La reazione di idrolisi dello ione acetato è:
CH3COO– + H2O ⇄ CH3COOH + OH–
Ki = [OH-]2 / [CH3COO-] ma [CH3COO-] = concentrazione del sale (Cs) e la Ki = Kw/ka pertanot
[OH-]2 = Kw/ka Cs [OH-] = √(Kw/Ka)Cs
[OH-]= √ (10-14/ 1,8 x 10-5 ) x 0,64 = √ (5,55 x 10-10 ) 0,64 = √ 3,55 x 10-10
[OH-] = 1,88 x 10-5 POH = 5- log 1,88 = 5 – 0,274 = 4,72
PH= 14-4,72 = 9,27 =9,3
risposta corretta B
5. Indicare l’affermazione ERRATA.
A) le misure conduttometriche sono specifiche per determinare il contenuto ionico delle soluzioni
B) la determinazione conduttometrica è particolarmente efficace per stabilire il grado di purezza di un’acqua per quanto riguarda il suo contenuto in sali
C) un grave inconveniente delle misure conduttometriche è che sono particolarmente sensibili alle sostanze organiche
D) nella titolazione conduttometrica dello ione cloruro, si usa come titolante una soluzione di AgNO3 che deve essere almeno 10 volte più concentrata di quella del cloruro da determinare
soluzione
La conduttometria è una tecnica di analisi elettrochimica che utilizza la conducibilità degli ioni presenti in una soluzione. Qualsiasi ione presenta una propria conducibilità e i due ioni che conducono di più in acqua sono H⁺ ed OH⁻. La conducibilità si ottiene attraverso una misura della resistenza di una soluzione applicando un tensione alternata alla cella di misura (se si usasse la corrente continua si verificherebbero processi elettrolitici all’interno del soluzione che potrebbero alterare il valore della resistenza).
La conduttività elettrica è uguale al reciproco del resistenza elettrica (che è anche chiamata conduttanza G) moltiplicata per la costante della cella c :
γ = 1/R x l /A = G x c
γ :conducibilità (S cm–1or S m–1)
R: resistenza (Ω (Ohm))
G: conduttanza (1/R), (S (Siemens) = Ω–1)
l:lunghezza del cammino della cella (cm or m)
A: Area (della sezione trasversale (cm2 or m2 )
c: costante della cella (l/A), ( cm–1or m–1)
La conducibilità di una soluzione dipende :
1- dal numero di ioni. (Più ioni contiene una soluzione, maggiore è la sua conduttività elettrica).
2- in generale dalla mobilità ionica, che a sua volta dipende da :
- 3.- dalla grandezza dello ione: più piccolo è uno ione, più è mobile è e meglio conduce. (ad es. gli ioni Idronio, idrossido, potassio e cloruro sono ottimi conduttori) . Se si verifica un’idratazione (lo ione si circonda di molecole di acqua che lo rendono più grande), allora la conducibilità diminuisce.
- 4- dalla polarità del solvente. I composti ionici. si dissociano più facilmente. L’acqua è un solvente ideale per composti ionici.Nel caso degli alcoli, il grado relativo di dissociazione diminuisce all’aumentare della lunghezza della catena (metanolo> etanolo> propanolo). Nei solventi organici non polari (ad esempio idrocarburi clorurati e non clorurati) praticamente la dissociazione non si verifica.
- 5-dalla temperatura: in contrasto con i solidi, nelle soluzioni la conducibilità aumenta man mano che la temperatura aumenta dall’1 … 9% per ° C, a seconda dello ione. ( In soluzioni come l’ acqua potabile che è un moderato conduttore, aumenta di circa il 2% / ° C).
- 6-dalla viscosità: all’aumentare della viscosità, ia mobilità ionica e quindi anche quella elettrica comporta una diminuzione della conducibilità.
Da quanto abbiamo detto, si osserva che le sostanze organiche (non polari) non possono influenzare le misure di conducibilità quindi la frase errata è la frase C
6. Data la reazione: 2 NO + O2 → 2 NO2 (a 298 K) per la quale si ha ΔH°298 = -114,1 kJ e ΔS°298 = -146,2 JK-1 individuare il ΔG°298:
A) -23,0 kJ
B) -43,7 kJ
C) +43,7 kJ
D) -70,5 kJ
soluzione
L’energia libera ( cioè l’energia disponibile affinchè il sistema possa produrre lavoro ) non è altro che l’energia entalpica privata di quella parte di energia (cosiddetta di natura entropica) che serve all’esistenza stessa del sistema ed è quindi inutilizzabile per compiere lavoro(TΔS)
La relazione che lega ΔG a ΔH e ΔS è pertanto:
ΔG = ΔH – TΔS
ora tutto ciò che dobbiamo fare è inserire i dati numerici ricordandoci di convertire ΔS in modo che sia espresso nelle stesse unità di ΔH.
Δ S = -146,2 J/K x (1 KJ /1000) = -0,1462 kJ/K
∆G= -114,1 kJ – (298 K )(-0.1462 kJ/K) = -114,1kJ + 43,567 kJ
∆G= – 70,5 kJ
risposta corretta D
7. Indicare se una massa di PbSO4 di 0,0330 g si scioglie in 1,00 L di H2O a 25 °C e, qualora non si sciolga, indicare il volume minimo di acqua necessaria per sciogliere il sale a 25 °C. Si consideri il volume della soluzione eguale a quello dell’acqua:
A) si scioglie
B) non si scioglie; 8,10 L
C) non si scioglie; 3,00 L
D) non si scioglie; 4,05 L
soluzione
Sapendo che il Kps del solfato di piombo(II) è 1,8 x 10-8
Kps = [Pb2+]×[SO42-] =1,8 x 10-8
è possibile determinare la solubilità del solfato di piombo(II); poiché essa risulta espressa in mol/L, è sufficiente calcolare a quante moli di solfato di piombo corrisponde la massa di 0,330 g per risalire al volume in cui esse possono sciogliersi.Indicando con s la solubilità di Pb+2 e SO4-2si può scrivere:
[Pb2+]×[SO42-] =1,8 x 10-8 = s x s = 1,8 x 10-8
s2 = 1,8 ×10-8 s = 1,34 x 10-4 moli /l
Il quesito ci dice che le moli di PbSO4 in 1 litro di acqua sono 0,330 / 303,26 =0.001088 moli, quindi
dal dato di solubilità s calcolato, sappiamo che in 1 litro si sciolgono 1,34 x 10-4 moli quindi in x litri si sciolgono 0,00188 moli
1L : 1,34 x 10-4 moli = X : 0,00188 moli X= volume necessario per sciogliere il sale è
V= X= (1,34 x 10-4 ) x ( : 0,00188 ) moli / 1L = 8,12 L
quindi V = 8,12 litri
risposta corretta B
8. Nella seguente reazione si formano:
CH2= CH -CH =CH2 + Br2 (in CCl4)
si formano:
A) 4 prodotti con tutte le proprietà chimiche e fisiche diverse
B) 4 prodotti due dei quali con eguali proprietà chimiche e fisiche, a parte una (fisica)
C) 2 prodotti con tutte le proprietà chimiche e fisiche diverse e 2 con proprietà tutte uguali
D) 3 prodotti con tutte le proprietà chimiche e fisiche diverse
soluzione
I doppi legami sono detti cumulati se sono consecutivi, coniugati se sono separati da un legame singolo. L’1-3 butadiene è quindi un DIENE con legami coniugati. Come tutti i doppi legami va incontro a reazioni di somma. L’addizione di Br2 ad un diene avviene sia con attacco 1,2 che 1,4 in proporzioni diverse a seconda della temperatura. Si formano i seguenti 4 composti. I primi due sono enantiomeri.
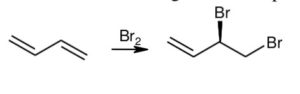
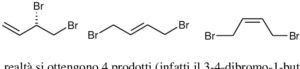
Solo gli ultimi due hanno isomeria cis trans e hanno proprietà diverse.I primi due sono enantiomeri (R il primo, S il secondo) e hanno le stesse proprietà chimiche e fisiche ad eccezione di quelle in cui interagiscono con altre sostanze chirali. Gli altri due sono diversi.
Risposta corretta B
9. Indicare l’affermazione ERRATA a proposito degli amminoacidi naturali:
A) sono tutti alfa amino acidi
B) a valori di pH < 2, sia il gruppo amminico che quello carbossilico sono protonati
C) sono tutti, a parte la glicina, della serie sterica L, ovvero sono levogiri
D) ognuno ha un punto isoelettrico caratteristico
soluzione
Gli amminoacidi si definiscono alfa quando il gruppo amminico ed il gruppo carbossilico sono legati allo stesso atomo di C detto Carbonio alfa.
Le affermazioni A,B, D sono corrette
A In natura tutti gli amminoacidi sono L-alfa amminoacidi
B ad un pH<2 essendo ambiente abbastanza acido (H+) sia NH3 che COO- sono protonati
D ogni amminoacido ha un suo punto isoelettrico cioè il valore di pH al quale una molecola presenta carica elettrica netta nulla.
C la glicina non è ne levogira ne destrogira,perchè non è chirale… non ha rotazione ottica ma gli altri non sono tutti con configurazione L , infatti esistono anche aminoacidi D ma la specie umana utilizza solo amminoacidi L (i batteri utilizzano gli amminoacidi D)
risposta ERRRATA C
10. Indicare l’affermazione ERRATA a proposito di un tampone:
A) un tampone contrasta le variazioni di pH intervenendo a seconda del caso sull’acido o sulla base aggiunta
B) man mano che si va verso l’esaurimento, il suo potere tampone diviene minore
C) la minima efficienza di un tampone si ha quando pH = pKa
D) un tampone si ottiene mescolando un acido e la sua base coniugata, funziona meglio se in quantità circa uguali e comunque non inferiori a 0,1 M
soluzione
le risposte A,B,D sono corrette mentre la risposta C è errata in quanto in genere si utilizza un tampone il cui PKa è vicino al valore di PH da tamponare e l’ideale è quando PH= PKa. Infatti per un tampone acido debole base forte PH = PKa -log Ca/Cs e se si usano concentrazioni uguali Ca=Cs allora PH = PKa
11. Si consideri la reazione:
H2 + N2 → NH3 da bilanciare,
e si indichi, nell’ordine, se a 25 °C essa è spontanea verso destra e il valore della sua T di equilibrio se ΔH = -11000 cal; ΔS = -23,6 cal K-1 (entrambe valide anche alla T di equilibrio).
A) a 25 °C non è spontanea ; Teq = 466 K
B) a 25 °C non è spontanea ; Teq = 466 °C
C) a 25 °C è spontanea ; Teq = 466 °C
D) a 25 °C è spontanea ; Teq = 193 °C
soluzione
sappiamo che per conoscere se una reazione è spontanea o meno oppure è all’equilibrio si ricorre alla definizione di ΔG
ΔG = ΔH -T ΔS
ΔG = -11000cal -( 273+25) x -23,6 cal
ΔG = -11000 -298 x -23,6= -11000 + 7032.8 = -3967.2 cal
questo valore negativo significa che la reazione è spontanea.
Per calcolare la T di equilibrio ricordiamo che si ha l’equilibrio se ΔG = 0 pertanto ΔH = T ΔS
11000 = T 23,6 da cui Teq = 466,1 K = 466-273 = 193,1 °C
risposta corretta D
12- Indicare nell’ordine il segno di ΔH ° e ΔS° per i seguenti due processi:
H2 O(g) → H2 O(l)
C2H2(g) + 5/2 O2 (g) → 2 CO2(g) + H2O(g)
A) ΔH° > 0; ΔS° < 0; ΔH° < 0;Δ S° < 0
B)Δ H° < 0; ΔS° > 0; ΔH° < 0;Δ S° < 0
C)Δ H° < 0; ΔS° < 0; ΔH° < 0; ΔS° < 0
D)Δ H° < 0; ΔS° < 0; ΔH° > 0; ΔS° > 0
soluzione
nel primo caso la reazione è orientata verso il prodotto quindi ΔH° < 0; e siccome ΔS° = ΔH° / T allora ΔS° = < 0
Nella seconda reazione è anch’essa orientata verso destra ed anche in questo caso ΔH° < 0; e siccome ΔS° = ΔH° / T allora ΔS° = < 0
questo significa che la risposta corretta è C
13. Indicare l’affermazione ERRATA:
A) lo iodio sublimato non si usa come standard primario perché non sufficientemente puro
B) le soluzioni acide di I3- preparate sciogliendo I2 in un eccesso di KI, sono instabili perché l’eccesso di I viene lentamente ossidato dall’aria, aumentando il titolo
C) un’eccellente procedura per preparare una soluzione di I3- consiste nell’aggiunta di una quantità di iodato di potassio puro a un eccesso di KI e a un eccesso di acido forte
D) in soluzione neutra o acida, il triioduro ossida il tiosolfato a tetrationato
soluzione
Lo iodio I2 è uno standard primario, una sostanza madre, che può essere facilmente ottenuta con un alto grado di purezza. Lo iodio viene utilizzato come ossidante per titolare sostanze riducenti (sostanze che cedono elettroni agli ossidanti). C’è un piccolo problema però. Lo iodio I2 è molto volatile. Lo iodio è infatti un elemento del settimo (14) gruppo (alogeni) e come tale si trova in natura come molecola biatomica. Lo iodio è molto pesante, e per questa ragione lo troviamo allo stato solido, ma è un solido molecolare, quindi con interazioni secondarie debolissime. Lo iodio quindi praticamente non esiste allo stato liquido, è un solido con grande tendenza a sublimare. La sublimazione in particolare è un ottimo modo per purificare, dato che le impurità non hanno la stessa tendenza a sublimare. A dispetto di questa facilitazione è veramente difficile preparare soluzioni standard con lo iodio, proprio per la stessa tendenza. Ma ci sono dei modi di ovviare a questa difficoltà, per esempio utilizzando soluzioni che contengano lo ione I– , come ad esempio un sale,KI. Quando aggiungo I2 ad una soluzione contenente I– ottengo , triioduro. Lo ione complesso triioduro finalmente è stabile in soluzione. Quindi in gran parte dei casi quando si fa riferimento all’utilizzo di Iodio molecolare come titolante in realtà si fa riferimento ad una soluzione di I2 con un eccesso di I–.
Quindi non si usa come standard primario non perchè non sia sufficientemente puro ma perchè sublima ed è difficile utilizzarlo come I2.
La risposta errata è quindi A
14. Indicare il potenziale a 25 °C della seguente pila:
Pt/Fe2+ (0,10 M), Fe3+ (0,20 M) //Ag+ (1,0 M) /Ag(s):
A) 0,029 V
B) 0,011 V
C) 0,022 V
D) 0,044 V
soluzione
La reazione che si osserva nell’elettrodo ad argento (catodo cioè dove si ha la reazione di riduzione ) è :
Ag+ + e → Ag il cui potenziale è E= E° +0,0591 /1 log [Ag+] E= E° +0,0591 log 1 = E°= 0,7994 V
la reazione che si osserva nell’elettrodo di Fe (anodo dove si ha la reazione di ossidazione) è:
Fe+2 –> Fe+3 + e il cui potenziale è E=E°+0,0591/1 log [ fe+3]/[Fe+2]
E= E° +0,0591log 0,2/ 0,1 = E° + 0,0591 log 2 = 0,771 + 0,0591 x 0,301 = 0,771 + 0,01778=- 0,7888 V
la Fem di questa pila è quindi Ecatodo – E anodo = 0,7994 V – 0,7888 V = 0,0106= 0,011 V
risposta corretta B
15. In soluzione neutra, la reazione di I3- con tiosolfato porta alla formazione di:
A) Na2S4O6 e I-
B) Na2S2O3 e IO3–
C) NaS4O5 e I-
D) Na2S3O4 e I-
soluzione
la titolazione che utilizza una soluzione standardizzata di tiosolfato di sodio quale titolante viene chiamata iodometria ed è usata per determinare la concentrazione di agenti ossidanti mediante un procedimento indiretto che implica lo iodio come intermedio; infatti,in presenza di iodio, lo ione tiosolfato si ossida quantitativamente a ione tetrationato.
Per determinare la concentrazione degli agenti ossidanti viene aggiunto all’interno della soluzione un eccesso non misurato di una soluzione di ioduro di potassio. Lo iodio I2 liberato stechiometricamente da I3-, a seguito della riduzione dell’analita, è poi titolato con una soluzione standard di tiosolfato di sodio (Na2S2O3). Le titolazioni che coinvolgono lo iodio vengono eseguite con una sospensione di salda d’amido come indicatore. La salda d’amido è una soluzione acquosa di amido addizionata di una piccola quantità di battericida, in maniera tale da evitare la decomposizione che può interferire con le proprietà di indicatore. A seguito del legame tra lo iodio (I2) e la catena elicoidale del β-amilosio si sviluppa una colorazione blu intensa.
- Le soluzioni di iodio debbono essere impiegate a pH < 8,5 in quanto a pH basico lo iodio disproporziona (, nella quale lo iodio in parte si ossida ed in parte si riduce);
- L’ossidazione del tiosolfato sodico a tetrationato avviene in ambiente neutro o debolmente acido (in soluzione alcalina avverrebbe l’ossidazione a solfato mentre In ambiente fortemente acido il tiosolfato si decompone a S2);
- Lo iodio forma I- secondo la reazione
I3– + 2e– ↔ 3I–
I3– = ione triioduro (Per aumentare la solubilità dello iodio in acqua è necessario aggiungere lo ione ioduro che forma il triioduro complesso).
Le soluzioni di iodio standard hanno un’applicazione relativamente limitata in confronto agli altri ossidanti a causa del piccolo potenziale elettrodico. Talvolta questa caratteristica della coppia I3– /I– si rivela vantaggiosa poiché impartisce un grado di selettività che rende possibile la determinazione di forti agenti riducenti in presenza di quelli deboli.
16. Indicare, dopo aver verificato, con un calcolo teorico, il suo potenziale a 25 °C, se la reazione:
Sn(s) + Pb2+(1,0·10–3 M) → Pb(s) + Sn2+(0,50 M)
é spontanea o no, nel verso e nelle condizioni indicati.
A) E = -0,066 V; reazione non spontanea
B) E = +0,066 V; reazione non spontanea
C) E = -0,066 V; reazione spontanea
D) E = -0,033 V; reazione spontanea
soluzione
I potenziali Redox sono:
E° Sn 2+ /Sn = ‒0,14 V. E = E° + 0,059/2 log Sn 2+ = ‒0,14 + 0,059/2 log 0,5 = ‒0,1489 V
E° Pb 2+ /Pb = ‒0,126 V. E = E° + 0,059/2 log Pb 2+ = ‒0,126 + 0,059/2 log 10 ‒3 = ‒0,2145 V
∆E = E Pb ‒ E Sn = ‒0,2145 + 0,1489 = ‒0,0656 V. La reazione non è spontanea. La specie con potenziale di riduzione maggiore (‒0,1489: Sn 2+ ) si riduce, la reazione va a sinistra.
La risposta corretta è A
17. Un campione di 25,00 mL di H2O, contenente come solo catione lo ione Ca2+, è fatto passare attraverso una colonna a scambio ionico in forma acida HR. Se l’acqua che esce dalla colonna ha richiesto 7,59 mL NaOH 0,0133 M, per la sua perfetta titolazione, si può dedurre che la durezza dell’acqua in ppm di Ca2+ è:
A) 80,80 ppm
B) 161,6 ppm
C) 40,40 ppm
D) 0,133 ppm
soluzione
V1 x M1 = V2 x M2
da cui M2= V1 x M1/V2 sostitutendo i valori numerici 7,59 x 0,0133 / 25 = 0,00404 M
tuttavia la resina a scambio ionico per uno ione bivalente scambia 2H quindi ciò che abbiamo calcolato era relativo a 2 H pertanto il Ca++ è la metà dell’H calcolato cioè
Ca++= 0,00404/2 = 0,00202 moli
0,00202 x 40 = 0,00808 g per 1000 g H2O quindi 80,8 ppm
risposta corretta A
18. Si sa che l’errore assoluto (totale della misure ) in una titolazione se si usa una buretta da 25 mL (Bu25), è 0,08 mL; mentre con una buretta da 50 mL (Bu50) l’errore assoluto è 0,150 mL. Se si esegue una titolazione in cui vengono impiegati 20 mLdi soluzione, l’errore relativo con le due burette è:
A) 0,70% (B25); 0,40% (B50).
B) 0,40% (B25); 0,75% (B50).
C) 0,32% (B25); 0,60% (B50).
D) 0,64% (B25); 1,20% (B50).
soluzione
Si indica come errore assoluto di una misura , e si indica con Ea la differenza tra il valore teorico della misura effettuata e il valore effettivamente misurato: questo dà un’idea di quanto i dati raccolti si discostino dal valore che si vuole misurare. In questo modo, ogni misurazione può essere indicata con
Ea = Valore medio – quantità misurata
essendo il valore medio il valore più vicino al valore teorico ( se le misure sono numerose)
(quantitaˋ misurata )=Xm ± Ea
Quindi, tanto è più piccolo l’errore assoluto, tanto più precisa sarà la misurazione.
Col termine errore relativo, indicato con , si indica il rapporto tra errore assoluto e la media delle misurazioni:
Er = Ea/ valore medio
Per una buretta di 25 ml se si misura un valore di 20 ml si ha
20 = 20 ± 0,08
per una da 50 ml
20 = 20± 0,150
l’errore relativo è Ea/ media quindi
Er (Bu25) = 0,08 /20 = 0,04 = 0,4%
Er(bu50) = 0,150 / 20 = 0,0075 =0,75%
Risposta corretta B
19. Si immagini di effettuare le titolazioni dell’esercizio precedente impiegando 40 mL di soluzione e usando prima la Bu25, riempiendola due volte, e poi la Bu50, riempiendola una sola volta. Si indichino gli errori relativi alle due titolazioni:
A) 0,20% (B25); 0,52% (B50)
B) 0,40% (B25); 0,38% (B50)
C) 0,80% (B25); 0,36% (B50)
D) 0,45% (B25); 0,74% (B50)
soluzione
per quanto indicato nel problema precedente nella buretta da 25 ogni 20 ml utilizzati l’errore è 0,40% quindi siccome la buretta viene utilizzata 2 volte l’errore è
Er(bu25) =0,08 x 2/40 =0,004 = 0,40% e per la buretta Bu(50)ml
Er(Bu50 )= 0,150/40 =0,38 %
Risposta corretta B
20. Indicare l’affermazione ERRATA.
Un dispositivo per titolazioni potenziometriche:
A) permette di effettuare reazioni di neutralizzazione, redox, di precipitazione e di complessazione
B) è costituito da un elettrodo indicatore, un elettrodo di riferimento, un agitatore, una buretta e un voltmetro elettronico
C) ha un elettrodo indicatore a potenziale costante
D) nelle reazioni di neutralizzazione, permette di ottenere una curva di titolazione perfettamente analoga a quella ottenuta per via chimica con gli indicatori
soluzione
E’ evidente che l’affermazione errata è C in quanto un elettrodo indicatore non può avere un valore costante in quanto deve variare al variare dell’attivita’ dello ione che scambia elettroni nel corso della reazione elettrodica (elettrodo di prima specie). Gli elettrodi indicatori di seconda specie, invece, rispondono all’attivita’ di ioni il cui stato di ossidazione non cambia durante la reazione elettrodica. Un esempio di elettrodo di seconda specie e’ l’elettrodo Ag/AgCl che viene utilizzato anche come elettrodo indicatore sensibile all’attivita’ degli ioni ![]() infatti E=E° – RT/F log [Cl-] .Quando questo elettrodo viene usato come elettrodo di riferimento lo si immerge in una soluzione a conc. nota di Cl- ed il suo potenziale rimane costante.
infatti E=E° – RT/F log [Cl-] .Quando questo elettrodo viene usato come elettrodo di riferimento lo si immerge in una soluzione a conc. nota di Cl- ed il suo potenziale rimane costante.
21. Indicare l’affermazione ERRATA:
Le particelle alfa:
A) sono identiche ai nuclei di elio 2 4He2+
B) quando attraversano la materia danno luogo a un grande numero di ioni
C) non sono deviate da campi elettrici e magnetici
D) per perdita provocano una diminuzione di 2 unità del numero atomico e di 4 unità nella massa atomica del nuclide
soluzione
E’ anche quì evidente che l’affermazione errata è la C in quanto la particella alfa , essendo dotata di carica viene deviata da campi elettrici e magnetici (ricorda l’esperimento di Rutherford in cui il Nucleo fa deviare le particelle alfa essendo esso carico positivamente)
22. Tra gli ossoacidi del fluoro: HFO e HFO2 e quelli del cloro: HClO e HClO2, indicarne, nell’ordine, uno con una carica formale positiva e uno con cariche formali nulle:
A) HFO2 e HClO
B) HClO e HFO2
C) HFO e HClO2
D) HFO2 e HClO2
soluzione
La carica formale (FC) è la carica assegnata ad un atomo in una molecola, assumendo che gli elettroni di legame siano equamente condivisi tra gli atomi indipendentemente dalla loro elettronegatività. Essa può essere utile per stabilire quale fra le strutture meglio rappresenta i legami della molecola e per poter prevedere la reattività.I in base a ciò si calcola da :
CF = numero elettroni di valenza atomo neutro – numero di elettroni di non legame – 1/2 numero elettroni legame
in HFO2 il Fluoro possiede 7 elettroni di valenza nessun elettrone di non legame e 1/2 x10 elettroni di legame CF= 7-5=2
in HClO : l’ H ha 1 elettrone di valenza ,zero elettroni di non legame e 2/2 =1 elettroni di legame CFdi H = 0
L’O ha 6 elettroni di valenza 2 coppie (4 elettroni) di non legame e 2 elettroni di legame essendo H-O-Cl CF=0
Cl ha 7 elettroni di valenza 6 elettroni di non legame e 2/2 elettroni di legame CF= 0
In HClO tutti gli atomi hanno carica formale zero pertanto
In HClO2 si ha la struttura O=Cl-O-H
CF H = 1 elettrone di valenza- 0 elettroni di non legame – 2/2 =1 elettroni di legame = 0 CFH=0
CF Cl = 7 elettroni di valenza – 4 elettroni di non legame -6/2=3 elettroni di legame = 0 CFCl=0
CF O = 6 elettroni di valenza – 4 elettroni di non legame – 4/2 elettroni di legame
CF del secondo ossigeno = 6 elettroni di valenza – 4 elettroni di non legame – 4/2 =2 di legame
CF H = 0
La risposta corretta è sia A che D
23. Indicare l’affermazione ERRATA.
Le particelle b-
A) sono deflesse da un campo magnetico in direzione opposta alle particelle alfa
B) nel caso più semplice si formano con un processo di decadimento di un neutrone libero instabile al di fuori di un nucleo atomico
C) hanno una carica -1 che nelle equazioni nucleari corrisponde a un numero atomico -1
D) sono dette anche neutrini
soluzione
Quando il nucleo ha una quantità in eccesso di neutroni, viene espulso un elettrone dall’atomo. L’emissione di una particella con carica negativa dà origine alla radiazione beta negativa ( β– ). Dopo l’emissione dell’elettrone ( particella β– ) nel nucleo atomico un neutrone si trasforma in protone.Questo processo è definito Decadimento Beta. Alla fine del processo di decadimento il numero atomico (Z ) dell’atomo è aumentato di un’unità mentre il numero di massa ( A ) è rimane uguale.
Le risposte A,B e C sono quindi corrette mentre quella errata è la D perchè la particella beta ha carica negativa e quindi non può essere un neutrino perchè neutrino indica una particella non carica.
24. Indicare l’affermazione ERRATA.
Il reattivo analitico dimetilgliossima (DMG) :
A) è un legante bidentato
B) forma complessi 2 : 1 col Ni(II) (2 DMG : Ni2+)
C) forma col Ni(II) in soluzione acquosa un complesso planare quadrato
D) forma col Ni(II) un complesso di colore azzurro chiaro poco solubile in acqua
soluzione
La dimetilgliossima è un reattivo organico avente la seguente formula:

come si può notare è un reattivo bidentato (attraverso i 2 atomi di N ) quindi l’affermazione A è corretta
Trova impiego nell’analisi qualitativa e quantitativa ( gravimetrica) del Nikel dato che con esso forma un complesso insolubile color rosa fucsia secondo la reazione:
Ni2+ + 2 H2C4H6N2O2 → 2 H+ + Ni(HC4H6N2O2)2 (s) il rapporto DMG/Ni =2/1 quindi l’affermazione B è corretta
Forma un complesso planare quadrato
quindi la risposta C è corretta.
La risposta errata è D in quanto abbiamo detto che il complesso ha colore rosa fucsia e non azzurro.
25. Il complesso ottaedrico ad alto spin che lo ione Co2+ forma con l’acqua:
A) non assorbe nel visibile
B) ha 1 elettrone spaiato
C) ha 3 elettroni spaiati
D) è diamagnetico
soluzione
Il complesso è [Co(H2O)6]+2 ad alto spin come si vede per gli ioni seguenti
Il complesso dello ione Co2+ ha forma ottaedrica e negli orbitali d vi si trovano sette elettroni che si dispongono in due modi diversi negli orbitali formando una struttura a basso spin ed una ad alto spin.
La struttura del cobalto Co+3 e Co+2 ad alto e basso spin sono indicate sopra. Da queste si osserva che nel complesso di Co+2 a basso spin vi è un solo elettrone spaiato mentre nel complesso ad alto spin vi sono 3 elettroni spaiati. Per i complessi di Co+3 possiamo invece vedere che vi sono 4 elettroni spaiati nel complesso ad alto spin e nessuno nei complessi a basso spin.
la risposta corretta è C
26. Individuare il prodotto finale della sequenza di reazioni indicata di seguito:
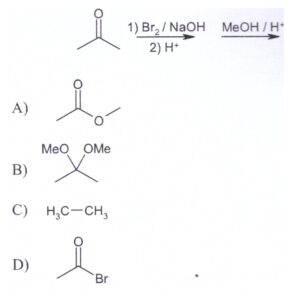
soluzione
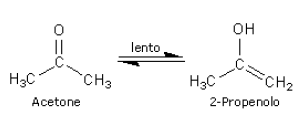
Il bromo reagisce col doppio legame (il bromo non deve essere in eccesso perché si potrebbe verificare un’esplosione)
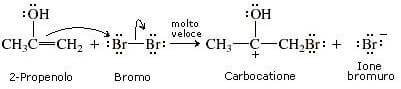
il carbocatione che si forma è stabile per risonanza :
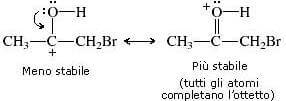
si ha successivamente la deprotonazione che porta all’alfa alochetone :
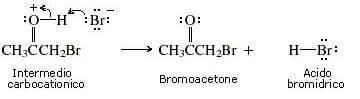
A questo punto il carbonio in alfa si alogena tre volte ed a questo punto si ha l’attacco di OH ‒ sul carbonile: lo ione OH–, agendo da nucleofilo attacca il carbonio carbonilico con conseguente rottura del doppio legame carbonio-ossigeno e formazione di una carica negativa sull’ossigeno e produce acetato. La reazione successiva con Metanolo porta alla formazione dell’estere.
Si forma quindi il prodotto A
27. Indicare l’affermazione ERRATA in chimica analitica:
A) nelle titolazioni le dimensioni di una buretta vanno scelte in relazione alla quantità di titolante da usare per contenere l’errore relativo percentuale
B) nelle titolazioni le dimensioni di una buretta vanno scelte in relazione alla quantità di titolante da usare per contenere l’errore assoluto ma non l’errore relativo percentuale che è indipendente dalle dimensioni della buretta
C) la pesata di campioni piccoli con una stessa bilancia analitica comporta un errore relativo maggiore che non la pesata di un campione grande
D) l’uso di volumi opportuni per la diluizione di campioni comporta errori generalmente minori di quelli connessi all’uso di una bilancia non adeguata alle basse quantità
soluzione
L’affermazione A è corretta così come le affermazioni C e D, ed è evidente che quella B è errata perchè anche l’errore relativo percentuale viene contenuto.
28. Indicare, tra i seguenti fattori: natura dei reagenti, concentrazione dei reagenti, temperatura, presenza di catalizzatori, pH del solvente, dimensione delle polveri, entalpia dei reagenti, quelli che fanno variare la velocità di una reazione:
A) temperatura, presenza di catalizzatori, pH del solvente, dimensione delle polveri, entalpia dei reagenti
B) temperatura, presenza di catalizzatori, pH del solvente
C) temperatura, presenza di catalizzatori, pH del solvente, dimensione delle polveri
D) natura e concentrazione dei reagenti, temperatura, presenza di catalizzatore
soluzione
La velocità di reazione dipende dal tipo di reagente e dalla sua concentrazione oltre ovviamente alla temperatura e dalla presenza o meno di un catalizzatore.
Risposta corretta D
29. La comune candeggina è una soluzione basica di un sale di un acido del cloro.
A) il sale, un ipoclorito, è un ossidante in quanto il cloro passa da N.O. = +1 a N.O. -1 (cloruro)
B) il sale, un clorito, è un ossidante in quanto il cloro passa da N.O. = +3 a N.O. = 0 (cloro)
C) il sale, un clorato, è un ossidante in quanto il cloro passa da N.O. = +5 a N.O. -1 (cloruro)
D) il sale, un ipoclorito, è un riducente in quanto il cloro passa da N.O. = +1 a N.O. -1 (cloruro)
soluzione
La candeggina ha formula NaClO (ipoclorito di sodio) è un ossidante e come tale necessariamente si riduce nella reazione secondo la semireazione
ClO- + 2H+ +2e –> Cl- +H2O
la risposta corretta è A
30. Indicare la lunghezza d’onda associata a un fascio di elettroni che viaggiano a un decimo della velocità della luce
(massa elettrone) = 9,109 ∙10-31 kg, costante di Planck = 6,626 ∙10-34 kg m2s-1):
A) 2,420 pm
B) 3,000 pm
C) 24,20 pm
D) 1,300 pm
soluzione
la relazione tra momento dell’elettrone è quella di De Brogliè
λ = h/mv = 6,626 ∙10-34 m2/s / 9,109 ∙10-31 x 299792458 m/s
λ = 6,626 ∙10-34 m2/s / 2,73 x 10-23 m/s
λ =2.427x 10-11 m essendo 1 m = 1 x 1012 picometri
λ =24,27 pm
risposta esatta C
31. Indicare l’affermazione ERRATA:
A) le energie di ionizzazione degli elementi diminuiscono all’aumentare del loro raggio atomico
B) l’andamento lungo un periodo dell’energia di ionizzazione è sempre di aumento
C) l’affinità elettronica (in kJ/mol) misura la variazione di energia che si verifica quando una mole di atomi gassosi di un elemento acquista un elettrone per atomo
D) l’energia di ionizzazione degli alogeni è relativamente maggiore (in valore assoluto e segno) di quella degli altri elementi
soluzione
I valori di Energia di prima ionizzazione per il secondo periodo sono:
| Li 5,39172 |
Be 9,32263 |
B 8,29803 |
C 11,26030 |
N 14,53414 |
O 13,61806 |
F 17,42282 |
Ne 21,56454 |
||
e quelli del terzo periodo sono:
| Na 5,13908 |
Mg 7,64624 |
Al 5,98577 |
Si 8,15169 |
P 10,48669 |
S 10,36001 |
Cl 12,96764 |
Ar 15,759 |
||
quelli del quarto periodo sono:
| K 4,34066 |
Ca 6,11316 |
Ga 5,99930 |
Ge 7,899 |
As 9,8152 |
Se 9,75238 |
Br 11,81381 |
Kr 13,99961 |
||
da questi dati si evince che in un periodo l’ EI1 non aumenta in tutto il periodo ma vi sono alcune eccezioni ,. La risposta D sarebbe corretta se si escludessero i gas nobili ma questi invece hanno EI maggiore degli alogeni. Quindi si può ritenere anche la risposta D errata.
Si deduce che la risposta errata è B
32. Indicare l’affermazione ERRATA:
A) in un atomo o ione diamagnetico, tutti gli elettroni sono accoppiati e gli effetti magnetici di ciascuno di essi si annullano reciprocamente
B) una specie diamagnetica (es. Ag, Cu, Hg) viene debolmente respinta da un campo magnetico
C) un atomo o uno ione paramagnetico possiede elettroni disaccoppiati e i loro effetti magnetici non si annullano tra loro (es. Al, Pd, O)
D) per distinguere una sostanza diamagnetica da una paramagnetica basta pesarle in presenza di un campo magnetico sotterraneo: quella diamagnetica pesa di più
soluzione
un atomo isolato, quando possiede uno o più elettroni spaiati possiede anche un momento elettronico permanente che è la risultante del momento magnetico di spin e di quello orbitale e si comporta come un piccolissimo dipolo magnetico. La presenza di elettroni spaiati nel livello più esterno determinano la presenza di un momento di spin. Una sostanza paramagnetica possiede una serie di infinitesimi dipoli reciprocamente statisticamente orientati in assenza di un campo magnetico esterno.Un campo magnetico esterno non ha alcun influsso, sul momento magnetico di ciascuno di questi dipoli, ma solo sulla loro reciproca orientazione e, quindi, sul momento risultante della sostanza. Il momento magnetico che un atomo possiede non è originato da un campo magnetico esterno, ma quando la sostanza paramagnetica è posta in un campo magnetico esterno questi rivela la presenza di un momento macroscopico non nullo della sostanza paramegnetica.
Da quanto detto la risposta al quesito è D
33. Se si considera la reazione:
Cl2(g) + 2 I-(aq) –>2 Cl-(aq) + I2(s)
si può concludere che essa avviene perché:
A) il Cl è più elettronegativo dello iodio (ha Eae più negativa e maggiore in valore assoluto)
B) il Cl è meno elettronegativo dello iodio (ha Eae più negativa anche se maggiore in valore assoluto)
C) il cloro è più riducente dello iodio
D) la reazione è esotermica
soluzione
Quando due atomi di differente natura sono uniti da un legame chimico (che è costituito da 2 elettroni) si osserva che uno dei due atomi manifesta una certa capacità di attrazione nei confronti degli elettroni del legame. Questa tendenza ada attrarre verso di se gli elettroni viene chiamata elettronegatività. Nel 1932 Linus Pauling fu il primo a proporre una scala di elettronegatività degli atomi partendo dai valori di energia di ionizzazione ove i valori di energia di dissociazione del legame Ed per A–B, A–A e B–B sono espressi in elettronivolt e il fattore (eV)−1⁄2 serve a ottenere un valore senza dimensioni.
.L’idrogeno fu scelto come riferimento, dato che forma legami covalenti con moltissimi elementi; il suo valore di elettronegatività fu dapprima fissato a 2,1 ed In seguito Allred aggiornò i valori dell’elettronegatività di Pauling, ponendo il valore per l’idrogeno a 2,20.
In questa tabella di valori il Cloro possiede un’elettronegatività pari a 3 mentre lo iodio ha elettronegatività pari a 2,5 . Si deduce quindi che la risposta corretta è A
34. Si ha a disposizione una comune bilancia con precisione ± 0,2 mg e si voglia pesare una sostanza usando un crogiolo come contenitore (ovvero facendo una pesata per differenza). Indicare gli errori percentuali rispettivi quando si pesano 20 mg e 200 mg. Sapendo che per la pesata di un campione da sottoporre ad analisi si richiede una precisione di almeno lo 0,1%, indicare la pesata minima da effettuare su tale bilancia.
A) 0,2%; 2%; 100 mg
B) 1%; 0,1%; 200 mg
C) 1%; 0,1%; 100 mg
D) 2%; 0,2%; 400 mg
soluzione
La precisione della bilancia è ±0,2 mg quindi se pesiamo 20 mg l’incertezza su questa pesata 20± 0,2 mg e quindi l’errore relativo è 0,2 mg/20mg= 0,01 cioè 1% . Se pesiamo 200 mg avremo un errore relativo di 0,2/200 = 0,001 cioè 0,1 %
se la precisione deve essere 0,1 % significa che il valore misurato oscilla tra 100 ± 0,1 quindi l’incertezza è 0,1/100 = 0,001 cioè 0,1% questo valore indica che la quantità minore da pesare per avere una precisione dell0 0,1% è 100 mg.
risposta corretta C
35. Si consideri la reazione di titolazione (da bilanciare) del ferro(II) con permanganato:
Fe2+ + MnO4-+ H+ –> Fe3+ + Mn2+ + H2O
Di essa si può affermare che:
A) il potenziale al punto di equivalenza è indipendente dal pH
B) maggiore è il pH minore è il potenziale al punto di equivalenza
C) il pH e il potenziale al punto di equivalenza sono direttamente proporzionali
D) il potenziale al punto di equivalenza dipende esclusivamente dai potenziali normali delle due coppie redox coinvolte
soluzione
1]MNO4- + 8H+ + 5e —> Mn+2 + 4H2O
5]Fe+2 —-> Fe+3 +e
—————————————————
MnO4- +5Fe+2 +8H+ —-> Mn+2+ 5 fe+3 + 4H2O
Il potenziale elettrochimico di una reazione redox è
E= E° + RT/nF log K
E=E° + RT/nF lg [ Fe3+]5 [Mn2+] [H2O]4 / [Fe2+]5 [MnO4-][ H+]8
da questa equazione si vede che il potenziale E è funzione del PH della soluzione e che al punto di equivalenza necessariamente il valore di E diminuisce
risposta corretta B
36. Indicare l’affermazione ERRATA. Il termine Chiralità in chimica organica indica un fenomeno:
A) che interessa ogni oggetto o molecola che non possegga un piano e un centro di simmetria
B) che riguarda un oggetto o molecola diverso dalla propria immagine speculare
C) che riguarda gli atomi di carbonio legati a quattro gruppi diversi
D) che riguarda tutti gli oggetti e le molecole che per riflessione in un piano danno un’immagine alla quale non sono sovrapponibili
soluzione
La chiralità (dal greco χείρ, “mano”) è la proprietà di un oggetto rigido (o di una disposizione spaziale di punti o atomi) di essere non sovrapponibile alla sua immagine speculare. In chimica è detta chirale una molecola non sovrapponibile alla propria immagine speculare nelle tre dimensioni.

non esiste un atomo (o un punto) che sia chirale, bensì la chiralità è una proprietà appartenente alla molecola (o a un oggetto in generale).[
Un atomo di carbonio che porti quattro sostituenti diversi, e faccia parte di una molecola chirale, è correttamente definibile come centro chirale.
Si deduce che la risposta corretta è C
37. La velocità iniziale della reazione A + B –> C è stata misurata per differenti concentrazioni iniziali di A e B, con i risultati qui riportati
Exp. [A] (M) [B] (M) Velocità iniziale (M/s=
——————————————–
1 0, 100 0,100 4,0 ∙10‒5
2 0, 100 0,200 4,0 ∙10‒5
3 0 ,200 0,100 16,0 ∙10‒5
Determinare: l’ordine della reazione, il valore della costante cinetica e la velocità della reazione quando
[A] = 0.050 M e [B] = 0.100 M
A) 1, 4,0 ∙10-3M-1s-1, 8,0 ∙10-5 M s-1
B) 2, 2,0 ∙10-2M-1s-1, 4,0 ∙10-5 M s-1
C) 2, 4,0 ∙10-3M-1s-1, 1,0 ∙10-5 M s-1
D) 3, 2,0 ∙10-3M-1s-1, 1,0 ∙10-5 M s-1
soluzione
Sappiamo che la velocità di reazione cambia durante un intervallo di tempo considerato e la concentrazione varia più velocemente all’inizio del periodo di tempo considerato. La velocità istantanea di reazione è il rapporto tra la variazione di concentrazione rispetto all’intervallo di tempo.
Dai dati del problema vediamo che la reazione è del secondo ordine in A perchè dipende dal[A]2 e di ordine zero in B (perchè non dipende dalla [B] ).(Nelle reazioni di secondo ordine rispetto ad un componente la velocità risulta proporzionale al quadrato della concentrazione di quel componente).
v = k [A]2[B]0
La costante cinetica k (essendo la velocità iniziale 4 x 10-5 mol/s) è quindi :
k = v / [A]2[B]0 = 4.0 x 10-5 M/s / (10-1 M)2 = 4.0 x 10-3 M-2s-1
Nota la costante cinetica possiamo calcolare la velocità quando [A]=0,05 M
V= k [A]2= 4 x 10-3 x(0,05)2 = 0,0025 x 4 x 10-3= 1 x 10-5 M/s
risposta corretta C
38. Si parla di isomeri configurazionali quando due composti hanno:
A) la stessa costituzione e gli stessi legami degli atomi ma una diversa disposizione spaziale degli stessi atomi; le disposizioni non sono convertibili se non per rottura di un legame
B) la stessa costituzione ma una diversa disposizione spaziale degli atomi; le disposizioni sono convertibili senza rottura di legami ma per semplice rotazione attorno a uno o più legami
C) isomeria di catena, di funzione o di posizione
D) una diversa conformazione
soluzione
isomeri (dal greco isos: uguale e meros: parte) sono quei composti aventi la stessa formula molecolare (o bruta) ma diversa formula di struttura.
Esistono diversi tipi di isomeria che si possono distinguere in due categorie fondamentali:
– isomeria di posizione o di catena: in tali isomeri gli atomi occupano nella molecola posizioni diverse;
– stereoisomeria: in questo caso gli isomeri, generalmente chiamati stereoisomeri, differiscono perché gli atomi delle loro molecole sono legati nella stessa sequenza, ma diversamente orientati nello spazio.
La stereoisomeria comprende gli isomeri conformazionali e gli isomeri configurazionali. Questi ultimi, a loro volta, possono essere distinti in isomeri geometrici e isomeri ottici.
Come si vede non sono convertibili se non attraverso la rottura dei legami ed il loro riposizionamento.
Sono detti isomeri conformazionali o conformeri gli stereoisomeri che si ottengono quando gli atomi ruotano attorno a legami singoli, dando origine a conformazioni diverse della molecola.
Prendendo in esame la molecola dell’etano C2H6, ad esempio, si nota che essa può esistere in due forme:infatti, gli atomi di idrogeno della forma spaziale eclissata sono più vicini di quelli dell’altra forma, causando un impedimento sterico che provoca una repulsione tra gli atomi. La forma sfalsata è più stabile perché gli atomi, disposti alla massima distanza possibile, non provocano reciproche interferenze.

Il cicloesano può assumere una conformazione di particolare stabilità, detta a sedia, in cui l’anello non subisce tensioni perché tutti i legami sono sfalsati. La conformazione a sedia è rigida e risulta la più stabile; tutti i legami infatti sono disposti in modo tale da avere la minima repulsione possibile. Esaminando più attentamente gli atomi di idrogeno di tali conformazioni si osserva che essi possono essere suddivisi in due gruppi distinti: sei assiali e sei equatoriali. Gli atomi di idrogeno assiali sono quelli disposti perpendicolarmente al piano mediano della molecola, mentre gli equatoriali sono quelli disposti parallelamente a tale piano; questi ultimi risultano più stabili perché presentano minori interazioni. E’ possibile anche l’esistenza di un’altra conformazione, denominata a barca, meno stabile a causa della tensione dovuta alla presenza di due legami eclissati. La conformazione a barca, pur non presentando tensioni angolari, è meno stabile perché i legami C—H si trovano tutti in posizione eclissata. Ciò provoca un altro tipo di tensione detta tensione torsionale. La conformazione a barca è flessibile e per semplici torsioni può formare due conformazioni più stabili, dette conformazioni a treccia o conformazioni a twist che hanno il vantaggio di avere tutti i legami C—H in posizione sfalsata.
Come conseguenza della deformazione dell’anello, sei dei legami carbonio-idrogeno finiscono quasi perpendicolare al piano medio e quasi paralleli all’asse di simmetria, con direzione alternata, e si dicono assiali . Gli altri legami CH che giacciono quasi paralleli al piano medio, e si dice che siano equatoriali . Gli angoli sono tali che i due legami CH in ogni carbonio, uno assiale e uno equatoriale, puntino in senso opposto rispetto all’asse di simmetria. Così, in una conformazione a sedia ci sono tre legami CH di tipo – assiale “up”, assiale “down”, equatoriale “up”, ed equatoriale “down”; e ciascuno carbonio ha una “up” e uno “down”, e uno assiale e uno equatoriale. Idrogeni a carboni successivi sono quindi sfalsati in modo che vi sia poca deformazione torsionale . Questa geometria è spesso mantenuta quando gli atomi di idrogeno sono sostituiti da alogeni o altre semplici gruppi.
Da quanto esposto la risposta corretta è A
39. La chelazione con EDTA (acido etilendiaminotetraacetico) può essere usata per il trattamento dell’avvelenamento da metalli. Infatti, si sa che:
A) se ad una persona avvelenata da un sale di piombo viene somministrato Ca(EDTA)2− (Kf = 5 ∙1010) si ha lo scambio Pb → Ca in quanto Pb(EDTA)2− ha una costante di formazione maggiore (Kf = 1,1 ∙1018)
B) il Pb2+ viene ossidato a Pb4+ dal Ca2+ che si riduce a Ca atossico
C) si forma un complesso con due ioni Pb2+ per ione EDTA contrariamente al Ca2+ che forma un complesso 1:1
D) con il sale di Pb2+ si forma un complesso polimerico in cui gli ioni Pb2+ legano in catena più ioni EDTA in forma di catena lineare polimerica
soluzione
La risposta B è errata così come la risposta C e D
La risposta corretta è A
40. L’energia reticolare di KI è l’energia che si libera nel processo:
A) K+(g) + I-(g) –>KI(g)
B) K+(g) + I-(g) –>KI(s)
C) K (s) + I-(g) –>A KI(s)
D) K (s) + I2 (s) –> KI(g)
soluzione
L’energia reticolare è una misura della forza dei legami che formano un dato composto solido ionico. Viene definita come il ΔH° del composto ionico ottenuto a partire dai singoli ioni in fase gassosa secondo un processo esotermico. Il concetto di energia reticolare fu inizialmente sviluppato per i composti con struttura di tipo NaCl e ZnS, dove gli ioni occupano siti del reticolo ad elevata simmetria. Nel caso di NaCl, ad esempio, l’energia reticolare è l’energia liberata dalla reazione
- Na+ (g) + Cl− (g) → NaCl (s)
che assume valore -787KJ/mol. Una definizione alternativa di Energia Reticolare consiste nel considerare l’energia reticolare come il lavoro necessario per separare gli ioni dallo stato solido combinato e portarli in fase gassosa (in questo caso cambia di segno).
l’equazione di Born-Landé fornisce l’energia che rende stabile il reticolo :
in cui r è la distanza minima tra gli ioni Z la carica N la costante di Avogadro εo la costante dielettrica e la carica elementare
Da quanto esposto la risposta corretta è B
41. Indicare le coppie di elettroni presenti attorno all’atomo centrale di IF4- e la geometria dello ione:
A) 4 di legame e 2 di non legame, struttura quadrata
B) 2 di legame e 4 di non legame, struttura quadrata
C) 2 di legame e 2 di non legame, struttura tetraedrica
D) 2 di legame e 1 di non legame, struttura a V
soluzione



come si vede, mentre gli elettroni sono distribuiti secondo un ottaedro in quanto vi sono 2 coppie elettroniche di non legame sull’atomo centrale, gli atomi, invece, sono disposti secondo una struttura planare quadrata-
Risposta corretta A
42. Indicare le affermazioni corrette:
a) la conducibilità elettrica di un metallo diminuisce al crescere della temperatura
b) un solido ionico è un buon conduttore elettrico
c) nei semiconduttori, la separazione fra banda di conduzione e banda di valenza è trascurabile
d) la stabilità di un solido molecolare cresce al crescere della forza del legame covalente nella sua molecola
A) a, c, d
B) a
C) a, b
D) b, d
soluzione
La conducibilità elettrica è una misura della capacità che ha un materiale (o una soluzione) di condurre una corrente elettrica. È definita come l’inverso della resistività, ϱ, che appare nella seconda legge di Ohm, R=ϱl/S, dove R indica la resistenza elettrica del conduttore, l la sua lunghezza e S la sezione.I materiali sono classificati in conduttori, semiconduttori e isolanti, secondo la loro conducibilità elettrica.La conducibilità di un materiale dipende dalla temperatura. Per materiali isolanti e semiconduttori essa aumenta con l’aumentare della temperatura, mentre la conduttività nei metalli un aumento di temperatura porta a una diminuzione della conducibilità gli elettroni vanno incontro ad una diminuzione della loro mobilità a causa dell’aumento delle vibrazioni reticolari all’interno del materiale provocato dalla temperatura.
La principale dipendenza della conduttività dalla temperatura è riconducibile al parametro τ, che è approssimabile con il rapporto tra la distanza interatomica e la velocità termica della particella:
In un composto ionico gli elettroni sono trattenuti fortemente dal legame ionico. e quindi i solidi ionici sono pessimi conduttori ma il composto ionico diventa conduttore se è allo stato fuso, perchè in questo caso la corrente non è più trasportata dagli elettroni ma dagli ioni.
Le proprietà elettriche di un solido cristallino dipendono dalle peculiari caratteristiche della struttura a bande e dal numero di elettroni presenti nella banda di valenza. Riferendoci ai casi più semplici, se la banda di valenza è parzialmente occupata, di modo che vi sono livelli superiori disponibili per gli elettroni nella stessa banda, il solido è un conduttore; se, invece, la banda di valenza è completamente occupata il solido può essere un semiconduttore o un isolante, a seconda dell’ampiezza del gap energetico che separa la banda di valenza da quella immediatamente superiore (banda di conduzione). In particolare, alla temperatura T, il solido è un semiconduttore se il gap Eg è minore, confrontabile o non molto più grande di kT (in modo tale che il moto di agitazione termica permetta ad un certo numero di elettroni di valenza di passare nella banda di conduzione), è un isolante se Eg è molto più grande di kT.
I solidi molecolari sono costituiti da aggregati di particelle (atomi o molecole) interagenti mediante forze di Van der Waals o legami idrogeno e la loro struttura cristallina dipende sia dalla direzione delle forze di interazione, in modo tale che ogni particella interagisca nel modo migliore, sia dalla geometria molecolare per cui le particelle tendono a impacchettarsi in maniera tale da creare il minimo ingombro.
Come si vede l’ affermazione D è errata in quanto la stabilità dei solidi molecolari non dipende dal legame covalente ma dalle forze di van der Waals.
La risposta corretta è B
43. Indicare le affermazioni corrette:
a) un elemento che ha le seguenti Energie di Ionizzazione: 800, 1500, 7800, kJ mol-1, non appartiene al 3° gruppo della tavola periodica
b) l’energia di prima ionizzazione dipende dalla carica nucleare efficace
c) la temperatura è una proprietà intensiva
d) un legame doppio tra due atomi anche diversi dal C può essere costituito da un legame s e uno p o da due legami s
A) a, b
B) a, b, c
C) a, c, d
D) a, b, c, d
soluzione
un elemento con Energie di Ionizzazione: 800, 1500, 7800, kJ mol-1, non può appartenere al 3° gruppo della tavola periodica in quanto l\’energia di terza ionizzazione è circa 10 volte più grande denotando una forte schermatura dall’atomo. che dipende dalla carica nucleare effettiva. Da quanto detto le affermazioni a e b sono corrette.
Una proprietà si dice estensiva se il suo valore dipende dalle dimensioni del corpo a cui ci si riferisce (la massa, il volume sono grandezze estensive).
La temperatura, la pressione, il volume specifico e la densità sono invece esempi di grandezze intensive.
Per quanto attiene l’affermazione D, quando si forma un legame tra due atomi per formare una molecola, si formano orbitali che si estendono su tutta la molecola(orbitali molecolari OM) egli elettroni che prima si trovavano sugli atomi adesso si dispongono sugli OM seguendo lo stesso metodo di riempimento degli orbitali atomici. La funzione d’onda più semplice che descrive una molecola A-B è data dalla
ψm = aψ1 + b ψ2
in cui a e b rappresentano il contributo dell’orbitale dell’atomo A e quello dell’atomo B alla formazione dell’OM.
Questa funzione matematica sostituita nell’equazione di Schrodinger Hψm = E ψm dà origine a due tipi di orbitali molecolari e quindi a legami :
1- orbitale di legame con energia più bassa di quella degli atomi
2 – orbitale di antilegame con energia più alta
In generale le energie degli orbitali molecolari vengono rappresentate da diagrammi di energia. Un esempio è la molecola di Ossigeno

come si può vedere la sovrapposizione degli orbitali di tipo s forma OM sigma di legame e di antilegame, mentre gli orbitali P formano orbitali di tipo sigma e di tipo π di legame e di antilegame. Come si vede in questo caso la sovrapposizione degli orbitali P conduce alla formazione di due tipi di legame uno di tipo σ ed uno di tipo π. Questo viene definito doppio legame.
Da quanto detto è chiaro che un doppio legame non può essere formato da orbitali di tipo s che hanno simmetria sferica.
Si evince che la risposta corretta è B
.
44. Una soluzione di iodio e idrogeno si trova in equilibrio con HI gassoso, alla T di 500 °C. La Kc di equilibrio vale 46, mentre [I2] vale 3,1 10-3 M e [HI] = 2,7 10-3 M. Calcolare [H2] nella miscela:
A) 0,76 mM
B) 0,35 mM
C) 0,05 mM
D) 1,2 mM
soluzione
la reazione da considerare è
H2+I2 ⇔ 2HI
Kc= [HI]2 / [H2][I2] = 46 da cui [H2] = [HI]2 / [I2] 46 trasformando tutto in millimoli si ha
[H2] = (2,7 )2 / 46 x 3,1 = 7,29 / 142,6 =0,05 mM
risposta corretta C
45. Dato il composto HClO3, indicare, nell’ordine,gli elettroni di valenza, se esiste una formula di Lewis con cariche formali 0 su tutti gli atomi, e il n°di legami semplici, doppi e tripli, presenti nella migliore formula di Lewis:
A) 13, si, 2, 2, 0
B) 13, no, 1, 2, 1
C) 26, si, 1, 1, 1
D) 26, si, 2, 2, 0
soluzione

come si vede dalla struttura, vi sono 26 elettroni e 2 legami doppi ma nessun legame triplo.
CF = numero elettroni di valenza atomo neutro – numero di elettroni di non legame – 1/2 numero elettroni legami
per Cl ad esempio CF= 7 – 2 -10/2 = 0
analogamente per l’O CF= 6 – 4 -4/2=0
per l’H CF= 1- 0 – 2/2=0
La risposta corretta è D
46. Da una quantità pesata di un ossido di manganese (250,0 g) si estrae una massa di manganese maggiore della metà (158,0 g).
Immaginando che la reazione sia quantitativa, indicare la formula minima dell’ossido:
A) MnO
B) MnO2
C) Mn2O3
D) MnO4
soluzione
La % di Mn nel campione è 250 :158 =100 : X X= % Mn= 63,2 % e la % di O = 100-63,2 = 36,8 %
pertanto 63,2 /54,9= 1,15 36,8 / 16= 2,3 dividendo per il numero più piccolo si ha Mn = 1 O = 2
La formula minima è MnO2
Risposta corretta B
47. Indicare la massa di rame che viene depositata al catodo di una cella elettrolitica contenente una soluzione di ioni Cu2+ in cui si fa passare una corrente di 1,62 A per 1,00 h.
A) 0,604 g
B) 1,92 g
C) 2,84 g
D) 3,84 g
soluzione
Fornendo energia elettrica tramite una sorgente esterna si può far avvenire una reazione redox non spontanea ed il processo perende il nome di Elettrolisi. Leggi di Faraday, che regolano gli aspetti quantitativi dell’elettrolisi sono
1. La massa di materia che si deposita sotto forma di solido (o liquido) o si sviluppa sotto forma di gas agli elettrodi è direttamente proporzionale alla quantità di elettricità che si applica agli elettrodi.
2. Per depositare o liberare agli elettrodi 1 equivalente di sostanza (quantità che cede o perde una mole di elettroni) occorre sempre la stessa quantità di elettricità pari a 96485 coulomb/mole di elettroni., Questa quantità di elettricità è definita 1 Faraday.
La quantità di elettricità (Q) che viene fatta passare in una cella elettrolitica è misurata in coulomb. Essa è ottenibile dalla intensità della corrente I (misurata in Ampere, A) e dal tempo t (misurato in secondi, s) per il quale viene fornita corrente:
Quantità di elettricità che attraversa la cella è data da Q (coulomb) = Ampere x secondi
Nel caso in esame la reazione catodica è
Cu+2 +2 e –> Cu
e la quantità di corrente che attraversa la cella è 1,62 A x 60 minuti Q= 1,62 x 3600 = 5832 coulomb
63,55 g = 1 mole che è costituita da 2 equivalenti cioè da 2 x 31,775 grammi
pertanto se 96500 C depositano al catodo 1 equivalente cioè 31,775 g di Cu allora 5832 C ne depositano X X= 1,92 g di Cu
risposta corretta B
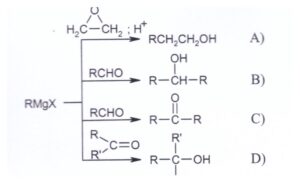
48. Indicare la reazione con il prodotto ERRATO:
A) a
B) b
C) c
D) d
soluzione
Le reazioni di Grignard aggiungono un radicale R all’aldeide o chetone ma il risultato della reazione con l’aldeide è un alcol e non è un chetone.
Le reazioni tra i vari composti contenenti il gruppo C=O quali aldeidi e chetoni, procedono tutte secondo il medesimo meccanismo e l’unica differenza è costituita nei gruppi legati al carbonile. Nel primo stadio della reazione il reattivo di Grignard si addiziona al doppio legame carbonio-ossigeno ad esempio
successivamente si aggiunge acido diluito per idrolizzare il prodotto della reazione per formare l’alcol.
Tuttavia è possibile anche ottenere un chetone ma solo per ossidazione dell’OH dell’alcol che si ottiene dalla reazione di Grignard ma non è il caso del quesito .
Il prodotto di reazione errato è C
49. Indicare l’affermazioni ERRATA:
A) nello spettro 1H-NMR di un estere acilico i protoni della parte alchilica (RCOOCH2R’) rispetto a quelli della parte acilica (RCH2COOR’) risuonano a frequenze maggiori (4,3 ppm contro 2,3 ppm)
B) nello spettro IR, un estere aromatico del tipo ArCOOR assorbe tra 1715 – 1730 cm-1; uno del tipo RCOOAr assorbe attorno a 1770 cm-1
C) nello spettro 13C il carbonio carbonilico di un estere risuona nell’intervallo 150-185 ppm
D) nello spettro 1H-NMR l’idrogeno aldeidico RCHO risuona nello stesso intervallo dei protoni vinilici e il carbonio carbonilico risuona sopra i 190ppm
soluzione
Sappiamo che gli atomi di idrogeno (così come il C13 ) assorbono a frequenze leggermente diverse se sono immersi in un intorno chimico diverso . Un atomo di idrogeno, infatti, a seconda dell’elettronegatività dell’atomo a cui è legato, può essere più o meno immerso nei propri elettroni di legame. Queste particelle cariche sottoposte all’azione di campo magnetico Bo, producono un movimento elettronico che dà origine ad un piccolo campo magnetico indotto opposto a quello forte applicato.Per esempio in un estere acilico i protoni della parte alchilica (RCOOCH2R’) rispetto a quelli della parte acilica (RCH2COOR’) risuonano a frequenze maggiori (4,3 ppm contro 2,3 ppm) quindi la risposta A è corretta così come sono corrette le affermazioni B e C
La risposta errata è D
50. Indicare l’affermazione ERRATA.
Si ricorre alle titolazioni inverse:
A) quando l’acido o la base da titolare sono dotati di una volatilità non trascurabile (es. N2 secondo Kjeldahl)
B) quando la reazione tra la sostanza da titolare e il primo reagente titolante è molto rapida
C) nel caso della titolazione per precipitazione dei cloruri secondo Volhard perché il solfocianuro in eccesso dà il viraggio con l’indicatore
D) per permettere al primo agente titolante di facilitare il completamento della reazione per azione di massa
soluzione
E’ ovvio che se la reazione tra titolante e sostanza da titolare risulta essere molto veloce, non si apprezza adeguatamente il punto di viraggio per cui si preferisce aggiungere un eccesso di titolante e retrotitolare quest’ultimo.
risposta corretta B
51. Lo ione trioduro I3- è uno ione polialogenuro. Esso può essere prodotto con la seguente reazione:
I2 + I- –> I3-
Indicare se la reazione è Redox o Acido-Base secondo Lewis. Indicare se si tratta di una reazione del primo tipo, e indicare quindi l’ossidante e il riducente, o del secondo tipo e quindi indicare l’acido e la base.
A) redox ox I2 riduc. I-
B) acido-base base I- acido I2
C) acido-base base I2 acido I-
D) dismutazione ox I2 riduc. I2
soluzione
si tratta di una reazione redox
2 I0 + 2/3 e– → 2 I-1/3 (riduzione)
I-I – 2/3 e– → I-1/3 (ossidazione)
I2 e l’agente ossidante ed I– è l’agente riducente. La reazione è una comproporzione cioè una reazione in cui due reagenti, ciascuno contenente lo stesso elemento ma con un diverso numero di ossidazione, formano un prodotto in cui gli elementi coinvolti raggiungono lo stesso numero di ossidazione. È contrario alla disproporzione.
Tuttavia in questa reazione lo ioduro è visto come un UNA BASE DI LEWIS e lo odio UN ACIDO DI LEWIS . Questa reazione è analoga alla reazione S8 + 2 Na2S —> 2Na2S5
La risposta corretta è A
52. Sapendo che la costante K dell’equilibrio di dissociazione
I2 <=> 2 I
vale 0,165 a 1000 °C, indicare, nell’ordine, il grado di dissociazione di I2, e la quantità chimica delle specie presenti all’equilibrio, quando 1 mol di I2 viene portata a 1000 °C in un pallone da 100 mL.
A) 6,24%; n I = 0,1248, n I2 = 0,938
B) 0,624%; n I = 1,248, n I2 = 9,38
C) 3,12%; n I = 0,155, n I2 = 0,458
D) 0,312%; n I = 0,062, n I2 = 0,938
soluzione
le moli di I2 iniziali sono 1/0,1 ml = 10 moli
Reazione . . . . . . . . . . . .I2 <———-> 2I
moli iniziali. . . . . . . . . ….10 . … . . . . . .0
variazione moli. . . . . . ….-X . . . . . . . . .+2X
moli finali. . . . . . . . . ……10-X. . . . . . ….. 2X
Le moli complessive finali sono:
n = 10 – X + 20 X = 10 + X
Possiamo calcolare le frazioni molari delle due specie:
Dalla Kp= Kc(RT)Δn
essendo Δn= 2-1 = 1
0,165 = Kc 0,0821 x 1273 0,165 = Kc x 104,5 Kc = 0,165 / 104,5 Kc= 1,58 x 10-3
Pertanto
Kc= (2x)2 / (10-X)
0,001579 = (2X)2 / (10-x)
0,001579 (10-x) = 4 X2
4X2 +0,001579X – 0,01579=0
X= 0,06265 grado di dissociazione = 6,26%
I-= 2x quindi I-= 0,125 moli di I-
I2=1-x = 1-0,06265 = 0,9373 moli di I2
Risposta corretta A
53. La cisteina è un amminoacido importante per la struttura terziaria delle proteine e molto più banalmente perché entra a giustificare la messa in piega permanente che i parrucchieri fanno a signori e signore. Alla fine delle loro operazioni i parrucchieri ossidano i residui di cisteina a residui di cistina. Indicare la reazione corretta che avviene:
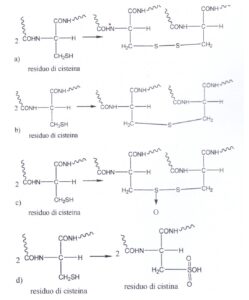
A) a
B) b
C) c
D) d
soluzione
La cisteina è un amminoacido che appartiene al terzo gruppo, quello che racchiude gli amminoacidi polari. La polarità della L-cisteina è dovuta alla presenza del gruppo sulfidrico SH, anche se questo amminoacido è molto meno polare rispetto alle altre molecole del gruppo.
Dall’ossidazione di due gruppi SH di due residui di cisteina vicini si forma un legame covalente detto ponte disolfuro. Quando i due gruppi SH reagiscono tra di loro vengono rilasciati due elettroni e si forma la cistina. La reazione è reversibile perché la cistina può accettare due elettroni ripristinando le due molecole di partenza. I ponti disolfuro possono formarsi sia intracatena, all’interno di una singola catena polipeptidica, che intercatena, tra più catene polipeptidiche.
R_SH + HSR ———-> RS-SR +2H+ + 2 e
questa reazione è tuttavia reversibile
RS-SR +2H+ +22e —> RSH + HSR
Questi legami covalenti tra due residui di cisteina sono fondamentali per la struttura e per la stabilità dei capelli e delle unghie, entrambi formati da particolari proteine dette cheratine. Le cheratine sono appunto tenute insieme grazie alla presenza dei ponti disolfuro.
Da quanto detto si evince che la risposta corretta è A
54. Indicare il pH di una soluzione acquosa contenente NaHC2O4 (0,020 M), e H2C2O4 (0,10 M), a 25 °C. Ogni eventuale costante necessaria va ricercata nel fascicolo.
A) 0,23
B) 0,97
C) 1,33
D) 0,53
soluzione
sappiamo che H2C2O4<=> H+ HC2O4- ed HC2O4- <==> H+ + C2O4-2
nel primo caso si ha
K1 = 5,9 x 10-2 = [H+] [HC2O4-] / [H2C2O4] [H+]= 5,9 x 10-2 x [H2C2O4] / [HC2O4-] cioè
[H+]= 5,9 x 10-2 x Ca/Cs
PH = -log[H+] = PKa – logCa/Cs
da cui PH=2-0,77- log 5 =2 -0,77-0,68 = 0,55
Nel quesito la risposta corretta è 1,33 e questo sarebbe esatto se Ca=Cs ma i valori sono diversi.
55. Porre i seguenti composti in ordine di reattività decrescente nei confronti della reazione di addizione al carbonile.

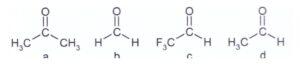
soluzione
la reattività dipende molto dall’ azione attrattiva o repulsiva degli atomi legati al Carbonile.
Il fluoro essendo molto elettronegativo esercita sugli elettroni un effetto attrattivo quindi favorisce l’apertura del doppio legame C=O per renderlo disponibile alla reazione di addizione.
l’idrogeno ha un debolissimo effetto induttivo elettrronrepulsore sul C=O quindi anche se ha un effetto meno intenso del Fluoro favorisce la reazione di addizione.
CH3 e soprattutto il gruppo isopropil hanno effetto induttivo elettronrepulsore che non favoriscono la reazione di addizione.
Si deduce che l’ordine di reattività decrescente rispetto all’addizione è:
CF3CHO> HCHO> CH3CHO> ( CH3)2 CO
La risposta corretta è A
56. Individuare l’affermazione ERRATA.
A) lo standard assoluto, normalmente utilizzato per determinare il titolo di una soluzione di KMnO4 in chimica analitica è l’ossalato sodico. Si usa però anche l’anidride arseniosa commerciale perché pura e stabile
B) la reazione di KMnO4 con H2C2O4 è lenta a 25 °C ed è catalizzata da ioni Mn2+. E’ più conveniente effettuare la reazione tra 60 e 90 °C, perché è più veloce e non si corre il rischio di commettere errori in quanto all’aria l’acido non reagisce con O2
C) l’acido arsenioso reagisce in ambiente acido con MnO4- per dare acido arsenico H3AsO4
D) la presenza di fluoruri in soluzione rende impossibile l’uso del KMnO4 come titolante
soluzione
La reazione tra permanganato di potassio e acido ossalico e la sua natura catalitica sono note fin dal 1866, ma il meccanismo di reazione appare ancora poco chiaro e diversi autori nel corso del tempo hanno sviluppato varie ipotesi.
La reazione di ossidoriduzione complessiva risulta:
2 MnO4–(aq) + 6 H+(aq) + 5 H2C2O4(aq) —» 2 Mn++(aq) + 8 H2O(aq) + 10 CO2(g)
Lo ione manganoso (Mn++) che si forma durante la reazione risulta essere un catalizatore della stessa secondo un meccanismo ancora sconosciuto.
L’ossalato di sodio NaOOCCOONa è un eccellente standard primario in quanto può essere ottenuto con un elevato grado di purezza, si presenta stabile quando è riscaldato e non è igroscopico e lo si usa proprio per standardizzare il Permanganato da usare nelle titolazioni ossidimetriche (permanganometria).La reazione viene eseguita a 55-60-70 gradi ma questo non è in relazione con l’ossigeno nè con la velocità di reazione.
I fluoruri presenti reagirebbero ossidandosi. Infatti per lo stesso motivo non si può usare HCl per acidificare al soluzione ( in quanto si svilupperebbe Cloro) e si usa H2SO4.
Si deduce che la risposta al quesito è B
57. Due proteine hanno Mr = 68000 e 14000 e punti isoelettrici pI = 6,8 e 11 rispettivamente. Indicare ogni tecnica idonea a separare una loro miscela.
a) cromatografia a scambio ionico; b) gel-filtrazione; c) dialisi; d) elettroforesi
A) a, b, d
B) a, b
C) a, d
D) c
soluzione
La dialisi delle proteine viene di solito utilizzata per concentrare la soluzione proteica quindi è una fase di preparazione del campione, e non è un metodo analitico. Le tecniche analitiche utilizzate sono in ordine di importanza : elettroforesi, spesso utilizzata per la routine analitica, lo scambio ionico e la gel-filtrazione che sono usate spesso molto più che l’elettroforesi soprattutto per analisi di proteine particolari.Esistono metodiche che utilizzano anche HPLC con rivelatore a fluorescenza e la spettrometria di massa.
La risposta corretta è A
58. Per ossidazione con KMnO4 acido a caldo, un composto di formula C5H8 ha dato come unico prodotto organico, acido 2-chetopropionico.
Il composto ossidato è:
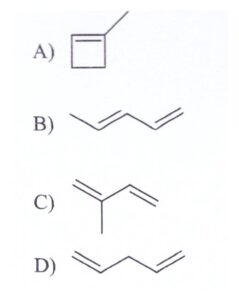

soluzione
l’acido 2 chetopropionico non è altro che l’acido piruvico

Il composto di partenza C5H8 è l’isoprene
il permanganato ossida il CH2 in posizione 4 formando il gruppo COOH mentre l’altro gruppo CH2 viene ossidato a chetone
Risposta corretta C
59. Indicare i reagenti idonei a permettere la seguente conversione:
soluzione
il boroidruro di sodio NaBH4 riduce i chetoni ad Alcoli attraverso gli ioni iidruro questi dioli sono molto reattivi e con acetone in ambiente acido eliminano una molecola di H2O e formano il prodotto.
risposta corretta B
60. Se si tratta una soluzione di glucosio (1 mol) in un solvente opportuno con acido periodico (H5IO6) in eccesso, si ottiene:
A) 1 mole di acido formico (HCOOH) e 5 moli di formaldeide (HCHO)
B) 5 moli di acido formico (HCOOH) e 1 mole di formaldeide (HCHO)
C) 5 moli di acido formico (HCOOH) e 1 di CO2
D) acido gluconico (C6H12O7)
soluzione
Essendo i carboidrati dei poli-oli, l’acido periodico ossida tali composti, frammentadoli in molecole di acido formico e di formaldeide. La reazione avviene in acqua, dove il gruppo carbonilico del carboidrato deve essere idratato per dare inizio alla scissione.
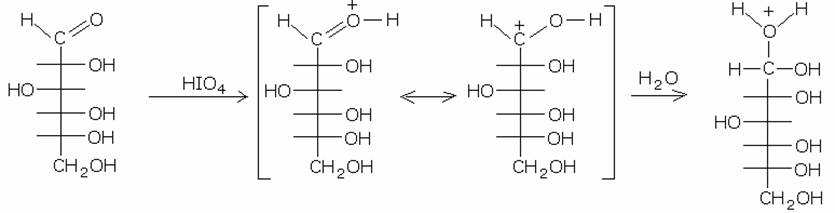

il gruppo aldeidico forma una molecola di acido formico. L’acido periodico, con le stesse modalità, attacca la nuova catena, riducendola di volta in volta di una unità, con la formazione, ogni volta, di acido formico. Il carbonio terminale, infine, viene ossidato a formaldeide. Pertanto dalla molecola di glucosio alla fine della reazione si formeranno 5 molecole di acido formico e 1 di formaldeide.
Risposta corretta B