IL POTENZIALE DI OSSIDO-RIDUZIONE
Se consideriamo una lamina di metallo M immersa in una soluzione dei suoi ioni M+n
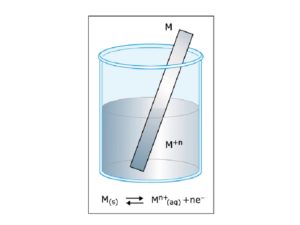
si osservano 2 processi : il passaggio del metallo M in soluzione sotto forma dei suoi ioni M→ M+n + n e e contemporaneamente il depositarsi degli ioni M+n sulla lamina di metallo M+n+ ne→ M. Si raggiungerà quindi uno stato di equilibrio:
Ms ⇄ M+naq+ ne
dove ne sono gli elettroni scambiati all’interfaccia Metallo-soluzione.
Durante il passaggio in soluzione, sulla superficie della lamina rimangono gli n elettroni e quindi si determina tra la lamina di metallo e la soluzione acquosa un doppio strato elettrico con opposte cariche . La figura mostra una lamina di magnesio immersa in una soluzione acquosa
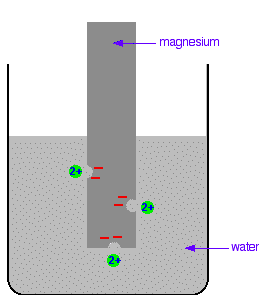
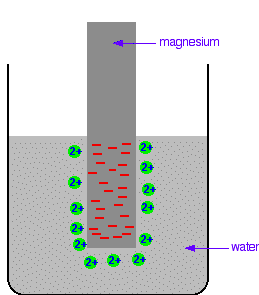
Il Mg forma ioni Mg+2 acquoso e sulla lamina rimangono due cariche elettriche cioè 2 elettroni. Come conseguenza di questa separazione di cariche, nell’interfaccia Metallo-soluzione si determina una differenza di potenziale elettrico che si indica con E.
Riassumendo : quando un solido è immerso in un liquido polare si carica elettricamente in superficie. In genere la carica è negativa. Tale carica causa la formazione di una struttura denominata “doppio strato elettrico”. Le cariche negative superficiali attraggono gli ioni positivi solvatati e orientano le molecole costituenti il liquido. Ioni e molecole generano quindi un cuscinetto ordinato di cariche sulla superficie del solido, via via sempre più diffuso verso il resto del liquido. Si distinguono quindi sulla superficie del solido:
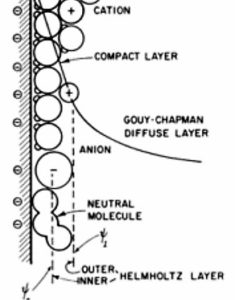
a) uno strato carico negativamente (Outer + Inner strato di Helmholtz);
b) uno strato adsorbito di ioni solvatati (strato di Stern);
c) uno strato diffuso di ioni e molecole orientate (strato di GouyChapman)
Per definizione il potenziale elettrico è il lavoro necessario per portare una carica da distanza infinita (bulk della soluzione) nell’interno del metallo. La ddp (differenza di potenziale) invece è la variazione di lavoro da un punto all’altro. Tuttavia essendo le soluzioni elettrolitiche più complicate rispetto al metallo in soluzione, il potenziale elettrico non può essere considerato da solo, così come accade anche al potenziale chimico, perché questi sistemi sperimentano sia fenomeni chimici che fenomeni elettrici. A questo scopo Guggenheim introdusse il concetto di potenziale elettrochimico:
μel = μ + + z NA x e Φ
pot elettrochimico = potenziale chimico + potenziale elettrico
I metalli in generale sono ottimi conduttori di corrente e secondo il modello a bande in un metallo distinguiamo dei livelli di energia occupati da elettroni e la sovrapposizione dei livelli di ogni singolo atomo porta alla formazione di gruppi di livelli o bande e nel metallo distinguiamo in particolare la banda in cui si trovano gli elettroni più esterni e una banda di energia superiore, vuota, che chiamiamo rispettivamente banda di valenza e banda di conduzione.
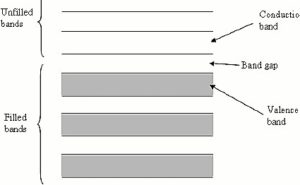
Gli elettroni di valenza infatti non risultano legati ad un tipo di ione ma al reticolo nel suo complesso. Possiamo spiegare queste proprietà osservando che gli atomi di molti elementi che formano legami metallici hanno un’energia di ionizzazione bassa. Un valore basso dell’energia di ionizzazione significa che un atomo lega debolmente gli elettroni di valenza. Di conseguenza nel solido, gli elettroni di valenza si separano facilmente dai loro atomi ed assumono una distribuzione abbastanza uniforme di carica negativa : in altri termini si viene a creare un “gas di elettroni”.
- ∞ →superficie dell’elettrodo POTENZIALE DI VOLTA
- attraversamento della superficie POTENZIALE DI SUPERFICIE
- ∞ → interno metallo POTENZIALE GALVANI (o INTERNO)
il potenziale di superficie è costituito dal contributo degli ioni presenti all’interfase liquido-metallo e dal contributo dei dipoli orientati inquesta regione.
I potenziali tipici di un elettrodo metallico sono:
- POTENZIALE DI VOLTA
- POTENZIALE GALVANI
POTENZIALE DI VOLTA
nelle due parti dell’interfaccia metallo soluzione si crea una differenza di potenziale di cui una parte è costituita dal potenziale di Volta dovuto proprio alla presenza delle cariche nelle due facce.
POTENZIALE GALVANI O INNER POTENTIAL
la differenza di potenziale dovuta al lavoro fatto per portare una carica unitaria dall’infinito nel vuoto al centro del metallo.
In conclusione il Potenziale di un elettrodo che indichiamo con E è il risultato del contributo dei potenziali volta e galvani da cui si può dedurre che è impossibile misurare il valore assoluto di E, però, possiamo misurare un valore di E relativo ad un elettrodo preso come riferimento ed a cui si attribuisce per convenzione il valore E=0: tale elettrodo di riferimento è l’elettrodo ad idrogeno.
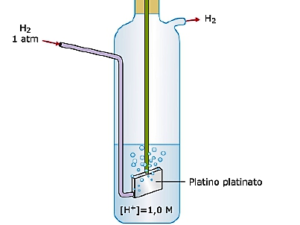
come si vede in figura, l’elettrodo di riferimento è costituito da una lamina di platino rivestita da uno strato poroso di polvere di platino che è contenuta in una capsula di vetro immersa in una soluzione 1 M di HCl ed attraverso cui si fa gorgogliare idrogeno gassoso alla pressione di 1 atmosfera.L’ elettrodo viene usato alla temperatura di 25°C .La reazione che si verifica sulla superficie del platino nell’elettrodo ad idrogeno è la seguente
2H+ (acq) ⇄ H2(g)
L’ elettrodo ad idrogeno, per essere utilizzato come riferimento, deve essere collegato con l’elettrodo di cui si vuol calcolare il valore di E relativo, cioè occorre creare un circuito elettrico costituito dall’elettrodo metallico e dall’elettrodo ad idrogeno collegati attraverso un ponte salino.La figura seguente mostra un esempio di cella elettrochimica, costituita da un elettrodo di Zinco ed un elettrodo ad idrogeno in cui il ponte salino è un tubicino contenente KNO3 in soluzione ed alle cui estremità vi sono due setti porosi( questo permette la continuità elettrica tra i due elettrodi ma non passaggio di sostanza).
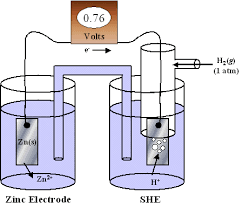
I due elettrodi sono collegati ad un volmetro che misura la differenza di potenziale tra i due elettrodi che vengono anche chiamati semicelle. Abbiamo quindi un circuito elettrico costituito da due semicelle una delle quali è la semicella ad idrogeno e l’altra una semicella del metallo.
Il circuito che vediamo in figura viene rappresentato con la seguente convenzione :
La semicella in cui si ha ossidazione (un elemento che cede elettroni si dice che si ossida mentre un elemento che acquista elettroni si dice che si riduce) costituisce l’anodo e si scrive a sinistra e quella in cui si ha riduzione(catodo) a destra.


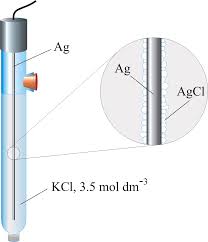
AgCl +e ⇄ Ag° + Cl-
ed il suo potenziale è dato dalla E=E° – 0,0591 log[Cl-]x f
E°= 0,2389 V a 25° quando KCl=1M pertxanto:
E= 0,2389- 0,0591 log aCl-
Il potenziale di un elettrodo ad argento/cloruro d’argento contenente una soluzione satura di KCl è pari a +0,197 V rispetto all’elettrodo standard ad idrogeno.
– nFe E = -nFeE° + RT ln Keq da cui
E= E° – RT/nFe ln K
ma K = 1/[M+n] pertanto E=E° -RT/nFe ln 1/[M+n]
e passando dai logaritmi naturali a quelli decimali e ricordando che il Log 1/x = Log 1 – logx e che log1 =0
E=E° -RT/nFe (log1 – log[M+n] )
usando il valore di [M+n] = 1 M si ha che il potenziale misurato sul volmetro della cella galvanica E non è altro che il valore del potenziale standard dell’elettrodo metallico E° infatti poichè
-RT/nFe x ln 1 =0
E=E°
Con questo metodo sono stati misurati i valori di E° per tutti i metalli ed è stata creata una scala di valori al cui centro vi è il potenziale dell’idrogeno per convenzione uguale a zero. L’altra convenzione utilizzata è che sono stati considerati e tabulati i valori di E° relativi alle riduzioni non alle ossidazioni per esempio la reazione considerata è :
M+n +ne ⇄ M
il cui E° misurato è E° di riduzione.
Ovviamente se si considera la reazione di ossidazione
M ⇄ M+n +ne
il valore di E° deve cambiare di segno cioè E° riduz.= – E° ossid
Valori tabulati dei potenziali standard
Nella tabella seguente vengono indicati i valori dei potenziali di riduzione standard misurati :
| Catodo | Potenziale di riduzione standard E0 (volt) |
|---|---|
| 3N2 + 2H+ + 2e− → 2HN3 | −3,09 |
| Li+(aq) + e− → Li(s) | −3,04 |
| Rb+ + e− → Rb(s) | −2,98 |
| K+(aq) + e− → K(s) | −2,93 |
| Cs+(aq) + e− → Cs(s) | −2,92 |
| Ba2+(aq) + 2e− → Ba(s) | −2,91 |
| Sr2+(aq) + 2e− → Sr(s) | −2,89 |
| Ca2+(aq) + 2e− → Ca(s) | −2,76 |
| Na+(aq) + e− → Na(s) | −2,71 |
| Mg(OH)2 + 2e− → Mg + 2OH− | −2,69 |
| Mg2+(aq) + 2e− → Mg(s) | −2,38 |
| H2AlO3−(aq) + H2O + 3e− → Al(s) + 4OH− | −2,35 |
| N2(g) + 2H2O + 4H+ + 2e− → 2NH3OH+(aq) | −1,87 |
| Al3+(aq) + 3e− → Al(s) | −1,66 |
| HPO32−(aq) + 2H2O + 2e− → H2PO2−(aq) + 3OH− | −1,65 |
| ZnO22−(aq) + 2H2O + 2e− → Zn(s) + 4OH− | −1,22 |
| CrO2−(aq) + 2H2O + 3e− → Cr(s) + 4OH− | −1,20 |
| Mn2+(aq) + 2e− → Mn(s) | −1,19 |
| 2SO3=(aq) + 2H2O + 2e− → S2O4=(aq) + 4OH− | −1,12 |
| PO43−(aq) + 2H2O + 2e− → HPO32−(aq) + 2OH− | −1,05 |
| Sn(OH)62−(aq) + 2e− → HSnO2−(aq) + 3OH− + H2O | −0,93 |
| SO42−(aq) + H2O + 2e− → SO32−(aq) + 2OH− | −0,93 |
| Cr2+(aq) + 2e− → Cr(s) | −0,91 |
| Ti3+(aq) + e− → Ti2+(aq) | −0,90 |
| TiO2(s) + 4H+ + 4e− → Ti(s) + 2H2O | −0,86 |
| 2H2O(l) + 2e− → H2(g) + 2OH−(aq) | −0,828 |
| Zn2+(aq) + 2e− → Zn(s) | −0,762 |
| Cr3+(aq) + 3e− → Cr(s) | −0,74 |
| AsO43−(aq) + 2H2O + 2e− → AsO2−(aq) + 4OH− | −0,71 |
| PbO(s) + H2O + 2e− → Pb(s) + 2OH− | −0,576 |
| Fe(OH)3(s) + e− → Fe(OH)2(s) + OH− | −0,56 |
| 2CO2(g) + 2H+ + 2e− → H2C2O4(s) | −0,49 |
| S(s) + H2O + 2e− → HS−(l) + OH− | −0,48 |
| S(s) + 2e− → S2−(aq) | −0,476 |
| Fe2+(aq) + 2e− → Fe(s) | −0,41 |
| Cd2+(aq) + 2e− → Cd(s) | −0,40 |
| Co2+(aq) + 2e− → Co(s) | −0,28 |
| Ni2+(aq) + 2e− → Ni(s) | −0,257 |
| Sn2+(aq) + 2e− → Sn(s) | −0,14 |
| Pb2+(aq) + 2e− → Pb(s) | −0,13 |
| Fe3+(aq) + 3e− → Fe(s) | −0,04 |
| 2H+(aq) + 2e− → H2(g) | 0,00 |
| Sn4+(aq) + 2e− → Sn2+(aq) | 0,15 |
| Cu2+(aq) + e− → Cu+(aq) | 0,16 |
| ClO4−(aq) + H2O(l) + 2e− → ClO3−(aq) + 2OH−(aq) | 0,17 |
| S4O62−(aq) + 2e− → 2S2O32−(aq) | 0,2 |
| AgCl(s) + e− → Ag(s) + Cl−(aq) | 0,22 |
| Cu2+(aq) + 2e− → Cu(s) | 0,34 |
| ClO3−(aq) + H2O(l) + 2e− → ClO2−(aq) + 2OH−(aq) | 0,35 |
| IO−(aq) + H2O(l) + 2e− → I−(aq) + 2OH−(aq) | 0,49 |
| Cu+(aq) + e− → Cu(s) | 0,52 |
| I2(s) + 2e− → 2I−(aq) | 0,54 |
| ClO2−(aq) + H2O(l) + 2e− → ClO−(aq) + 2OH−(aq) | 0,59 |
| Fe3+(aq) + e− → Fe2+(aq) | 0,77 |
| Hg22+(aq) + 2e− → 2Hg(l) | 0,80 |
| Ag+(aq) + e− → Ag(s) | 0,80 |
| Hg2+(aq) + 2e− → Hg(l) | 0,85 |
| ClO−(aq) + H2O(l) + 2e− → Cl−(aq) + 2OH−(aq) | 0,90 |
| 2Hg2+(aq) + 2e− → Hg22+(aq) | 0,90 |
| NO3−(aq) + 4H+(aq) + 3e− → NO(g) + 2H2O(l) | 0,96 |
| Br2(l) + 2e− → 2Br−(aq) | 1,07 |
| O2(g) + 4H+(aq) + 4e− → 2H2O(l) | 1,23 |
| Cr2O72−(aq) + 14H+(aq) + 6e− → 2Cr3+(aq) + 7H2O(l) | 1,33 |
| Cl2(g) + 2e− → 2Cl−(aq) | 1,36 |
| Ce4+(aq) + e− → Ce3+(aq) | 1,44 |
| MnO4−(aq) + 8H+(aq) + 5e− → Mn2+(aq) + 4H2O(l) | 1,49 |
| H2O2(aq) + 2H+(aq) + 2e− → 2H2O(l) | 1,78 |
| Co3+(aq) + e− → Co2+(aq) | 1,82 |
| S2O82−(aq) + 2e− → 2SO42−(aq) | 2,01 |
| O3(g) + 2H+(aq) + 2e− → O2(g) + H2O(l) | 2,07 |
| F2(g) + 2e− → 2F−(aq) | 2,87 |
COME POSSIAMO UTILIZZARE I POTENZIALI DI RIDUZIONE STANDARD?
- l’ossidazione del Ferro Fe→Fe+2 + 2e
- la riduzione del rame Cu+2 + 2 e → Cu
i potenziali di riduzione standard sono :