SCOPI DELLA TERMODINAMICA CHIMICA
In genere le reazioni chimiche avvengono con sviluppo o con assorbimento di calore: per esempio,la combustione è un tipo di reazione che avviene spontaneamente con sviluppo di calore (reazione esotermica), mentre esistono altre reazioni, come ad esempio la decomposizione di una molecola, che richiedono l’apporto di calore dall’esterno perché possano procedere (reazioni endotermiche).
Le leggi della termodinamica chimica forniscono i criteri con i quali è possibile prevedere, unicamente in base alla conoscenza delle proprietà macroscopiche del sistema, se una data trasformazione o reazione chimica possa o non possa realizzarsi spontaneamente.
I princìpi e le leggi della termodinamica, vengono dedotti da proprietà quali la temperatura, la pressione, la concentrazione ma occorre però tenere ben presente che la termodinamica, pur essendo capace di prevedere quale sia lo stato finale stabile di un sistema, non è in grado di fornire alcuna indicazione sulla velocità con cui il sistema stesso evolve dallo stato iniziale a quello finale.
COS’E’ UN SISTEMA ED UNA FUNZIONE DI STATO
Si intende per SISTEMA l’oggetto di una qualsiasi indagine sperimentale costituito da una porzione di materia : tutto ciò che non fa parte del sistema stesso è definito INTORNO o AMBIENTE.
Lo stato di un sistema può variare in seguito a un processo fisico o chimico (può ad esempio variare la temperatura, o la pressione, o le concentrazioni delle specie chimiche presenti), se i valori assunti dalle funzioni non dipendono dal modo con cui si è giunti allo stato finale a partire dallo stato iniziale le funzioni vengono dette FUNZIONI DI STATO.
Un sistema,inoltre, si dice in equilibrio quando le sue funzioni di stato rimangono inalterate nel tempo.
Una trasformazione di stato condotta a pressione costante viene detta trasformazione ISOBARA; condotta a volume costante viene detta trasformazione ISOCORA; condotta a temperatura costante viene detta trasformazione ISOTERMA.La trasformazione viene detta ADIABATICA quando il sistema non scambia calore con il suo intorno o ambiente.
CALORE E LAVORO
Calore e lavoro sono due forme dell’ energia di un sistema. Gli studi sul calore si devono inizialmente a Mayer , Von Helmhotz e Jaule ed i lavoro di Mayer e soprattutto quello di Jaule hanno permesso di comprendere la trasformazione del calore in lavoro e viceversa ed ha misurato il fattore di conversione tra le due forme, infatti:
1caloria =4,184 Jaule
Il lavoro è l energia scambiata tra due sistemi attraverso l’azione di una forza o una risultante di forze quando l’oggetto subisce uno spostamento e la forza ha una componente non nulla nella direzione dello spostamento.
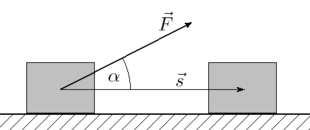
Come si vede per spostare l’ oggetto in figura occorre applicare una forza e quindi occorre effettuare un lavoro che viene definito
dove L è il lavoro e α l’angolo tra la direzione della forza e la direzione dello spostamento.
In termodinamica il lavoro è associato all’espansione o alla compressione di un gas.
Consideriamo ad esempio il sistema chiuso costituito da un gas entro un recipiente cilindrico chiuso da un pistone a perfetta tenuta e mobile senza attrito:
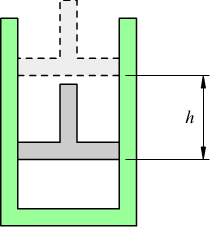
Nello stato iniziale il pistone si trova nella posizione 1 (in figura quella solida) e nello stato finale, caratterizzato da un maggior volume, nella posizione è quella tratteggiata. La trasformazione dallo stato 1 allo stato 2 può essere causata da una variazione della temperatura o dalla pressione esterna, o da una reazione chimica che sviluppa prodotti gassosi che spingono il cilindro verso l’alto.
Nel caso della figura vediamo che il pistone, per effetto della forza proveniente dal gas, sale di un’altezza h e siccome la superficie su cui è applicata la forza è A, il prodotto Axh rappresenta la variazione di volume dovuta alla pressione del gas cioè ΔV.Quando il pistone si ferma dopo espansione, significa che la pressione del gas all’interno del cilindro è uguale alla pressione esterna cioè alla pressione ambiente. Si deduce che
Lavoro= F x spostamento= pressione x variazione di volume =W =L = -PΔV
Il segno negativo si riferisce per convenzione al lavoro compiuto dal sistema.
Questa espressione quindi è valida quando si ha un’espansione rapida contro una pressione esterna quindi P= pressione esterna.
Tuttavia, quando il gas viene riscaldato in modo che uno stato successivo al precedente differisca solo di un infinitesimo (cioè in condizioni di reversibilità) allora la pressione è quella del gas non la pressione esterna per cui in questo caso non possiamo applicare la L=-PΔV ma dobbiamo sostituire a P il valore ricavato dall’equazione di stato dei gas P=nRT/V quindi:
L= -n RT dV/V
Ricorda ancore che il segno meno è, per convenzione, riferito al lavoro compiuto dal gas mentre in una compressione (lavoro compiuto sul gas) il segno è positivo.
Si può scrivere pertanto:
L= – ∫ RT dv/v = – RT ∫dv/v = -nRT ln V2 -lnV1= -nRTlnV2/V1
Poiché il lavoro è differente a seconda che si operi in condizioni di reversibilità oppure contro una pressione esterna costante si deduce che :
Il LAVORO NON È UNA FUNZIONE DI STATO !!!
IL CALORE
Il calore viene definito come il contributo di energia trasformata a seguito di una reazione chimica o nucleare e trasferita tra due elementi. E’ ben noto che il calore si trasferisce sempre da un corpo più caldo ad uno meno caldo e la misura del flusso di calore che si trasferisce rappresenta la TEMPERATURA.Pertanto CALORE E TEMPERATURA, pur essendo in relazione tra loro, non sono la stessa cosa!
Il calore quindi è una forma di energia che viene trasferita da un corpo ad un altro .
Per stabilire se il calore è una funzione di stato ricorriamo al primo principio della termodinamica
L’energia interna E di un sistema è la somma di tutte le forme di energia possedute da ogni singolo componente del sistema.
Essa è una funzione di stato ma non può essere misurata direttamente, in quanto è la somma delle energie cinetiche traslazionali, rotazionali e vibrazionali delle singole particelle costituenti il sistema (nuclei, elettroni, atomi, molecole) e delle energie potenziali associate alle forze esistenti tra tali particelle.
Pur non conoscendo il valore dell’energia interna di un sistema, è tuttavia possibile misurare la variazione di energia interna che accompagna la trasformazione di un sistema in base al primo principio della termodinamica, o principio della conservazione dell’energia.
In base a tale principio, l’energia di un sistema isolato (ossia di un universo) è costante. La variazione di energia interna ΔE che accompagna la trasformazione di un sistema chiuso dev’essere quindi compensata da una uguale variazione, ma di segno contrario, dell’energia del suo intorno o ambiente. Se indichiamo con Q la quantità di energia ceduta dall’ambiente al sistema sotto forma di calore e con L la quantità di energia ceduta dal sistema all’ambiente sotto forma di lavoro, la variazione di energia del sistema è pari a:
ΔE = Q – L che si può scrivere ΔE = Q – PΔV
In una trasformazione isobara (a pressione costante) abbiamo visto sopra che
L=-P(V2 -V1) quindi ΔE = Q – P(V2 -V1) E2 -E1 = Q – PV2 + PV1 da cui
(E2+PV2) – (E1 + PV1) = Q ma E+PV viene indicato con H (contenuto termico)
pertanto H2 -H1 = Q ΔH = Q
questo significa che in una trasformazione chimica si può sviluppare calore o che la reazione può avvenire con assorbimento di calore. Ogni molecola possiede un contenuto termico proprio. In una reazione chimica A+B → C + D
∑Hprodotti – ∑ H reagenti = ΔHreaz
Se effettuata la differenza tra i valori di H cioè se ΔH o meglio Q ha segno negativo, ciò significa che i prodotti hanno contenuto termico più basso dei reagenti e la reazione emette calore (reazione esotermica); se invece Q è positivo ciò significa che i prodotti hanno un contenuto termico maggiore e la reazione è endotermica cioè avviene assorbendo calore dall’esterno.
In una trasformazione a volume costante (come ad es.nelle reazioni chimiche in soluzione)
ΔV =0 quindi ΔE = Q- Px o cioè ΔE = Q . Ciò significa che se cediamo calore al sistema,in condizioni isocore, tutto il calore serve per aumentare l’energia interna del sistema.
Se operiamo a temperatura costante, questo non modifica l’energia del sistema per cui
ΔE= 0 pertanto Q= PΔV
Se operiamo in condizioni adiabatiche (cioè senza scambio di calore e di materia con l’esterno) si ha Q=0 pertanto ΔE= -P(V2-V1) ciò significa che il lavoro compiuto sul gas è utilizzato dal gas per aumentare la propria energia interna, viceversa, se il lavoro è compiuto dal gas esso avviene esclusivamente a spese dell’energia interna del gas.
Da quanto abbiamo esposto si evince che la quantità Q dipende dal tipo di trasformazione effettuato quindi
IL CALORE NON È UNA FUNZIONE TERMODINAMICA !!!
Tuttavia pur non essendo nè Q nè L funzioni termodinamiche, la loro somma che è ΔE invece è una funzione termodinamica perchè dipende esclusivamente dagli stati iniziale e finale.
CAPACITA’ TERMICA E CALORE SPECIFICO DI UNA SOSTANZA
Quando a un campione di materia viene fornita dell’energia sotto forma di calore, ad esempio ponendo il campione a contatto con un corpo più caldo,si osserva in genere un aumento della temperatura del campione stesso. Se nel corso del processo di trasferimento dell’energia non avvengono trasformazioni chimiche o cambiamenti di fase entro il campione, si trova che l’aumento di temperatura è proporzionale alla quantità del calore fornito.
Indicando con q il calore fornito e con ΔT l’aumento di temperatura, si ha quindi:
q = CΔT
e la costante di proporzionalità C viene detta capacità termica del campione. La capacità termica di una sostanza, pur potendosi considerare costante entro limiti non troppo estesi della temperatura, non è in realtà indipendente da quest’ultima, per cui essa è più esattamente definita come il rapporto tra la quantità infinitesima di calore trasferito dq, e la corrispondente variazione infinitesima di temperatura dT
C = dq/dT
Se il campione in esame è omogeneo, la sua capacità termica è proporzionale alla sua massa m, per cui, indicando con e la capacità termica specifica, o calore specifico, si ha:
q =c x m x ΔT
Se invece di considerare la massa consideriamo il numero n di moli del campione, la costante di proporzionalità assume il nome di capacità termica molare, o calore molare, e si indica con Cm, per cui:
q = Cm x n x T2 – T1
Per le sostanze solide o liquide, il cui volume non varia apprezzabilmente al variare della pressione, il valore del calore molare è praticamente indipendente dal tipo di trasformazione, isocora o isobara, subito dal campione; per le sostanze gassose invece il calore molare C. di una trasformazione isocora ( Cv)differisce notevolmente, come vedremo, dal calore molare C, di una trasformazione isobara (Cp) infatti
Cv= dq/dt= dE/dt mentre Cp= dH/dt
La dipendenza dei calori molari dalla temperatura può essere espressa dall’equazione:
C, = a + b•T+ c•T2 + d/T2
in cui i coefficienti a, b, c e d vengono ricavati per via empirica.
Lascia un commento