IL PH E POH DI ACIDI E BASI FORTI
(CHE SONO COMPLETAMENTE DISSOCIATI IN SOLUZIONE)
Gli acidi forti sono ad esempio HCl HNO3 H2SO4 HClO4 che in soluzione formano H+ -Cl- ; H+ + NO3- ; 2H+ SO4-2
H+ + ClO4- . In questi acidi la [H+] corrisponde alla Ca cioè alla concentrazione analitica dell’acido ad esempio se HCl = 10-3 M la [H+]= 10-3 se ad es HCl= 2,35 M la [H+] = 2,35 se HCl = 0,1 M [H+]= 0,1 cioè 10-1
Basi forti sono ad esempio NaOH LiOH KOH Ca(OH)2 che in soluzione formano ioni OH-
Nota che se viene richiesto il PH di una base come quelle indicate sopra OCCORRE PRIMA CALCOLARE [OH-] POI IL POH E QUINDI RICORDANDO CHE PH+POH=14 CALCOLARE IL PH=14-POH
1 calcolare il pH di una soluzione 0,01 M di NaOH
soluzione
sappiamo che : NaOH →Na+ + OH-
per cui la [OH-]=0,01 M = 10-2 M essendo NaOH una base forte.
Essendo una base è chiaro che dobbiamo calcolare POH =-log[OH-] e poi ricordando che PH+POH =14 possiamo calcolare il PH. Quindi POH = -log 10-2 da cui POH= – (-2) log 10 = 2 x1 ( essendo log10 10=1)
PH=14-POH = 14-2=12 che indica una soluzione fortemente basica.
2-Una soluzione di Ca(OH)2 ha un PH=11,5 calcolare la sua concentrazione.
soluzione
Calcolare la concentrazione di Ca(OH)2 significa conoscere [OH-] nella soluzione. Per ottenere questo dato ricordiamo che PH+POH=14 quindi POH= 14-11,5 =2,5 e pertanto [OH-]= 10-2,5
Per ottenere [OH-] occorre aumentare l’esponente sino al numero intero successivo quindi [OH-] = 10-3 quindi sottraiamo a 3 il numero 2,5 ed otteniamo 0,5 che però non è un numero ma un logaritmo di cui occorre calcolare il numero.
Se il log X = 0,5 significa che lo 0 è la caratteristica e 500 è la mantissa.
Cerchiamo sulla tavola dei logaritmi la mantissa 500 a cui corrisponde il numero 316 e considerato che la caratteristica è 0 allora il numero che corrisponde al logaritmo 0,5 è 3,16 .
Pertanto [OH-] = 3,16 x 10-3 M
Poichè per ogni molecola di Ca(OH)2 vi sono 2 di OH- allora la concentrazione di Ca(OH)2 è:
3,16 x 10-3 / 2 =1,5 x 10-3 M perché 2[OH-]= Conc.analitica di Ca(OH)2 pertanto
Ca(OH) 2 = 1,5 x 10-3 M>
3- Calcola la concentrazione degli ioni [OH-] in una soluzione acquosa avente una concentrazione idrogenionica [H3O+] = 10-3 M e stabilisci se questa soluzione è acida o basica.Riteniamo [H3O+]=[H+]
soluzione
Dal prodotto ionico dell’acqua:
Kw = [H+] [OH-] = 10-14
si ha:
[OH-]= Kw/[H+]
[OH-]= 10-14 / 10-3 =10-11
POH= -log[OH-] = -log 10-11 = – (-11)log 10 = 11
essendo PH+POH=14 PH= 14-11 = 3
Essendo la concentrazione [H3O+]=10-3 > 10-7, ed il PH della soluzione =3 quindi <7 la soluzione è ACIDA
4-Calcola la concentrazione degli ioni [H+] di una soluzione acquosa avente una concentrazione di ioni [OH-] = 1 x 10-6 M
soluzione
Dal prodotto ionico dell’acqua: Kw = [H+] [OH-] = 10-14 si ha [H+ ] =Kw /[OH-] perciò [H+ ] = 10-14 / 10-6 =10-8
PH= -log 10-8 = -(-8) log 10 = 8
essendo il PH > 7 la soluzione è BASICA
5- Calcolare il pH e il pOH di una soluzione la cui concentrazione idrogenionica è 4.56 X 10-4 M.
soluzione
pH = – Ig [H+] = -·Ig 4.56 x 10-4 (il log di un prodotto è uguale al prodotto dei logaritmi) perciò
PH= – Ig 10-4 – Ig 4.56 = 4 – 0.66 = 3.84
poiché:
[H “l [OH -] = 1 x 10-14
si ha:
pH + pOH = 14
e quindi
pOH = 14 – 3.34 = 10.66.
6-Il pH di una soluzione è 5.4. Calcolare [H+] e [OH-l·
soluzione
[H+j = 10-pH = 10-5,4 = 10-6 x (logx=0,6) essendo 6-5,4 = 0,6 (che è un logaritmo)
il numero a cui corrisponde il logaritmo pari a 0,6 (o è la caratteristica e 600 la mantissa) si ottiene cercando sulle tavole dei logaritmi la mantissa 600 cui corrisponde il numero 398 e poichè la caratteristica è zero, il numero +3,98
Pertanto [H+]= 3,98 x 10.6
Per calcolare [OH-] ricordiamo che
pH + pOH 14
pOH = 14 – 5.4 = 8.6
[OH-]= 10 -pOH= 10-8,6 = 10-9 X (log x= 0,4)
cerchiamo sulle tavole dei logaritmi la mantissa 400 e vediamo che corrisponde al numero 251 ed essendo la caratteristica pari a zero, il numero è 2,51 pertanto
[OH-] =2,51 x 10.9
7- Calcolare il PH ed il POH di una soluzione di acido perclorico 2,5 x 10 -2 M
soluzione
L’acido perclorico HClO4 è un acido forte completamente dissociato quindi [H+]= 2,5 x 10-2
PH= -log [H+] = – log 2,5 x 10-2 = 2 – log 2,5 = 2- 0,397= 1,60
Poichè PH+POH = 14 si ha POH = 14- 1,60= 12,4
8-calcolare il PH di una soluzione 2 x 10-3 M di NaOH
soluzione
Essendo NaOH una base forte, per calcolare il PH occorre prima calcolare POH dal valore di [OH-].
sappiamo che [OH-]= 2 x 10 -3 quindi POH =log 2 x 10-3 = 2 -log 2= 3-0,3 =2,7
Sapendo che PH+POH=14 allora PH = 14 -2,7= 11,3
9- Calcolare il POH di una soluzione di HClO4 2 M
soluzione
Essendo HClO4 un acido forte, occorre calcolare prima il PH e poi il POH pertanto :
[H+] = 2 quindi PH= -log2 = -0,3
POH = 14 -PH = 14 -(-0,3)= 14,3
Avrai notato che i valori di PH possono essere inferiori a zero così come il valore di POH può essere superiore a 14 .
ciò succede per valori di concentrazione superiori ad 1.
infatti se [H+]=1 PH= -log 1 =0 se [H+] = 1,1 PH= -log1,1= – 0,04 se [H+]= 1,5 PH= -log1,5=-0,176 ovviamente il POH è rispettivamente 14 14,04 14,176
CALCOLO DEL PH DI SOLUZIONI DI ACIDI E BASI FORTI MOLTO DILUITE IN CUI [H+] OPPURE [OH-] È INFERIORE A 10-7 CHE È LA CONCENTRAZIONE DEGLI STESSI IONI PROVENIENTI DALLA DISSOCIAZIONE DELL’ H2O.
Per un acido forte HA in soluzione acquosa si hanno le reazioni seguenti:
l’acido in acqua si dissocia HA + H2O → H3O+ + A- (1)
l’acqua stessa si dissocia 2 H2O<=> H3O+ + OH- (2)
la reazione 1 indica che l’ acido è completamente dissociato e l’H3O+ che da esso si forma, influisce sulla dissociazione dell’acqua che è regolata dalla relazione della sua costante di equilibrio
Kw= [H3O+] [OH-] (in quanto la [H2O] = 1000g/18 = 55,5 moli /litro ed è costante inglobata in Kw) e si deduce che
[H3O+]totale=[H3O+]acido + [H3O+] acqua
ricordando che [H3O+] acqua = [OH-] acqua = kw / [H3O+] avremo
[H3O+]totale=[H3O+]acido + kw/ [H3O+] totale
cioè [H3O+] ² – Ca [H3O+] – Kw = 0
questa equazione permette di calcolare esattamente la [H3O+] se Ca < 10-6 M .
Se Ca > 10-6 M il termine Kw/[H3O+] è trascurabile rispetto a Ca quindi l’equazione si semplifica in [H3O+]= Ca e quindi PH = -log Ca
Analogo discorso vale per una base forte infatti
[OH-]² -Cb[OH-]- Kw = 0
10- calcolare il PH di una soluzione di HCl 10-8 M
soluzione
questo esercizio vuol mettere in evidenza che essendo 10-8 una concentrazione molto bassa [H+]= 10-8
PH= -log 10-8 =8
E’ evidente che questo risultato è errato in quanto HCl è un acido mentre PH=8 corrisponde ad una sostanza basica.
Il problema è che essendo la concentrazione di H+ proveniente da HCl, più bassa di quella proveniente dalla dissociazione dell’acqua che è 10-7, si deve tenere in considerazione anche la [H+] di quest’ultima.
La [H+] totale è quindi [H+] acido + [H+] acqua quindi
[H+]tot = 1x 10-8 + 1 x 10-7 = 1,1 x 10-7
pertanto PH= -log 1,1 x 10-7 = 7 – log1,1 = 7 – 0,04 =6,96
questo è ovviamente il risultato corretto in quanto la soluzione risulta acida anche se molto vicina alla neutralità che è PH =7
La soluzione allo stesso problema può essere effettuata in modo più rigoroso ricordando che
H2O <==> H+ + OH- Kw=[H+] x [OH-]
Essendo un equilibrio, se aggiungiamo un acido (quindi H+) l’equilibrio si sposta verso sinistra perchè l’OH- dell’acqua tende a bilanciare gli H+ aggiunti per mantenere l’equilibrio costante.
Ovviamente anche dopo l’aggiunta di acido la soluzione deve essere elettricamente neutra per cui le cariche positive devono essere uguali a quelle negative infatti
[H+] = [Cl-] +[OH-] ricordando però che Kw=[H+] x [OH-] allora [OH-]= Kw/[H+] pertanto sostituendo
[H+] =[Cl-] + Kw/[H+] da cui si ha [H+]2 =[H+] [Cl-] + Kw quindi [H+]2 – [H+] [Cl-] – Kw =0
dove [Cl-] = Conc acido
Questa è un’equazione di secondo grado rispetto a [H+] e si risolve ricordando che
a X2 +bX + C=0 ha soluzione X= -b± √b2 – 4ac /2a
nel caso specifico si calcola [H+]2 – 1 x 10-8 [H+] -1 x 10-14 =0 essendo [Cl-]=1 x 10-8 pertanto
[H+]= 1 x 10-8 + √ (10-8)2 +4 x 1 x 10-14 /2 = 1 x 10-8+ √1o-16 + 4 x 10-14 / 2 =1 x 10-8+ √4,01 x 10-14 / 2
[H+]=1 x 10-8 + 2 x 10-7 / 2 = 2,1 x 10-7/2 = 1,05 x 10-7 =7-0,02 = 6,98
Il risultato è molto vicino a quello calcolato in precedenza.
11- calcolare il PH di una soluzione di HCl 10-7 M
soluzione
a prima vista, considerata la concentrazione pari a 10-7 , saremmo portati a dire che il PH è 7 .Tuttavia ricordiamoci che nell’acqua abbiamo una [H+] proveniente dalla sua dissociazione e che è [H+]= 10-7
Pertanto a questa concentrazione si aggiunge quella proveniente dall’acido (che in questo caso è 10-7) per cui la [H+] totale + data da [H+]acqua + [H+]acido pertanto [H+]totale= 1 x 10.7 + 1 x 10-7 = 2 x 10-7
quindi il PH = 7 -log 2 = / -0,30 = 6,7
Volendo effettuare un calcolo più accurato occorre considerare che, come abbiamo visto in precedenza,
[H3O+]² -Cax [H3O+] – Kw = 0
[H3O+] = (Ca ±√ Ca² +4 Kw ) / 2 pertanto, in questo caso si ha:
[H3O+] =( 1 x 10-7 + √ (1x 10-7)² +4 x 1 x 10-14 ) /2
[H3O+] =( 1x 10-7 + √ 10-14 + 4 x 10-14 )/2 = (1 x 10-7 + √ 5 x 10-14 ) /2
[H3O+] = (1x 10-7 + 2,23 x 10-7)/2 = 3,23/2 x 10-7 =1,615 x 10-7
PH= -log 1,615 x 10 -7 = 7 – log 1,65= 6,78
POH= 14 – 6,78 =7,22
12- Il POH di un acido forte HA è 7,22 calcolare la [H3O+] . Considerare [H3O+] = [H+]
soluzione
Poichè PH+ POH = 14 allora PH = 14- 7,22 = 6,78
[H+]= 10– 6,78 = 10-7 x (log x =0,22) troviamo sulle tavole dei logaritmi la mantissa 220 ed otteniamo il numero
165 e poichè la caratteristica è zero il numero è 1,65 .Pertanto [H+]= 1,65 x 10-7 M
COME CALCOLARE IL PH DI UNA SOLUZIONE SE NON È NOTA LA SUA CONCENTRAZIONE ?
NEI CALCOLI RELATIVI AL PH, RICORDIAMO CHE LA CONCENTRAZIONE DI UNA SOLUZIONE E’ SEMPRE ESPRESSA IN MOLI/LITRO.
pertanto se non è nota la Concentrazione analitica Ca,il quesito ci fornirà sempre i dati per poterla calcolare e poi potremo procedere con il calcolo del PH.
PERTANTO È FONDAMENTALE CALCOLARE LA MOLARITÀ DELLA SOLUZIONE PRIMA DEL CALCOLO DEL PH
12- calcolare il PH di una soluzione ottenuta sciogliendo 0,04 grammi di NaOH in 250 ml di acqua.
soluzione
essendo una base forte [OH-]= Cb però in questo caso Cb non è nota ma il quesito ci permette di calcolare la concentrazione in moli/litro che è necessaria per ottenere il POH e poi il PH.
Infatti essendo 40 il PMNaOH le moli di NaOH sono:
moli NaOH= 0,04 /40 =0,001 = 1 x 10 -3 moli. Queste moli sono sciolte in 250 ml di acqua e quindi in 1 litro (1000 ml) vi sono se in 250 ml vi sono 10-3 moli in 1000 ve ne sono X
250:10-3 = 1000 ; X X= 1/ 250 = 0,004 pertanto la Cb = 0,004 = 4 x 10-3 M
adesso possiamo calcolare il POH infatti [OH-]= 4 x 10-3 POH= 3 – log 4 = 3-0,6= 2,4
da cui PH= 14-2,4 = 11,6
13- Una soluzione di acido perclorico HClO4 ha un PH =3,47 . Calcolare la Molarità
soluzione
La molarità non è altro che il numero di moli in 1 litro di soluzione cioè GRAMMI / PESO MOLECOLARE in 1000 cc quindi dal PH dobbiamo risalire a [H+] che è espressa in moli/litro .
[H+]= 10 -3,47 = 10-4 (logx= 0,33) cerchiamo la mantissa sulla tavola dei logaritmi e notiamo che 330 corrisponde
al numero 338 quindi essendo la caratteristica zero il numero è 3,38 . Ne consegue che [H+]= 3,38 x 10-4 M che corrisponde alla molarità dell’acido infatti essendo un acido forte [H+]= Ca
Ca= 3,38 x 10-4 M
13 Il PH di 50 ml di una soluzione di KOH è 11,62 . Quanti mg di KOH sono sciolti in quei 50 ml?
soluzione
essendo KOH una base forte, calcoliamo il POH cioè POH=14-11,62= 2,38
essendo POH= 2,38 calcoliamo [OH-] = 10-2,38 cioè [OH-]= 10-3 x (log X=3-2,38=0,62)
[OH.]= 4,135 x 10-3 M cioè in 1000 ml vi sono 4,135 x 10-3 moli .
Pertanto in 50 ml vi sono 1000 ml : 4,135 x 10-3 moli =50 ml : X
Le moli contenute in 50 ml sono X= 50 x 4,135 x 10-3 /1000 = 0,00020674 moli = 0,20674 millimoli
poichè millimoli = mg/ PM per calcolare i grammi di KOH contenuti in 50 ml 0,20674 x 56,01 = 11,58 mg
CALCOLO DEI GRAMMI DI ACIDO O BASE NECESSARI
PER OTTENERE UN DATO PH
Il calcolo dei grammi di acido o base si può effettuare semplicemente ricordando che moli= grammi/peso molecolare, pertanto la prima cosa da fare è calcolare le moli da cui è semplice poi calcolare i gremmi.
13- calcolare quanti grammi di HNO3 sono necessari per ottenere una soluzione a PH 2,5 . Quanti grammi servono per preparane 1,47 litri?
soluzione
in questo caso [H+]= 10-2,5 = 10-3 (logx=0,5) [H+]= 3,16 x 10-3 M
significa che in 1000 cc (1 litro) vi devono essere 3,16 x 10-3 moli che corrispondono a
grammi = 3,16 x 10-3 x PM HNO3= 3,6 x 10-3 x 63,01 = 0,199 g
Quindi per 1 litro servono 0,199 grammi mentre per 1,47 ne servono 0,293 g
(infatti 1 l : 0,199 =1,47 :X X= 1,47 x 0,199/1 = 0,293)
Sarebbe quindi molto semplice preparare 1,47 litri di HNO3 , basterebbe pesare 0,293 g di HNO3 con una bilancia e versare i grammi in 1,47 litri di acqua. Ma purtroppo l’ HNO3 è un liquido non un solido! La pesata sarebbe complicata per cui conviene prelevare un certo volume di HNO3 che corrisponde a quei grammi.
Ma quale volume corrisponde a 0,293 grammi di acido?
Per ottenere il volume corrispondente ai grammi bisogna conoscere la densità, infatti
DENSITA’ = GRAMMI / VOLUME
DA CUI
VOLUME = GRAMMI / DENSITA’
Pertanto se la densità dell’acido è 1,12 grammi/ml significa che 1 ml di acido pesa 1,2 grammi.
Allora se prendendo 1 ml si prelevano 1,12 g quanti ml servono per prelevare 0,293 g di HNO3 da versare in 1,47 litri di acqua? cioè occorre risolvere la proporzione 1 ml : 1,12 g =Xml : 0,293 g
da cui X= 0,293/1,12 = 0,2616 ml occorre prelevare 0,262 ml e poi portare a volume 1,47 litri
Spesso però il composto originario contenuto nel recipiente da cui occorre prelevarlo non è al 100 % ma solitamente è contenuto con una percentuale ben definita, per cui nel calcolo che abbiamo effettuato sopra dovremo tenerne conto come nel quesito che segue:
CALCOLO DEI GRAMMI NECESSARI DI UN ACIDO (O BASE) E QUINDI DEL CORRISPONDENTE VOLUME DA PRELEVARE SE SI CONOSCE LA DENSITA’ E LA % DI ESSO NEL RECIPIENTE ORIGINARIO
Ti vengono dati in laboratorio i recipienti seguenti :
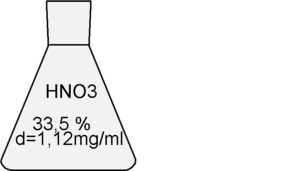
ti si chiede di preparare 1 litro di una soluzione di HNO3 con un PH= 1,3 ; cosa devi fare?
soluzione
se il PH deve essere 1,3 allora [H+] deve essere 10-1,3 cioè [H+] = 10-2 x (log x=0,7) da cui
[H+]=5 x 10-2 M (moli /litro) quindi in 1 litro di soluzione vi devono essere 5x 10-2 moli (0,05 moli)
0,05 moli corrispondono a o,o5= grammi/ peso molecolare quindi Grammi= 0,05 x 63,1 = 3,15 g di acido
Questa quantità dovrà essere prelevata dal beker che contiene HNO3 al 33% di densità 1,12 g/ml
Bisogna quindi prelevare un volume di HNO3 pari a 3,15 g ricordando che d= g/V perciò V=g/d quindi
V= 3,15/ 1,12 = 2,812 ml
Per preparare 1 litro di soluzione di HNO3 a PH= 1,3 sarebbe necessario prelevare 2,812 ml porre nel secondo beker e pertare il tutto ad 1 litro.
Ricordiamo però che l’HNO3 contenuto nel beker originario non è al 100 % HNO3 ma è solo a 33% quindi se prelevassi 2,18 ml, come giustamente calcolato, in realtà preleverei una quantità inferiore a quella necessaria, quindi :
se prelevassi 100 ml di acido al 33% preleverei in realtà 33 ml allora quanti ne devo prelevare per ottenere quanto me ne serve cioè 2,18 ml?
100: 33 = X: 2,18 da cui X = 2,18 x 100 /33 = 6,60 ml
Pertanto si devono prelevare 6,60 ml di acido al 33% di densità 1,12 g/ml da porre nel secondo beker e portare il tutto ad 1 litro.
14- Calcolare il PH che si ottiene sciogliendo 1,23 g di NaOH in 725 ml di H2O.
soluzione
Sappiamo che per calcolare il PH di una base come NaOH occorre prima calcolare[OH-] poi, noto [OH], si calcola il POH = -log[OH-] quindi il PH dalla PH+POH=14.
la [OH-] è sempre espressa in MOLI/Litro per cui nel caso del quesito
moliOH-= 1,23/ PMNaOH = 1,23 /40 = 0,03 = 3 x 10-2 moli
queste moli vengono sciolte in 750 ml e non in 1000 quindi
se in 750 ml sciogliamo 0,03 moli di NaOH in 1000 ne dovremmo sciogliere X
750:0,03 = 1000:X X= 0,03 x 1000/750 = 30 / 750 = 0,04 pertanto la [OH-] = 0,04 M (moli/litro)
il POH= -log 4 x 10-2 = 2 .log 4 = 2-0,60 =1,4
essendo POH= 1,4 PH = 14 – 1,4 = 12,60
15- occorre preparare 150 ml di acido cloridrico HCl con un PH = 2,5 avendo a disposizione HCl al 30 % di densità 1,13 g /ml. Quanti ml di acido occorre prelevare ?
soluzione
PH 2,5 significa che [H+]= 10-2,5 cioè [H+]= 10-3 x (log X=0,5) [H+]= 3 x 10-3 M
(moli /litro) che corrispondono a g= PM x moli = 0,003 x 36.5 = 1,095 g di HCl in 1 L
ciè significa che se dovessi preparare 1000 ml di acido partendo da acido puro al 100% dovrei prelevare 1,095 g di HCl e portare ad 1 litro. Tuttavia HCl è un liquido per cui il volume che corrisponde ad 1,095 g è calcolato dalla densità d= 1,13 g/ml (che significa che se si preleva 1 ml si preleverebbero 1,13 g) quindi
1 ml : 1,13 = X : 1,095 da cui X = 1,095 / 1,13 = 0,969 ml
Se avessi a disposizione HCl puro al 100% dovrei prelevare 0,969 ml di acido e portare a volume di 1000 ml.
Essendo però HCl al 30% è evidente che ne dovrò prelevare una quantità maggiore per avere la quantità che corrisponde a 0,969 ml infatti:
Se prelevando 100 ml in realtà è come se prelevassi 30 , allora quanti ml devo prelevare per avere il volume reale di 0,969 ml?
se 100 :30 = X : 0,969 X= 96,9/30 = 3,23 ml da portare ad 1 litro .
Così facendo preparerei 1 litro di HCl ,ma non devo preparane 1 litro bensì 150 ml, quindi, se per preparane 1000 ml devo prelevare 3,23 ml allora per preparare 150 ml ne dovrò prelevare X
1000:3,23 = 150;X X= 150 x 3,23 /1000 = 0,4845 ml
In conclusione, per preparare 150 ml di HCl a PH =2,5 partendo da HCl 30% d= 1,13 g/ml devo prelevare 0,485 ml e portarli ad un volume di 150 ml.
16- abbiamo 400 ml di una soluzione acido forte con un PH =2,7 e vogliamo preparare una soluzione dello stesso acido però con PH=3,5. Quanta acqua bisogna aggiungere?
soluzione
abbiamo inizialmente [H+] = 10-2,7 = 2 x 10-3 = Ca1
alla fine avremo [H+]= 10 -3,5 = 3,16 x 10-4 Ca2
uno dei principi che dobbiamo ricordare è che per una soluzione il prodotto
Volume in litri x Concentrazione = numero di moli oppure
Volume in millilitri x Concentrazione = numero di millimoli
ovviamente se diluiamo l’acido con acqua, cambierà il volume di liquido che aumenta, ma il numero di moli non cambierà. Tuttavia cambiando il volume, cambierà la concentrazione essendo la concentrazione il numero di moli / volume-
Pertanto nel nostro caso si ha:
V1 x Ca1 = V2 x Ca2 400 x (2 x 10-3 ) = X x ( 3,16 x 10-4) da cui si calcola il volume finale della soluzione perché si abbia una [H+] = 3,16 x 10 -4 cioè un PH=3,5
X= 400 x (2 x 10-3 ) / ( 3,16 x 10-4) = 2532 ml totali, quindi
l’acqua da aggiungere è 2532- 400= 2132 ml
questo quesito può essere risolto anche col metododel prodotto in croce infatti:
17 – si vogliono preparare 200 ml di una soluzione di HCl a PH=3,5 avendo a disposizione 400 ml di HCl a PH 2,7
soluzione
come nel caso precedente [H+] iniz= 2 x 10-2 M ed [H+]finale = 3,16 x 10-4 M.
Il metodo della croce
X
poniamo la conc iniziale in alto a sinistra e quella finale al centro della X
a sinistra in basso si pone la concentrazione dell’altro composto (in questo caso H2O ha Conc=0) .
Si sottrae la concentrazione che si vuole ottenere da quella in alto a sinistra (2×10-3) -(3,16 x 10-4) ed il risultato si scrive a destra in basso nella X
In alto a destra si scrive il risultato della differenza tra la concentrazione centrale e quella a sinistra in basso (0,000316 – 0) e si sommano i due risultati a destra(0,000316 + 0,0197 = 0,002
2 x 10-3 ————————> 0,000316
3,16 x 10-4
o ——————————-> 0,0 01684
_________________________________
totale 0,002
questo ci indica che i due liquidi vanno mescolati in rapporto 0,000316 parti del primo e 0,001684 parti del secondo per ottenere un volume di 0,02 (ml oppure litri a seconda di come esprimiamo i due termini)
questo significa che per ottenere 0,002 litri di soluzione a PH 3,5 occorre prelevare 0,000316 litri di HCl 0,02 M e mescolarlo con 0,001684 litri di acqua . Ciò e analogo a dire che per ottenere 2 litri occorre usare 1684 ml di acqua e 316 ml di acido iniziale . Ovviamente per ottenere 200 ml bisogna usare 168,4 ml di acqua e 31,6 ml di acido iniziale.
Se vogliamo sapere quanta acqua occorre aggiungere a 400 ml di acido PH2,5 per ottenere una soluzione a PH 3,7 basta fare la proporzione
se per 316 ml di acido devo usare 1684 ml di acqua per 400 ml ne dovrò usare X X= 400 x 1684 / 316= 2131,6
risultato identico a quello ottenuto col metodo precedente.
18- 10,2 ml di NaOH al 36% in massa di densità d= 1,39 g /ml vengono diluiti con acqua sino al volume di 300 ml. Quale sarà il PH della soluzione risultante?
soluzione
la densità 1,39 g/ml ci dice che ogni ml di soluzione pesa 1,39 g quindi se NaOH fosse al 100% nei 10,2 ml di NaOH vi sarebbero 1,39 x 10,2 g = 14,18 g. Tuttavia, NaOH non è al 100% ma al 36% quindi non vi sono 14,18 g ma il 36% di 14,18 g cioè se in 100 : 36 = 14,18 : X X= 5,1 g effettivi.
questi grammi sono contenuti in 300 ml ma la [OH-] deve essere sempre espressa in moli/litro quindi
se in 300 ml sono contenuti 5,1 g di NaOH in 1000 ve ne saranno X X= 5,1 x 1000 / 300 = 17 g di NaOH in 1 litro e ricordando che il PMNaOH =40
le moli in 1 litro sono quindi 17/ 40 =0,425 moli /l quindi [OH-]= 0,425 M POH = -log 0,425 = -log 4,25 x 10-1
POH = 1 -log 4,25 = 1-0,628 =0,372 PH= 14-0,372 =13,63
19- Calcolare la molarità di una soluzione di KOH con PH 13,24 .
Soluzione
[H+ ] =10-13,024 [H+] = 10-14 x (logX= 0,976) [H+] = 9,46 x 10-14
[OH-] = 10-14 / 9,46 x 10-14 = 1,106
20-Calcolare il PH di una soluzione 1,34 x 10-2 M di Ba(OH)2
Soluzione
Ogni mole di idrossido di Bario in soluzione immette 2 moli di OH- nell’acqua per cui
Ba(OH)2 - Ba+2 +2OH- pertanto [OH-] = 2 x 1,34 x 10-2 M = 2,68 x 10-2 M
POH= 1,57 PH= 14 –POH = 14- 1,57 = 12,43
PH RISULTANTE DAL MESCOLAMENTO DI 2 ACIDI
21- Qual è il PH risultante dal mescolamento di 250 ml di HCl 0,01 M e 100 ml di HClO4 0,05 M?
Soluzione
sappiamo che in ogni caso il PH = -log [H+] quindi l’obiettivo finale deve essere il calcolo di [H+] dopo il mescolamento.Pertanto ricordandoci che
volume in litri x M = moli e (volume in litri x Normalità= equivalenti) e quindi
volume in ml x Molarità = milliequivalenti allora si ha :
[H+] di Hcl prima della diluizione
250 ml x 0,01 M = 2,5mmoli (millimoli)
[H+]di HClO4 prima della diluizione
100 ml x 0,05 M = 5mmoli
Pertanto mescolando i due acidi abbiamo 2,5 mmoli provenienti da HCl e 5 mmoli provenienti da HClO4 in totale :
5 + 2,5 = 7,5 mmoli di H+ che sono adesso contenute in 250 ml + 100 ml di soluzione
Ne consegue che la [H+] finale è 7,5 mmoli in 350 ml di soluzione
Però sappiamo che ai fini del calcolo del PH, la [H+] deve essere espressa in
moli /litro quindi se in 350 ml vi sono 7,5 millimoli (cioè 0,0075 moli) in 1 litro (1000 ml) ve ne sono X
350:0,0075 = 1000 : X da cui X= 0,0075 x 1000 /350 =0,0214 Moli in 1 litro
Quindi [H+] finale = 2,14 x 10-2 M
Adesso possiamo calcolare il PH della soluzione risultante :
PH= -log [H+]= -log 2,14 x 110-2 = 2 – log 2,14 = 2-0,33=1,67
PH= 1,67
22-Quanto HClO4 0,05 M occorre aggiungere a 250 ml di HCl 0,01 M perché la soluzione risultante abbia un PH =1,67 ?
Il quesito è l’inverso del precedente, infatti
Se PH=1,67 allora [H+] = 10-1,67 = 2,146 x 10-2
Ciò significa che in 1000 ml vi devono essere 0,02146 moli di H+
ricordando che volume x conc= volume x conc
e sapendo che le moli alla fine dovranno esere 0,02146 moli /l
il volume di acido da aggiungere è:
0,02146 ( 250+X) = 0,01 x 250 +0,05X
5,35 + 0,02146 X = 2,5 + 0,05 X
2,85 +0,02146 X = 0,05 X
2,85 = 0,0285 X
X= 100 ml
23-Calcola il PH di una soluzione ottenuta sciogliendo 11,6 mg di KOH in 50 ml di acqua.
Soluzione
L’obiettivo è che calcolare [H+] che deve essere espresso sempre in moli/litro. Nel caso nostro però abbiamo aggiunto OH- in soluzione visto che si tratta di una basequindi dobbiamo calcolare la [OH-] in moli litro. Pertanto il primo passo è calcolare le moli di [OH-] cioè moli= grammi / Peso molecolare o come nel caso nostro millimoli= miligrammi /Peso molecolare
Moli = 11,6 / 56,10 = 0,267 mmoli queste sono sciolte in 50 ml tuttavia la [OH-] deve essere espressa in moli/ litro quindi 0,267 millimoli = 0,000267
Se in 50 ml vi sono 0,000267 moli in 1000 ve ne sono X
50: 0,000267 = 1000 / 50 da cui moli/litro = 0,267/50 = 4,135 x 10-3
Possiamo adesso calcolare POH infatti POH = -log [OH-]= – log 4,135 x 10-3
POH= 3- log 4,135 = 3- 0,616 = 2,38
Noto il POH possiamo calcolare il PH dalla relazione PH+POH=14
Pertanto PH= 14 -2,38 = 11,62
La stessa soluzione si può ottenere ricordando che [H+] [OH-] = 10-14
Pertanto una volta calcolata [OH-] = 4,135 x 10-3 moli/l
Quindi [H+] = 10-14 / 4,135 x 10-3 = 2,418 x 10-12 moli/l
PH = -log 2,418 x 10-12 = 12 – log 2,418 = 11.62
24- Quanti ml di HCl al 37% in massa la cui densità è d= 1,185 g/ml si devono utilizzare per preparare 600,0 ml di soluzione con un PH= 0,60
soluzione
il primo passo è calcolare la [H+] ricordando che [H+] = 10 –PH quindi
[H+]= 10-0,6 = 0,251 moli/litro
Pertanto nella soluzione vi devono essere 0,251 moli in 1 litro quindi in 600 ml vi devono essere X moli
1000: 0,251 = 600 : X X= 0,251 x 600 /1000 = 0,1506 moli
Dobbiamo conoscere i grammi di HCl quindi sappiamo che
moli=grammi/Peso Molecolare grammi= 0,1506 x PM = 0,1506 x 36,46 = 5,491 g
tuttavia, abbiamo a disposizione un liquido e quindi dobbiamo utilizzare un volume di liquido corrispondente a 5,491 g e ciò è possibile ricordando che
densità = grammi/volume quindi volume = grammi/densità pertanto
volume = 5,491/ 1,185 = 4.633 ml
Naturalmente questo volume si dovrebbe versare in 600 ml ma l’acido è al 37,27%
Quindi se prelevando 100 ml ne prelevo in effetti 37,27 ml quanti se ne devono prelevare per averne in realtà 4,911 ml?
100 : 37,27 = X : 4,911 X= 463,3 /37,27 = 12,43 ml
Pertanto si devono prelevare 12,43 ml e portare a volume sino a 600 ml
Cioè si devono usare 600-12,43= 587,56 ml di H2O
CALCOLO DEL PH QUANDO UN ACIDO VIENE AGGIUNTO AD UNA BASE
Supponiamo di avere 100 ml di HCl 0,1 M in un beker e di aggiungere 100 ml di NaOH 0,1M . Ovviamente, dobbiamo conoscere ciò che avviene in soluzione in seguito al miscelamento di HCl ed NaOH . Sappiamo che quando un acido reagisce con una base si forma sempre
un sale + acqua:
ACIDO + BASE –> SALE +ACQUA
Na+ + OH- + H+ + Cl- –> Na+ + Cl- + H2O
In realtà la reazione formale sarebbe NaOH+HCl= NaCl + H2O
Però dobbiamo ricordare che NaCl in soluzione esiste sempre sotto forma di ioni Na+ e Cl-
Per quanto riguarda il calcolo del PH è ovvio che
se ad HCl aggiungiamo una quantità in moli di NaOH uguale a quella di HCl il PH risultante è quello dell’acqua in quanto agli ioni H+ ed OH- provenienti dalla dissociazione dell’acqua aggiungiamo quantità di H+ provenienti dall’acido in quantità uguali ad OH- proveniente dall’aggiunta di NaOH per cui il PH dell’acqua non si modifica e quindi è PH=7 . Se dopo il mescolamento di NaOH ed HCl si ha
NaOH in eccesso rispetto ad HCl allora la soluzione sarà basica,
se invece è HCl ad essere in eccesso la soluzione sarà acida.
Per comprendere quale specie tra HCl ed NaOH è in eccesso occorre calcolare le moli dalla relazione :
volume(in litri) x Molarità = Numero di Moli oppure
Volume (in ml) x Molarità = Numero di millimoli
Pertanto nel caso del quesito posto sopra si ha:
PER HCl
100 ml x 0,1 = 10 millimoli di HCl
PER NaOH
100 ml x 0,1 = 10 millimoliNaOH
Come si vede le moli di HCl ed NaOH sono in quantità uguali quindi il PH della soluzione è PH =7 che deriva dalla dissociazione dell’acqua.
Vediamo adesso come sarà il PH se a 100 ml di HCl 0,1M aggiungiamo 75 ml di NaOH
Avremo allora :
100 ml x 0,1 M = 10 millimoli (mmoli) di HCl
75 ml x 0,1 M = 7,5 millimoli (mmoli) di NaOH
In questo caso HCl è contenuto in quantità maggiore, ma delle 10 mmoli iniziali, 7,5 reagiscono con NaOH per formare NaCl e rimangono in eccesso 2,5 millimoli di HCl.
Pertanto la [H+] della soluzione è di 2,5 mmoli in un volume che però adesso è 175 ml (100 ml provenienti da HCl e 75 ml provenienti da NaOH cioè un volume di soluzione pari a 175 ml).
Poiché, però, sappiamo che nel calcolo del PH bisogna usare [H+] in moli litro allora dobiamo fare la seguente proporzione:
Se in 75ml vi sono 2,5 millimoli ovvero 0,0025 moli di H+ allora in 1000 ml (1 litro) ve ne saranno X
75:0,0025 = 1000 :X X= 0,0025 x 1000/ 75 =0,03 moli/litro
Perciò la nuova concentrazione di H+ è [H+]= 0,03 M
Il PH sarà quindi PH = -log [H+]= -log 3 x 10-2 = 2- log 3 =2- 0,477 = 1,523
Ricordiamo che il PH iniziale è calcolabile da PH= -log [H+] = -log 0,1 = -log 10-1 =1
Pertanto l’aggiunta di NaOH fa diminuire H+ e quindi il PH aumenta e da 1 diviene 1,523
Vediamo cosa succede adesso se aggiungiamo 125 ml di NaOH
Sappiamo che le millimoli di HCl sono 10mmoli
Per NaOH le millimoli sono 125 x 0,1 = 12,5 quindi di queste 12 mmoli 10 servono per la reazione con 10 mmoli di HCl e nella soluzione rimangono 2,5 millimoli di NaOH in eccesso.
In questo caso si ha [OH-] = 2,5 mmoli si trovano in un volume di 100 + 125 ml coè 225 ml di soluzione
Pertanto la nuova concentrazione che in questo caso è[OH-] è data da
225 ml : 0,0025 moli di NaOH = 1000 ml : X
X = 2,5 /225 = [OH-]= 0,01 M pertanto POH = -log[OH-] = -log 0,01 = -log 10-2 = 2
Il PH sarà quindi, essendo PH+POH=14, PH= 14- 2 = 12
Come si vede il PH una volta neutralizzato tutto l’acido aumenta esponenzialmente diventando fortemente basico
Lascia un commento