ESERCIZI SULLA f.e.m. DELLE PILE
1-Calcolare la fem della pila Zn/zn+2 0,01 ||Pb+2 0,06 M/Pb
E°zn= -0,76 V
E°Pb = -0,13 V
pertanto Ezn = -0,76 + 0,06/2 log 10-2 = -0,76 -2 x 0,06/2 = 0,76 – x -2 x 0,03
Ezn=- 0,76-0,06 = – 0,82 V
EPb= -0,13 + 0,06/2 log 6 x 10-2 = – 0,13 – 0,06 log 6 = -0,13 -0,047 =- 0,177 V
f.e.m. = Ecat – Ean= Epb
il catodo è l’elettrodo diPb in quanto E=- 13 è più positivo dell’elettrodo di Zn E°= -0,176
quindi f.e.m. = EPb- EZn
fem= -0,177 -(-0,82)= 0,64 V
2 Indicare gli schemi dei semielementi formati dalle seguenti semireazioni e scrivere la corrispondente equazione di Nernst:
a) 2H3O+ + 2e- → H2 (g) + 2 H2O
b) Al3+ + 3e- → Al(s)
c) O2(g) + 4 H3O+ + 4e- → 6 H2O
d) MnO4- + 5e- + 8 H3O+ → Mn2+ + 12 H2O
soluzione
a) per l’elettrodo ad idrogeno sappiamo che E°=0 per convenzione
Pt (H2 (g))/ H3O+ EH3O+/H2= 0 + 0,06/2 log [H3O+]² / PH2
b) Al/Al+3 EAl3+/Al = E°Al3+/Al + 0,06/3 log [Al+3]
c) Pt [O2 (g)]/H3O+ EO2/ H2O = E°O2/ H2O + 0,06/4 log Po2 [h3O+]²
d) Pt /MnO4-, Mn2+, H3O+
E MnO4-/Mn+2 = E° MnO4-/Mn+2 + 0,06/5 log [MnO4-][H+]8 / [MN+2]
3- Calcolare il potenziale dei seguenti semielementi:
a) Pt /SnCl2 0,10 M, SnCl4 0,010 M E°Sn4+/Sn2+ = 0,13 V
Sn4+ + 2e- → Sn2+ ESn4+/Sn2+ = E°Sn4+/Sn2+ +0,06/2 log[Sn+4]/[Sn+2]
ESn4+/Sn2+ = 0,13 +0,06/2 log 0,01/0,1 =0,10 V
b) Ni /NiCl2 0,010 M E°Ni2+/Ni = -0,25 V
Ni2+ + 2e- → Ni
ENi2+/Ni = E°Ni2+/Ni +0,06/2 log[Ni2+] = -0,25+0,06/2 log 0,01 = 0,31 V
c) Ni /NiS (sol. satura) E°Ni2+/Ni = -0,25 V Kps NiS = 1,0 x10-22
NiS(s)→ Ni2+(aq)+S2-(aq) Kps= [Ni2+][S2-]=s2 [Ni2+] = s =√Kps=√1,0 x10-22
Ni2+ + 2e- →Ni
ENi2+/Ni = E°Ni2+/Ni + 0,06/2 log[Ni+2]=-0,25+ 0,06/2log 10-11 = 0,575 V
f.e.m = E°(pila) – 0,059x logQ
dai valori di E°Zn =-0,76 V e E°Au = 1,498 V
0 = 2,258 V – 0,059/6 * log(Keq)
log(Keq) = 229,63
5- Calcoliamo la costante di equilibrio relativa alla dismutazione Cu+(aq) → Cu(s) + Cu2+(aq) a 298 K, sapendo che
E°(Cu+/Cu) = +0,520 V
E°(Cu2+/Cu) = +0,340 V
La dismutazione è la somma delle seguenti due semireazioni
Riduzione Cu+(aq) + e– → Cu(s)
Ossidazione Cu+(aq) → Cu2+(aq) + e–
per calcolare la Keq è necessario conoscere il potenziale di riduzione della coppia redox Cu2+/Cu+ combinando opportunamente i due potenziali noti. Se consideriamo la reazione
Cu+(aq) → Cu2+(aq) + e– possiamo notare che è possibile ottenerla sommando le due reazioni viste sopra
1[Cu2+ + 2e → Cu E° = + 0,340 V
2[Cu → Cu+ + e = E° = – 0,520 V( la reazione è una ossidazione)
Cu2+ + e → Cu+
Moltiplichiamo ciascun potenziale per il numero di elettroni della relativa semireazione e sommando
(+ 0,340 x 2) + (- 0,520 x 1) = + 0,160 V
Il potenziale così ottenuto va diviso per il numero di elettroni della semireazione finale
E°(Cu2+/Cu+) = + 0,160 : 1 = 0,160 V
Ora possiamo calcolare il potenziale in condizioni standard della reazione complessiva di dismutazione come differenza tra il potenziale di riduzione della reazione catodica (semireazione di riduzione) e di quella anodica (semirazione di ossidazione)
E°Pila = E°cat – E°an = 0,520 – 0,160 = + 0,360 V
La costante di equilibrio è data da :
0 = E° pila x 0,0591/n log Keq logKeq=n(E°pila) / 0,0591 n=1
log keq= 0,360/0,0591 = 6,1
Keq=1,26 x 106
6-Calcoliamo la costante di equilibrio relativa alla dismutazione
3 ClO–(aq) → 2 Cl–(aq) + ClO3–(aq)
in ambiente basico a 298 K, sapendo che il potenziale standard delle seguenti semireazioni di riduzione
ClO3–(aq) + 3H2O + 6e- → Cl– + 6OH– E°( ClO3–/ Cl–) = + 0,62 V
ClO–(aq) + H2O + 2e- → Cl– + 2OH– E°( ClO–/ Cl–) = + 0,89 V
La dismutazione è la somma delle seguenti due semireazioni
Riduzione 2ClO–(aq) + 4e- → 2Cl– E° = + 0,89 V
Ossidazione ClO–(aq) → ClO3– + 4e E° = sconosciuto
Dobbiamo calcolare il potenziale di riduzione della coppia redox ClO3–/ ClO– , che caratterizza la semireazione di ossidazione, combinando opportunamente i due potenziali noti. La semireazione di riduzione desiderata si può ottenere come somma delle seguenti due semirazioni
ClO3–(aq) + 3H2O + 6e- → Cl– + 6OH– E° = + 0,62 V
Cl– + 6OH– → ClO–(aq) + H2O + 2e E° = – 0,89 V (il segno è cambiato perché è un’ ossidazione)
────────────────────────
ClO3–(aq) + 2H2O + 4e- → ClO– + 4OH– E° = [(0,62 x 6)+(-0,89 x 2)] / 4 = 0,485 V
Il potenziale della coppia redox ClO3–/ ClO– si ottiene sommando i potenziali delle due semireazioni ciascun potenziale moltiplicato per il numero di elettroni della relativa semireazione. Il potenziale così ottenuto va diviso per il numero di elettroni della semireazione-somma (4 elettroni)
Ora possiamo calcolare il potenziale in condizioni standard della reazione complessiva di dismutazione come differenza tra il potenziale di riduzione della reazione catodica (semireazione di riduzione) e di quella anodica (semirazione di ossidazione)
E°cat – E°an = 0,89 – 0,485 = + 0,405 V
Essendo il numero di elettroni scambiati nella reazione bilanciata di dismutazione pari a n = 4, la costante di equilibrio varrà
log Keq = 4 x 0,405 /0,0591 = 27,41

Keq= 1,29 x 1027
7- Quando l’ossigeno esercita la sua azione ossidante, esso può ridursi ad acqua ossigenata (O2→H2O2), e questa poi ad acqua (H2O2 →HzO), oppure ridursi direttamente ad acqua (O2→H2O). Noti i valori dei potenziali standard E°O2/H2O2, = 0,682 V ed E°H2O2/H2O = 1,776 V, si calcoli il valore del potenziale standard della riduzione diretta E° O2 /H,O .
Le semireazioni sono:
O2+2H3O++2e →H2O2+2H2O (Eo=O,682 V)
H2O2+2H3O+ +2e → 4H2O (Eo= 1,776 V)
sommando ambedue le reazioni:
O2+4H3O+ +4 e → 6H2O E°x= ?
che è la riduzione diretta e l’energia di quest’ultima è quindi la somma delle energie delle semireazioni
ΔG°ultima reazione = ΔG°prima semireazione + ΔG° seconda semireazione
sappiamo però che -ΔG° = nFE°
quindi
[ – 2 x F x 0,682] – [2 x F x 1,774] = = – 4x Fx E°x
da cui
E°x = 1,23 V
7- Alla temperatura di 25,0 °C, la I.e.m. della pila
Pt(Cl2) / Cl- || Cu+2 /Cu
(pCl2 = 1 atm) [Cl-] = 0,001M [Cu+2] = 0,1M
ΔE = 1,256 V. Calcolare la costante dell’ equilibrio Cl2+ Cu <=>2Cl- + Cu2
sappiamo che logKeq= n(Eox-Erid) / 0,0591
essendo Eox-Erid= f.e.m Epila ed essendo Epila= 1,256 V si ha
1,256= [E° Cl2/2Cl- -0,0591 x log 10-3 ] – [E°Cu+2/Cu + 0,0591\/2 log 10-1 ] da cui
E° Cl2/2Cl- – E°Cu+2/Cu =1,049V
log Keq = 2 x 1,049 / 0,0591 = 35,50
Keq= 3,2 x 10-35
6- Stimare la stabilità dell’acqua in condizioni standard a pH = 7 e a pH = 3, considerando le due semireazioni.
(Stabilità dell’acqua significa la tendenza che ha l’H2O a scindersi nei suoi due componenti cioè O2 ed H2). Sappiamo che:
O2 + 2H2O + 4e →4OH– E°(O2/OH–) = + 0,401 V
2H+ + 2e → H2 E°(H+/H2) = 0 V
soluzione
Il potenziale della prima semireazione è dato in condizioni standard e quindi per [OH–] = 1 M e dunque un pH = 14. La dipendenza di tale potenziale dal pH per 1 atm di pressione è
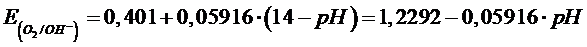
Il potenziale della seconda semireazione è dato in condizioni standard e quindi per [H+] = 1 M e dunque un pH = 0. La dipendenza di tale potenziale dal pH per 1 atm di pressione è
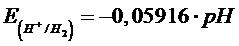
Al variare del pH i due potenziali variano quindi nello stesso modo (al crescere del pH decrescono) e della stessa quantità (una variazione di 0,05916 V per ogni punto di pH)
La prima semireazione manterrà dunque a qualsiasi pH un potenziale superiore alla seconda e quindi la prima si ridurrà a spese della seconda che si ossiderà.
La reazione spontanea complessiva sarà
Riduzione O2 + 2H2O + 4e → 4OH– +
Ossidazione 2H2 → 4H+ + 4e
──────────────────────────
Totale O2 + 2H2 → 2H2O
Infatti 4H+ +4OH- del secondo membro è ugale a 2H2O che si semplifica con 2H2O del primo membro
Il potenziale complessivo (potenziale di cella) è indipendente dunque dal pH
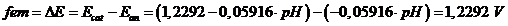
La costante di equilibrio della reazione totale sarà
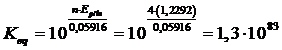
Il potenziale della reazione opposta, avrà lo stesso valore ma segno opposto
2H2O → O2 + 2H2 E = – 1,2292 V
La costante di tale equilibrio, che ci informa della tendenza dell’acqua a scindersi negli elementi che la costituiscono (e quindi della sua stabilità), è
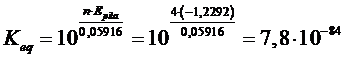
che è così piccolo da poter dire che l’acqua non ha praticamente alcuna tendenza a scindersi negli elementi che la costituiscono.
8- Indicare gli schemi dei semielementi formati dalle seguenti semicoppie redox e scrivere la corrispondente equazione di Nernst:
a) 2 H3O+ + 2e- → H2 (g) +2 H2O
schema : Pt (H2 (g))/ H3O+ H3O+/H2
Nernst: EH3O+/H2= 0,059/2 log [H3O+]² /PH2
b) Al3+ + 3e- →Al(s)
schema :Al/Al3+
Nernst : EAl3+/Al = E°Al3+/Al + 0,059 /3 log [Al+3]
c) O2(g) + 4 H3O+ + 4e- → 6 H2O
schema :Pt (O2 (g))/H3O+
Nernst: EO2/ H2O = E°O2/ H2O + 0,059/4 logPO2 [ H3O+]²
d) MnO4- + 5e- + 8 H3O+ →Mn2+ + 12 H2O
schema: Pt /MnO4-, Mn2+, H3O+
Nernst :
EMnO4-/Mn+2 =E°MnO4-/Mn+2 + 0,059/5 log[MnO4-] [H3O+]8 / [Mn+2]
7- Calcolare la f.e.m. delle seguenti pile:
a) Fe/Fe2+ 0,10 M ||Fe2+ 0,50 M; Fe3+ 0,050 M /Pt
sapendo che :
E°Fe2+/Fe= -0,44 V
E°Fe3+/Fe2+ = 0,80 V
al polo positivo si ha
Polo + Fe3+ + e- →Fe2+
Epolo + = EFe3+/Fe2+ = E°Fe3+/Fe2+ +0,059 log[Fe+3]/[Fe+2]
Epolo + = = 0,80+0,059log 0,05/0,5 = 0,74 V
Al polo negativo si ha :
Polo neg. – Fe2+ + 2 e- → Fe
Epolo –= EFe2+/Fe= E°Fe2+/Fe + 2 +0,059 log[Fe2+] = -0,44 + 0,059/2 log0,1= -0,47 V
Epila = Ep0lo+ – Epolo-
Epila = 0,74-(-0,47)= 1,21 V
b) Pt (H2 p = 1,0 atm) / H2SO4 0,050 M || AgNO3 0,10 M/Ag
E°Ag+/Ag = 0,80 V
al polo positivo
Polo + Ag+ + e- →Ag
E+= EAg+/Ag = E°Ag+/Ag + 0,059 log[Ag+]= 0,8 + 0,059 log 0,1= 0,74 V
al polo negativo
Polo – 2 H3O+ + 2e- → H2 (g) + 2 H2O
PH2=1,0 atm [H3O+]=2H2SO4= 2×0,05 = 0,1 M
E° H3O+/H2-= 0
Epolo neg = EH3O+/H2= 0,059/2 log[H3O+]² / PH2
Epolo neg= 0,059log[H3O+]= 0,059 log0,1= –0,059 V
Epila = Epolo p0sitivo – Epolo negativo = 0,74-(-0,059)= 0,80 V
c) Pt (H2 p = 2,0 atm) /CH3COOH 0,10 M || AgCl(sol. satura) /Ag
E°Ag+/Ag = 0,80 V ⇄
Ka= 1,8 x10-5 Kps AgCl = 1,5 x10-10
il polo positivo è
Polo + Ag+ + e- → Ag
AgCl(s) ⇄ Ag+(aq) + Cl-(aq) da cui si evince
[Ag+] = [Cl-] = √ Kps poichè Kps = [Ag+][Cl-]=S2
[Ag+] = s = √ Kps =√1,7 x 10-10=1,3×10-5 M
pertanto
Epolo+= EAg+/Ag = E°Ag+/Ag + 0,059l og[Ag+]= 0,8 + 0,059 log 1,3×10-5= 0,51 V
il polo negativo è:
Polo – 2 H3O+ + 2e- → H2 (g) + 2 H2O
PH2=2,0 atm E° H3O+/H2= 0
CH3COOH + H2O ⇄CH3COO- + H3O+ [H3O+] =√Kax Ca =√1,8 x 10-5 x 0,1 = 1,3 x 10-3
Epolo neg -= EH3O+/H2=0,059/2 log (1,3 x 10-3)²/2 = 0,059 log 0,1= -0,15 V
Epila = E+- E-= 0,51-(-0,15)= 0,66 V
8- Calcolare quale deve essere la concentrazione dello ione Ag+ perché la f.e.m. della pila sia pari a
zero, sapendo che E°Fe+3/Fe+2 = 0,74 V; E°Ag+/Ag = 0,80 V.
soluzione
La Pila è : Pt | [Fe+3] =[Fe+2] = 0,10 M || [Ag+] = x | Ag
Al Polo positivo+ Ag+ +e- →Ag
E=E° Ag+/Ag + 0,059 log[Ag+]
al polo negativo Fe3+ + e- → Fe2+
E polo+= E°Fe3+/Fe2+ +0,059log[Fe+3]/[Fe+2] ma essendo [Fe3+]=[Fe2+] =0,1 M
Epolo+ = E°Fe3+/Fe2+ =0,74 V
Epila= Epolo positivo – Epolonegativo
in questo caso Epila = O= Epolo positivo – Epolo negativo da cui Epolopositivo=Epolo negativo
pertanto E° Ag+/Ag + 0,059 log[Ag+] = E°Fe3+/Fe2+ =0,74 V
log[Ag+] =(E°Fe3+/Fe2+ – E° Ag+/Ag) / 0,059
log [Ag+]= 0,74- 0,8/ 0,059 = -10.1 V
[Ag+]=10-10,1=9,7×10-11 M
9- La forza elettromotrice della seguente pila a concentrazione:
Ag /AgBr (sol. satura); KBr 0,10 M || AgNO3 0,10 M / Ag
è pari a 0,605 V.
Calcolare la solubilità ed il prodotto di solubilità del bromuro di argento.
soluzione
sia al polo positivo che a quello negativo la reazione è Ag+ +e → Ag
Epolo positivo=E°Ag+/Ag + + 0,059 log[Ag+]
Epolo negativo = E°Ag+/Ag + + 0,059 log[Ag+]/[Ag+]
Epila = Epolo positivo – polo negativo
Epila = (E°Ag+/Ag + + 0,059 log[Ag+] ) – ( E°Ag+/Ag + + 0,059 log[Ag+])
Epila = 0,059 log[Ag+]polopositivo /[Ag+]polonegativo
0,059[Ag+]polonegativo = 0,059log[Ag+]polopositivo – Epila da cui
log[Ag+]polo neg = ( 0,059log[Ag+]polopositivo – Epila ) /0,059
log[Ag+]polo neg = ( 0,059 log o,1- 0,605 )/0,059 = 10,3
[Ag+]= 10-10,3 = 5,0 x 10-11 M
AgBr(s) ⇄ Ag+(aq) + Br-(aq)
Kps= [Ag+][Br-] ma [Br-]=0,1 M
Kps= [Ag+][Br-]=5,0 x 10-11 x 0,1= 5,0×10-12
11- A 25° C, la seguente pila ha una f.e.m. di 0,569 V:
Ni/Ni2+ 0,250M || Cu2+ 0,050 M/Cu
11Calcolare la costante di equilibrio della reazione di ossidoriduzione che si instaura in tale pila
(R = 0,0821 atm.l.K-1= 8,31 J .K-1 F= 96500 C) .
soluzione
Polo positivo Cu2+ + 2e- →Cu
Epolo positivo+=ECu2+/Cu = E° Cu2+/Cu + 0,059/2 log[Cu2+]
Polo negativo Ni2+ + 2e- →Ni
Epolo neg= ENi2+/Ni = E°Ni2+/Ni +0,059/ 2 log[Ni2+]
Epila= Epolo positivo – Epolo negativo
Epila= (E° Cu2+/Cu + 0,059/2 log[Cu2+] ) – ( E°Ni2+/Ni +0,059/ 2 log[Ni2+] )
Epila = E°pila + 0,059/2 log [Cu+2]/[Ni+2]
in questa espressione l’incognita è E°pila che peò può essere calcolata da
Epila – 0,059 log [Cu+2]/[Ni+2]
Epila= 0,059/2 log 0,05/0,25
Epila = 0,59V
dalla relazione -nFEpila = – RTlnKeq quindi nFEpila=RTlnKeq
lnKeq= nFEpila/ RT ln Keq = 2 x 96500 x 0,59 / 8,31 x 298
lnKeq= 45,98 da cui
Keq =e 45,98
Keq= 9,3 x 1019
12 -una pila ZnSO4 1M || H2/H+x /Pt ha f.e.m.=0,63 V. Calcolare il PH E° Zn/Zn+2 =-0,76 V
soluzione
Epila = E polo poitivo- E polo negetivo
Epila= EH2/H+ – E Zn/Zn+2
0,63 = 0,06/2log[H+]² – (-0,76)
0,63- 0,76 = 0,06log[H+]
-0.13/0,06 = log [H+]
PH= -log[H+]= 0,13/0,06 = 2,16
Indicare il valore della f.e.m. (E) di una pila in cui un elettrodo è costituito da una lamina di rame immersa in una soluzione di ioni Cu2+ 2,50 ·10-2 M e l’altro da una lamina di Zn immersa in una soluzione di ioni Zn2+ 1,30 ·10-3 M, entrambi in condizioni standard e a 25 °C. [E°(Cu2+/Cu) = +0,342 V e E°(Zn2+/Zn) = -0,760 V]: A) -1,14 V B) 1,14 V C) 2,30 V D) 1,98 V:
soluzione
lo schema di questa pila è mostrato in figura:
E (Zn2+/Zn) = E° (Zn) + 0.059/2 log 0,0013 = – 0.76 – 0.03 x -2,88 = – 0,847 V
ZnSO4 e da una lamina di rame immersa in una soluzione 1M di CuSO4.Calcolare la f.e.m.
iniziale della pila e la sua f.e.m. dopo che ha erogato una corrente costante di 5.1A per 21 ore.
(E°Zn2+/Zn = -0.763 e E°Cu2+/Cu = 0.337)
(-) Zn → Zn2+ + 2e-
(+) Cu2+ + 2e- → Cu
La f.e.m. iniziale della pila è data da:
ΔE = Ec-Ea= ΔE° -0,059/2 x log [Zn+2 ] /[Cu+2] =1,1 – 0,059/2 log 0,1/1 = 1,13 V
Dopo che la pila ha erogato una quantità di elettricità pari a:
5.1 A · 21 h =107.10 A h
la concentrazione dello Zn2+ in soluzione aumenta, ed essendo noto che 1Faraday = 26.8 A · h /eq

Lascia un commento