1. A quante moli di atomi di piombo corrisponde un insieme di atomi di piombo costituito da 9,3665x 1024 atomi?
A) 1,555 mol
B) 155,5 mol
C) 15,55 mol
D) 7,776 mol
soluzione
1 mole di atomi è costituita da 6,02 x 10 23 atomi quindi 9,3665 x 10 24 atomi corrispondono ad X moli
1:6,02 x 10 23 = X : 9,3665 x 10 24
X= 9,3665 x 10 24/6,02 x 10 23 = 15,55 mol
risposta corretta C
2. Lo ione 37 Cl– è costituito da:
A) 17 protoni, 20 neutroni e 18 elettroni
B) 17 protoni,20neutroni e 17 elettroni
C) 37 protoni, 20 neutroni e 18 elettroni
D) 17 protoni, 18 neutroni e 18 elettroni
soluzione
L’atomo di cloro 35 Cl possiede 17 elettroni e quindi 17 protoni e 18 neutroni (la somma tra protoni e neutroni è 35), ma l’isotopo 37 ha un peso di 37 ua .Allora questo isotopo deve avere 37 – 17 = 20 neutroni e 17 protoni (infatti la loro somma è 37). Lo ione Cl- possiede una carica negativa (1 elettrone) in più rispetto ai 17 elettroni dell’atomo e quindi questo ione possiede 18 elettroni ma sempre 17 protoni e 20 neutroni.
risposta corretta A
3. Indicare quale serie dì numeri quantici è incompatibile:
A) n=3; l= 1; m= -1; S=+1/2
B) n=4; l =2; m= l; S= -1/2
C) n= 5; l=4; m= -3: S=-1/2 _.
D) n=5; l=5; m=0; S=+1/2
soluzione
E’ noto che, affinché la funzione d’onda Ψ che descrive l’elettrone in un atomo, sia soluzione dell’equazione di Schrödinger (HΨ = EΨ ) che fornisce l’energia dell’elettrone caratterizzato da Ψ è necessario che alcuni numeri che in essa compaiono ,detti numeri quantici indicati con le lettere n,l,m,s , assumano valori ben definiti che sono in relazione tra loro, altrimenti la soluzione dell’equazione avrà come risultato lo zero. Le relazioni tra i numeri quantici sono:
n = numero quantico principale
può assume valori corrispondenti ai numeri interi che vanno da 1 ad infinito
l = numero quantico secondario
può assumere valori che vanno da 0 ad n-1
m =numero quantico magnetico
può assumere valori compresi tra +l,0, -l
S = numero quantico di spin
può assumere solo 2 valori + 1/2 oppure -1/2
per esempio
quando n=1 il numero l può assumere solo il valore 0 e quindi m=0 (quando m=0 si ha uno stato di tipo S) quindi per n=1 l=o m=0 stato 1S
(il numero1 che compare in 1S è il numero quantico principale n)
quando n=2 il numero l può assumere 2 valori l=0 ed l= 1
quando n =1 si hanno 2 stati che sono determinati dal valore di l infatti
- per n=2 ed l= 0 allora m=0 e si ha uno stato 2S
- per n=2 ed l=1 allora si hanno 3 valori di m e cioè +l,0,-l quindi m=1 m=0 m=-1 in questi 3 casi l’energia risultante dopo sostituzione nell’equazione di Schrödinger è la stessa per tutti e tre e si dice che siano stati energetici degeneri. Questi stati sono gli stati 2Px,2Py e 2Pz
il numero 2 si riferisce al livello energetico n=2
Per n= 3 gli stati l possibili sono l=0 l=1 ,l=2 e quindi
quando l=0 m=0 e si ha uno stato 3S
quando l=1 si hanno tre valori di m m=1 m=0, m=-1 che corrispondono ai 3 stati P cioè 3Px,3Py,3Pz con energia uguale tra loro(stati degeneri)
quando l=2 si hanno 5 valori di m e cioè m=2,m=1,m=0, m=-1,m=-2 questi 5 valori (anch’essi forniscono uguale energia) determinano 5 stati d
d1,d2,d3,d4,d5
la forma degli orbitali S, P,d è indicata in figura:
Chiarito ciò, si osserva che i numeri quantici incompatibili indicati nel quesito sono n=5 l=5. Infatti abbiamo visto che il massimo valore di l è n-1 quindi avremmo dovuto avere per n=5 valori di l pari a o,1,2,3,4 e non 5 .
si deduce che la risposta al quesito è D
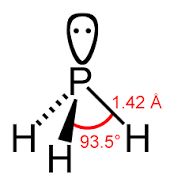
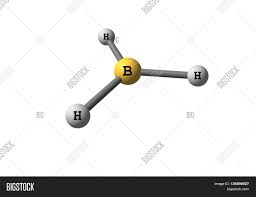
4. Quale delle seguenti molecole è polare:
A) CH4
B) PH3
C) BH3
D) CF4
soluzione
quando in una molecola il baricentro delle cariche positive e negative non coincidono, si ha una separazione parziale di cariche che determina la formazione di un dipolo e quindi di un momento dipolare. La polarità in una molecola si verifica quando gli elettroni del legame tra due atomi diversi A e B non sono equamente condivisi a causa della diversa elettronegatività tra A e B. L’ acqua è un esempio di molecola polare in cui le cariche negative si dispongono sull’ossigeno poiché l’ossigeno è molto più elettronegativo dell’idrogeno su cui invece si dispone la carica positiva.
5. Indicare il numero di legami multipli presente nella formula di struttura di Lewis di SO4 -2
A) l B) 2 C)3 D) 4
soluzione
la struttura dello ione solfato è la seguente:
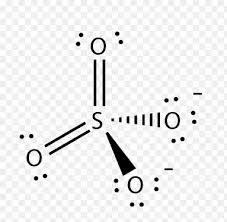
In realtà l’anione solfato esiste sotto forma di struttura risonante cioè sono possibili 4 strutture in cui alternativamente ogni atomo di ossigeno possiede la carica negativa. Il risultato finale consiste nella delocalizzazione della carica su tutti gli atomi di ossigeno presenti.
In questo ione vi sono 2 doppi legami e due legami semplici.
risposta corretta B
6. 709,0 g di cloro molecolare sono costituiti da un numero di molecole uguale a:
A) 6,022 x 1023
B) 3,011 x 1023
C) 12,04 x 1024
D) 6,022 x 1024
soluzione
sappiamo che moli = g/PM quindi
709,0 grammi di Cl2 corrispondono a 709/70,9 =10 moli
poichè in 1 mole vi sono 6,022 x 10 ²³ molecole quindi in 10 moli ve ne sono X
da cui X= 6,022 x 10 ²³ x 10 = 60, 22 x 10²³ molecole o meglio 6,022 x 1024
risposta corretta D
7. Quanti atomi di argento costituiscono 55 g di questo elemento?
A) 6,2×10-23
B) 3,07 x1023
C) 31,5 x 1023
D) 6,0 x 1023
soluzione
il peso atomico dell’ Ag è 107,87 quindi questa quantità che corrisponde ad 1 mole di Ag contiene 6,02 x 1023 atomi quindi 55 g ne contengono X.
107,87 : 6,022 x 1023 = 55 :X X= (6,02 x 55) x 1023/ 107,87 = (331,1 /107,87 ) x 1023 = 3,069 x 1023 = 3,07 x 11023 atomi
risposta corretta B
8. Quanti g di idrogeno necessari per consumare completamente 0,347 g di azoto secondo la reazione da bilanciare:
N2(g) + H2(g) -> NH3(g)
A) o,0750 g
B) 0,0500 g
C) 0,0250 g
D) 0.347 g
soluzione
la reazione bilanciata è
N2(g) + 3H2(g) ->2NH3(g)
dall’equazione sopra scritta, 28 g di azoto consumano 3 x 2,008 g di idrogeno quindi 0,347 g di azoto consumeranno X g di azoto
28 :6,024 = 0,347 :X X= 6,024 x 0,347 / 28 = 0,0746 g di H2 = 0,075 g
risposta corretta A
9. I risultati dell’analisi elementare di una sostanza, espressi come percentuali in peso sono:
Sodio: 22,09%, Ossigeno: 46,\3%, Zolfo: 30,81 %. Qual è la formula bruta del composto?
A) NaHSO4
B) Na2SO4
C) NaHSO3
D) Na2SO3
soluzione
in questo quesito non è indicata la quantità di H che dovrebbe essere per differenza 1%
dividiamo le % per ogni singolo peso atomico e si ha:
Na= 22,09 /22,9 =0,996
S= 30,81 / 32= 0,961
O = 46,13 / 16 = 2,88
H = 1/1,008 = 1
dividiamo per il numero più piccolo che è 0,961 ed otteniamo
Na =1 S=1 O= 3 H=1
la formula è quindi NaHSO3
10 Il gallio ha massa atomica 69,723 u ed esiste in natura come miscela dei due isotopi 69 Ga e 71 Ga. L’isotopo 69Ga ha massa 68,9256 u e abbondanza naturale del 60, 1 %. Determinare la massa e l’abbondanza naturale dell’ altro isotopo?
A) 69,9247 u,39,9%
B) 71,9247 u,39,9%
C) 70,9247 u,42,8%
D) 70,9247 u,39,9%
soluzione
la % in natura del 71 Ga è 100-60,1 =39,9 %
la massa dell’ isotopo 69 è 69,9256 e quindi
massa isotopo 1 x % in natura + massa secondo isotopo x % in Natura = massa tabulata nella tavola periodica che è 69,72
68,9256 x 0,601 = 41,42 + X x 0,399 = 69,723
X= 69,72 – 41,42 / 0,399= 70,92 u
risposta corretta D
11 . La minore velocità con cui il miele scorre rispetto all’acqua è dovuta:
A) alla minore densità del miele
B) alla maggiore densità del miele
C) alla minore viscosità del miele
D) alla maggiore viscosità del miele
soluzione
ricordiamo che la densità è il rapporto tra massa e volume mentre la viscosità indica la resistenza di un fluido allo scorrimento. La viscosità viene solitamente indicata con μ o con la lettera η ed è in relazione al coefficiente di attrito. Essendo la viscosità espressa come una forza su una superficie per un certo tempo, la viscosità e data da massa/lunghezza x tempo .
Da quanto sopra la risposta corretta è che la diversa velocità dipende dalla viscosità e non dalla densità .
12. Indicare la risposta che riporta tutti i valori di m compatibili con l =5
A) 5; 4; 3; 2; 1; 0; -1 ; -2; -3; -4; -5.
B) 5;4;3;2;1;0.
C} 5; -5.
D) 4; 3; 2; 1; 0; -1; -2; -3;-4.
soluzione
abbiamo già visto le relazioni tra i numeri quantici nel quesito n. 3 a cui rimandiamo, e sappiamo che i valori che m può assumere dipendono dal valore di l
Quando l=5 i valori di m, essendo compresi tra +l ,0,-l. , sono : m=+5,+4,+3,+2,+2,0, -1,-2, -3,-4,-5
la risposta corretta quindi è A
13. Indicare l’esatta relazione tra i punti di ebollizione degli alogeni:
A) T eb(F2» Teb(Cl2)» Teb(Br2)» Teb(I2)
B) Teb(Cl2»Teb(F2» Teb(I2)» Teb(Br2)
C) Teb(I2)» Teb(Br2)» Teb(Cl2)» Teb(F2)
D) Teb(Br2»Teb(Cl2)» T’b(F2)> T eb(Iz)
soluzione
le dimensioni atomiche degli alogeni crescono regolarmente lungo il gruppo, e ciò comporta un aumento sia delle temperature di fusione che quelle di ebollizione.
Ne consegue che la relazione corretta è C
14. Indicare la quantità di CH3COONa necessaria a trasformare 0,84038 g di H2SO4 secondo la reazione da bilanciare
CH3COONa + H2SO4 → Na2SO4 + CH3COOH
A) 1,4058 g
B) 2,8116 g
C) 0,7290 g
D) 1,0362 g
soluzione
la reazione bilanciata è: 2CH3COONa + H2SO4 → Na2SO4 + 2CH3COOH
se per 98g (peso di H2SO4) sono necessari 2 x 82 g (peso di CH3COONa) di acido acetico per 0,84038 g di acido solforico sono necessari X g
98 : 164 = 0,84038 : X
X = 1,406 g
risposta corretta A
15. Le molecole di ossigeno disciolte in acqua interagiscono con le molecole di solvente tramite interazioni di tipo:
A) legame a idrogeno
B} dipolo permanente-dipolo permanente
C) dipolo permanente-dipolo indotto
D) dipolo indotto-dipolo indotto
soluzione
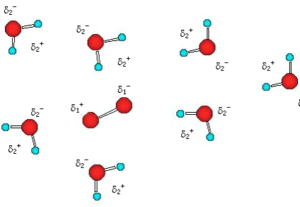
la figura mette in evidenza che il dipolo permanente dell’acqua, all’avvicinarsi all’ossigeno che inizialmente non mostra polarità, determina su quest’ultimo un dipolo indotto disponendo quindi una separazione di carica nell’ossigeno. Ciò comporta che l’ interazione tra acqua ed ossigeno è del tipo Dipolo permanente-dipolo indotto.
risposta corretta C
16. Individuare l’unica affermazione NON CORREITA.
A) tutti gli elementi di un gruppo hanno ‘lo stesso numero di elettroni valenza
B) tutti gli elementi di un gruppo hanno diverso numero di protoni
C) il Litio è più elettropositivo del Fluoro ed ha minore energia di ionìzzazionc
D) . i Lantanidi sono gli elementi con il raggio atomico più piccolo (Contrazione Lantanoidica)
soluzione
la risposta A è corretta infatti se prendiamo ad esempio gli elementi del primo gruppo H,Li,Na,K possiamo osservare che tutti possiedono 1 elettrone in un orbitale esterno di tipo S cioè hanno una struttura nS¹.
La risposta B è corretta in quanto all’aumentare del numero di elettroni in un gruppo, aumenta contemporaneamente il numero di protoni.
la risposta C è altrettanto corretta in quanto per staccare un elettrone 2S dall’atomo è sufficiente una bassa energia mentre per il fluoro che ha 7 elettroni esterni è necessaria una maggior energia per staccare 1 elettrone.Inoltre il Li è più elettropositivo del fluoro che ha invece una grande elettronegatività.
La contrazione lantanoidea (o lantanidica) consiste in una diminuzione del raggio atomico degli elementi appartenenti alla serie dei lantanoidi che è sensibilmente maggiore rispetto all’andamento teoricamente prevedibile osservando la variazione lungo gli altri periodi della tavola periodica.Il raggio atomico dei lantanidi NON è quindi il più piccolo dei raggi atomici tra gli elementi della tavola periodica. Questo fenomeno si spiega considerando il minore effetto schermante degli orbitali f nei confronti del nucleo. Uno dei principali effetti della contrazione lantanoidea consiste nel generare una marginale differenza di raggi atomici tra gli elementi del blocco d del VI e del V periodo, con il risultato che le proprietà chimiche degli elementi dei due periodi che appartengono a uno stesso gruppo sono molto simili.
Ne consegue che la risposta non corretta è la D
17. Indicare il nome del composto (NH4)2Fe(SO4)2 secondo la nomenclatura internazionale.
A) ammonio solfito ferroso
B) ammonio solfito ferrico
C) ammonio solfato ferroso
D) ammonio solfato ferrico
soluzione
il nome corretto è ammonio solfato di ferro(II) o ammonio solfato ferroso
risposta corretta C
18. Individuare l’unica affermazione CORRETTA che riguarda il fosforo.
A) ha minore affinità elettronica dell’ azoto
B) come tutti i non metalli. nello stato fondamentale è un gas
C) esistono solo due ossi acidi a base di fosforo
D) nello stato fondamentale esiste come molecola P2
soluzione
L’affinità elettronica è l’energia scambiata, rilasciata o assorbita, quando si aggiunge un elettrone ad un atomo neutro gassoso isolato come gas monoatomico, per formare uno ione gassoso con carica−1.
La maggior parte degli elementi ha affinità elettronica negativa quindi non necessita di energia per acquistare un elettrone, anzi la rilasciano.L’affinità elettronica è influenzata dalla regola dell’ottetto, infatti gli elementi del gruppo VII A tendono ad acquistare un elettrone ed a formare anioni con carica −1 mentre i gas nobili hanno già l’ottetto completo, quindi l’ aggiunta di elettroni richiede una grande quantità di energia. L’affinità elettronica degli elementi del gruppo XV hanno affinità basse e l’Azoto ha persino affinità positiva ( 7) mentre il fosforo ha affinità -72.
E’ chiaro quindi che la risposta corretta è A
19. Indicare la sequenza che riporta i coefficienti x e y che permettono di bilanciare la seguente reazione:
x P4O6 + y Al + 24 HCI -+ 4 PH3 + yAlCl3 + 6H2O
A) x= l;y= l
B) x= l;y=8
C) x= l;y=4
D) x =2;y=6
soluzione
la reazione è un’ossidoriduzione infatti il fosforo passa da +3 a -3 e l’alluminio Al° si ossida ad Al+3
3[4P + 12H+ + 24 e → 4PH3
24[Al → Al+3 +3 e
__________________________________ e semplificando 3 e 24 si ha 1 ed 8
4 P + 8Al + 24 HCl → 4 PH3 + 8Al+3
pertanto i coefficienti sono X= 1 Y=8
risposta corretta B
20, Indicare la configurazione elettronica di uno ione Na+
A) [Ne] 3s1
B) [Ne] 3S1p6
C) [He] 2s² P5
D) [He] 2sZp6
soluzione
l’elemento sodio ha 11 elettroni che per il principio di esclusione di Pauli riempiono gli orbitali a 2 a 2 pertanto la sua configurazione è
1S² 2S² 2Px² 2Py² 2Pz² 3S¹ oppure [He] 2S2 2P6 3S¹ essendo [He] = 1S² (cioè la configurazione dell’Elio)
lo ione Na+ possiede un elettrone in meno rispetto ad Na per cui la sua configurazione è [He] 2s2 2p6
risposta corretta D
21. Ad una certa temperatura un recipiente rigido contiene n moli di un gas che si comporta in maniera ideale vengono aggiunte m moli dello stesso gas, prelevandole da una bombola che si trova alla stessa temperatura del recipiente. A seguito dell’ aggiunta, si osserverà:
A) un aumento della temperatura del recipiente
B} un aumento della pressione nel recipiente
C) non si osserverà nessuna variazione di temperatura o pressione.
D) non è possibile effettuare il processo descritto
soluzione
l’equazione generale di stato dei gas mette in relazione le moli, la pressione, il volume e la temperatura di un gas.
PV =n RT
E’ evidente che un aumento del numero di moli da n ad m+n provoca un aumento del prodotto PV ed essendo il recipiente rigido il parametro che aumenta è la Pressione.
risposta corretta B
22. Quanto calore è richiesto per aumentare la temperatura di un blocco di rame del volume di 1.00 dm3 da 25,0 °C a 95,0 °C?
La capacità termica specifica del rame è 0.386 J/ K x g. mentre la sua densità è 8920 g /dm3,
A) 241 1
B) 360J
C) 241 KJ
D) 360kJ
soluzione
uno scambio di calore determina sempre una variazione di temperatura . Più alto è il salto termico ΔT di un corpo con massa m , più grande sarà la quantità di calore che assorbe o cede, quindi la quantità di calore scambiata è direttamente proporzionale alla differenza di temperatura ed alla massa.
A) Trigonale planare
B) Lineare
C) Quadrata planare
D) Trigonale piramidale
soluzione
Contiamo tutte le coppie di tipo σ intorno all’ atomo di P e consideriamo gli elettroni del fosforo e quelli derivanti dai legami con gli atomi di cloro.
PCl3: 5e- (per il P) + 3 x 1e- (messo a disposizione da ogni Cl) in totale 8 elettroni cioè 4 coppie di elettroni che formano 4 legami σ.
Poiché nel nostro sistema abbiamo 4 coppie ma solamente 3 atomi di Cl che si legano al P, la molecola è’ di tipo AX3E dove X indica gli atomi legati all’atomo centrale mentre E indica una coppia elettronica solitaria ovvero una coppia di elettroni non impegnata nella formazione di legami.
In base alla teoria VSEPR, i 4 doppietti elettronici assumono una disposizione tetraedrica, tuttavia considerato che gli atomi di Cl si respingono in modo da stare più lontano possibile tra loro gli angoli di legame differiscono sensibilmente dagli angoli di legame di un tetraedro e la geometria della molecola di PCl3 è una piramide trigonale in quanto ai fini della geometria non si prendono in considerazione le coppie solitarie.
risposta corretta D
24.Calcolare le moli di Ba(OH)2 da aggiungere a 0,700 L di una soluzione acquosa di Ha 0,150 M per ottenere una soluzione a pH=7,00 (trascurare variazioni di volume ed effetti sul pH dovuti alla presenza di altri ioni).
A) 0,0775 mol
B) 0,0105 mol
C) 0,0525 mol
D) 0,0257 mol
soluzione
ottenere un PH=7 significa che tutto l’acido deve essere neutralizzato dalla base Ba(OH)2
essendo le moli di acido 0,7 x 0,150 = 0,105 moli
dalla reazione Ba(OH)2 + 2 HCl → BaCl2 +2 H2O si osserva che per 2 moli di HCl serve solo 1 mole di Ba(OH)2 quindi
2 : 1 = 0,105 :X X= 0,105/2 = 0,0525 moli di Ba(OH)2 necessari per neutralizzare tutto l’acido ed ottenetre una soluzione a PH=7
risposta corretta C
25. Calcolare quanti grammi di una soluzione acquosa di KNO3 al 7,0% (p/p) occorre mescolare con 15,0 g di una soluzione di NaNO3 (p/p) al 18,0%, per ottenere una soluzione al 12,0% (p/p) di ioni NO3-
A) 5,7 g
D) 2,2 g
C) 1,8 g
D) 3,2 g
soluzione
siccome abbiamo i sali NaNO3 e KNO3 ma dobbiamo ottenere una soluzione finale che è al 12 %(p/p) di NO3- è necessario prima calcolare il %(p/p) di NO3- sia in NaNO3 che i KNO3 pertanto,
per calcolare il %(p/p) di NO3- in 15 g di NaNO3 procediamo calcolando prima al quantità di NaNO3 in 15 g al 18%
se in 100:18= 15 :X X = Massa di NaNO3 = 18 x 15/100=2.7 g di NaNO3 in 15 g di NaNO3 al 18% (p/p)
se in NaNO3 vi è NO3- in 2,7 g di NaNO3 vi sono X g di NO3-
85:62=2,7:X X= 1,969 g di NO3-
e ricordando che
%(p/p) = massa soluto x 100 / massa soluzione si ha:
% p/p = 1.97 x 100/15.0= 13.2 = %(p/p) di NO3- proveniente da 15 g di NaNO3 al 18%
pertanto %(p/p) NO3- provenienta da NaNO3 è 13,2 %
Passiamo adesso al secondo composto che è KNO3 al 7%
Nella soluzione al 7% vi sono 7 g di KNO3 (PM = 101) in 100 g di soluzione
se in KnO3 vi è NO3- allora in 7 g vene saranno X
101,1 :62 =7 :X X= 4,29 g NO3- nella soluzione al 7% di KNO3
la quantità di NO3- proveniente da KNO3 è pertanto 4,29 g e la sua %(p/p) è
% p/p = 4,29 x 100/100 = 4.29
sapendo che %(p/p) = massa soluto x 100/ massa soluzione
massa soluto = massa soluzione x %(p/p) /100
pertanto:
massa di soluto proveniente da NaNO3 =1,69 g
massa di soluto proveniente da KNO3 è
massa soluto =massa soluzione x 4.29/100 = 0.0429 x massa soluzione
ne consegue che :
%(p/p) = massa soluto proveniente da NaNO3 + massa soluto proveniente da KNO3 ) x 100 / massa di soluzione
quindi possiamo scrivere
12 = (1.969 +0.0429 massa soluzione ) 100/15 + massa soluzione
12 =196,9 + 4,29 massa soluzione / 15+massa soluzione
12 x (15 + massa soluzione) =196,9 + 4,29 x massa soluzione
180 + 12 x massa soluzione = 196,9 + 4.29 x massa soluzione
16,9 = (12 – 4,29) massa soluzione
massa soluzione = 16,9/ 7,71 = 2,19
Massa soluzione =massa di KNO3 al 7% da aggiungere a 15 g di NaNO3 =2.2g
risposta corretta B
26. ln un reattore alla temperatura di 500,0 K vengono introdotti N2 e H2 nel rapporto 1:3 in moli. Si stabilisce la seguente reazione di equilibrio (da bilanciare): N2+H2 ⇄ NH3 .Ad equilibrio raggiunto nel reattore, la pressione parziale di NH3(g) è 0,22x 105 Pa e quella totale è 1,01 x 105 Pa. Calcolare la pressione parziale di N2(g) all’ equilibrio.
A) 0,60×105 Pa
D) O,84x 105 Pa
C) 0,38×105 Pa
D) 0,20x 105Pa
soluzione
la reazione bilanciata è : N2 + 3H2 ⇄ 2 NH3
la frazione molare di NH3 = 0,22/ 1,01 = 0,218
sappiamo inoltre che la somma delle frazioni molari deve essere sempre 1
pertanto 1= FmNH3 +FmN2 +FMH2
da cui 1-0,218 = FmN2 +FMH2
dalla reazione di equilibrio vediamo che FMH2 = 3 FmN2 quindi sostituendo si ha:
0,782 = FmN2 + 3 FmN2
0,782 = 4 FmN2 da cui FmN2 = 0,782/4 = 0,1955 = frazione molare di N2
nota la frazione molare di N2 possiamo calcolare la pressione parziale ricordando che Pparz = fraz.molare x Ptotale
pertanto la Pparz N2 = 0,1955 x 1,01 x 105 = 0,197 x 105 = 0,2 x 105 Pa
risposta corretta D
27. Un adulto inspira 4,00 L di aria al minuto Sapendo che l’aria espirata possiede un quantitativo di O2 pari al 15,0% (V/V), calcolare il volume (in m³) di O2{g) assorbito dall’organismo nell’arco delle 24 h. (L’aria è costituita dal 20,8% (V/V ) di O2(g).
A) 0,915 ml
B)0,334m3
C) 0,573 m3
D) 0,259m3
soluzione
quantità di aria inspirata 4 litri minuto=240 l ora = 5760 al giorno
ossigeno inspirato = 28% di 5760 = 0,28 x 5760 = 1612,8 litri di O2
quantità di ossigeno espirata è il 15% di 5760 = 5760 x 0,15 = 864 litri
quantità di ossigeno assorbita = 1612,8 – 864 = 334 litri = 0,334 m³
risposta corretta B
28. In certe condizioni la solubilità del Elio in acqua è 0,00900 mL di Hew misurati alla temperatura di 293,0 K e alla pressione di l,Olxl05pa in 1,00 mL di acqua. Calcolare la concentrazione Molare della soluzione satura nelle stesse condizionì. Trascurare le variazioni di volume.
A) l,97x 104M
B) 3,73×104 M
C) 8,42×10-4M
D) 5,64×10-5 M
soluzione
le moli di elio corrispondenti ad un volume pari a 0,009 l possiamo calcolarle dall’equazione di stato dei gas PV=nRT
quindi numero moli n = 1,01 x 105 x 0,009 / 293 x 8,314 = 0,373 x 10 5 = 3,73 x 104
risposta corretta B
29. Calcolare quante moli di N2 si producono mettendo a reagire 5,00 mol di NH3 con una quantità in eccesso di NO . La reazione da bilanciare è:
NH3(g} + NO(g) -> N2 + H2O
A)9,11mol
B) 4,79 mol
C) 6,25 mol
D) 8,54mol
soluzione
la reazione bilanciata è:
4NH3(g} +6NO(g) -> 5 N2 +6 H2O
quindi da 4 moli di NH3 si ottengono 5 moli di N2 quindi da 5 moli se ne ottengono X
4 : 5 = 5 :X X= 25/4 = 6,25 moli
risposta corretta C
30. Quanta acqua deve evaporare da 95,0 g di una soluzione acquosa di NaBr al 37,0% (p/p) per ottenere una soluzione al 55.0%(p/p)?
A) 39,5g
B)40,6g
C) 24,4g
D) 31,1 g
soluzione
sappiamo che
%(p/p) = massa soluto x 100/ massa soluto + massa solvente
la massa di soluto iniziale è 95 g al 37 $% di NaBr quindi 95 x 0,18 =35,15 g di soluto
pertanto se indichiamo co X la massa di solvente (che è H2O) possiamo scrivere
37 = 35,15 x 100/ 35,15 + X
1300 + 37X= 3515 X=2215 /37 = 59,86 g di H2O iniziali
la soluzione dopo evaporazione di una quantità di solvente da calcolare, dovrà avere un concentrazione pari a 55%(p/p) pertanto possiamo anche in questo caso calcolare la massa di solvente finale
55= 35,15 x 100 / 35,15 +x
1933,2 +55X = 3515
X= 3515 – 1933,2 /55 = 28,76
pertanto da una quantità iniziale di H2O pari a 59,86 g la soluzione dovrà avere 28,76 g di H2O quindi dovranno evaporare 59,86 – 28,76 = 31,1 g di H2O
risposta corretta D
31. Il limite inferiore di infiammabilità è la minima concentrazione nell’aria necessaria per provocare un incendio in presenza di un innesco. Per l’acetone è 61.80 gim3. Un capannone industriale chiuso delle dimensioni di 8Omx15Ornx14,5m viene utilizzato come deposito di fusti di acetone da 50,00 kg. Quanti fusti al massimo possono essere collocati nel capannone perché non si superi il limite di infiammabilità se il loro contenuto dovesse evaporare completamente?
A) 176 fusti
B) 327 fusti
C) 155 fusti
D) 215 fusti
soluzione
il capannone ha un volume di 80 x 150 x 14,5 = 168000 m³
il limite inferiore di infiammabilità dell’acetone è 61,8 g /m³ quindi per tutto il capannone vi è un limite di 61,8 x 174000 g = =10753200 g = 10753,2 Kg
poiché 1 fusto contiene 50 Kg allora X fusti conterranno 10753,2 Kg
1: 50 = x :10753,2
X= 10753,2 /50
X= 215, 064 fusti
risposta corretta D
32. Calcolare la concentrazione (in % p/p) di una soluzione di acido acetico ottenuta mescolando 70,0 g dì una soluzione dì acido al 4,0% (P/p) con 55,0 g di una al 11,,0% (p/ p)
A) 8,3%
B) 9,4% •
q7j% .
D) 6,7%
s0luzione
sappiamo che %(p/p) = massa soluto x 100 / massa soluto + massa solvente
la massa di acido che deve essere aggiunto all’altra soluzione è 70 x 0,04 = 2,8 g
la massa di acido a cui vengono aggiunti i 2,8 g è 55 x 0,11 =6,05 g
la quantità totale di massa è 55+ 70 = 125 g
pertanto sapenndo che
%(p/p) = massa soluto x 100 / massa solvente
X % = (6,05 + 2,8) x 100 / 70+ 55
X = 885 / 125 = 7,08 = 7,1
risposta corretta C
33. In un’ industria ci sono quattro impianti frigoriferi che utilizzano ammoniaca come fluido refrigerante. Poiché il gas si disperde nell’ambiente di lavoro, indicare quale impianto presenta l’aria con la più alta concentrazione di NH3?
A) Impianto 1: 15 mg/dm3
B) Impianto 2: 30 mg/L
C) Impianto 3: 500 mg/m³
D) Impianto 4: 35 μg /cm³
soluzione
trasformiamo tutto in litri
Impianto 1 15 mg/dm³ = 15 mg/L
Impianto 2 30 mg / L
Impianto 3 500mg/m³ = 500 mg / 1000 L = 0,5 mg/L
Impianto 4 35 μg /cm³ = 35 mg /L
pertanto la risposta corretta è D
34. Quando 17,0 g di un minerale contenente NiO sono riscaldati a 1500 K, si producono 0,480 g di O2(g) secondo la reazione:
2NiO → 2Ni + O2
Calcolare la percentuale (p/p) di NiO nel minerale.
A) 25,9%
B) 13,2%
C) 32,5%
D) 20,6%
soluzione
calcoliamo prima la quantità di NiO2 presente in 17 grammi di campione
se da due molecole di NiO si ottengono 2 O allora da X g se ne ottengono 0,48 g
2 NiO :2O = X : 0,48
X= 2x 74,7 x 0,48 /32 = 2,241 g
sappiamo che % (p/p) = moli soluto x 100 / moli solvente pertanto
essendo le moli di soluto pari a 2, 241 e le moli di solvente 17
%(p/p) = 2,41 x 100 /17 = 13,18 = 13,2
35 L’emoglobina (Hb) nel sangue “trasporta” ossigeno attraverso la reazione che segue:
Hb+ 4O2(g) -> Hb(O2)4(g)
Se la concentrazione di Hb nel sangue è 150 g/L, quante moli di ossigeno sono trasportate da 6 litri di sangue? La massa molare dell’emoglobina (Hb) è 64500 g/mol.
A) 0,056 mal
B) 0,096 mol
C) 0,023 mol
D) 0,041 mol
soluzione
le moli di emoglobina che corrispondono a 150 g sono moli HB = 150 / 64500 = 2,34 x 10-³ in 1 litro di sangue
poichè 1 mole di HB trasporta 4 moli di O2 allora 2,34 x 10-³ moli ne trasportano X
X= 2,34 x 10-³ x 4 /1 = 9,36 x 10-³= moli di Ossigeno trasportate da 1 litro di sangue
6 litri x 9,36 x 10-³= 56,16 x 10 -³ = 0,0561 moli di ossigeno
risposta corretta A
36.Calcolare le moli di ossigeno necessarie a bruciare 2,0 mal di ammoniaca, secondo la reazione (da bilanciare):
NH3 + O2 → NO+ H2O
A) 3,3 mal
B) 2,0 mal
C) 1,1 mol
D) 2,5 mol
soluzione
la reazione bilanciata è
-3 +2
4[N +5 e → N
5[2O → 2O-2 + 4 e
pertanto
4 NH3 + 5O2 → 4NO+ 6H2O
da questa reazione si vede che per 4 moli di NH3 sono necessarie 5 moli di Ossigeno pertanto per 2 moli sono necessarie 5/2 = 2,5 moli di ossigeno
risposta corretta D
37. Calcolare la densità (in g/L) di una miscela gassosa al 28,5% (V/V) di H2 e al 71,5 % (V/V) di CH4 se a 351,0 K ha una pressione totale di 5,68x 10 5 Pa.
A) 3,78g/L
B) 4,01 g/L
C) 2,35 g/L
D) 1,77 g/L
soluzione
La densità di un gas può essere ricavata dall’ equazione di stato dei gas PV=nRT ma n/V = densità g/PM
38. In un capannone industriale di dimensioni 25 m x 30 m x 6 m viene completamente svuotato un serbatoio del volume di 40,0 L contenente metano alla pressione di 35 x 105 Pa . Se la temperatura ambiente è di 18 °C quale sarà la concentrazione di metano in g/m3 nell’aria del capannone.
A) 0,206
B) 0,714
C) 0,559
D) 0,647
soluzione
il capannone misura 4500 ³m
i grammi di CH4 in 40 litri sono calcolati dalla equazione di stato dei gas PV=g/PM RT essendo T =273+18 =291 K
quindi g= P x V x PM / RT
g = 35 x 105 x 40 x 16 / 8,314 x 291
g = 925,3 CH4
questa quantità occupa quindi il volume di 4500 m³ quindi in 1 metro cubo vi sono
925,3 :4500 = X : 1
X= 925,3 /4500 = 2,056 g = 2,06 g/m³
risposta corretta A
39. 0.650 m³ di una miscela gassosa costituita da Ne e Ar pesano 9,50 kg, alla temperatura di 303,0 K e alla pressione 10,6x 10 5 Pa . Calcolare la % (V/V)) dei singoli componenti.
A) 12,7% Ne(g) , 87,3% Ar(g)
B) 42,1% Ne(g), 57,9% Ar(g)
C) 33,5% N(g) ,66,5% Ar(g)
D) 26,2% N(g) , 73,8% Ar(g)
soluzione
% in volume è il volume di soluto un 100 parti in volume di solvente.
il volume della miscela di gas in esame è 650 Litri ed è composto da Ar ed Ne . Dobbiamo calcolare il volume occupato da ogni singolo gas alle condizioni di 303 °C e 10,6 x 105 Pa e poi calcolare la % . Calcoliamo prima le moli totali di gas;
Le moli totali di gas sono calcolate da PV=ntot x RT cioè ntot = PV/RT ntot = 10,46 tm x 650 litri / 0,0821 x 303
ntot = 273,3 moli
le moli totali sono la somma delle moli di Ne e le moli di Ar, cioè
ntot = 273,3= moli Ne + moli di Ar = X/20,18 + Y /40 dove con X ed Y indichiamo i grammi di Ne e di Ar
Possiamo calcolare i grammi di Ar e di Ne nella miscela ricordando che X+Y =9500 g quindi X= 9500 – Y e sostituendo nell’espressione che fornisce le moli totali possiamo ottenere Y .Infatti
273 = 9500 -Y / 20,18 + Y /40 dove con Y indichiamo i grammi di Ar e con Y i grammi di Ne
273x (20,18 x 40) = 40 (9500 -Y) + 20,18 Y
22036 = 380000 – 40 Y + 20,18 Y = 380000- 19,82 Y
Y=( 380000-220365 )/19,82
Y= 8054 g = peso di Ar
quindi il Peso del Neon è 9500 – 8054= 1446 g
a questo punto calcoliamo il volume che corrisponde a 1446 g di Ne e poi quello corrispondente ad Ar
Il volume corrispondente di Ne è calcolato da PV= g/PA RT V= g/PA RT V= (1446/20,18 ) x 24,88/ 10,46 = 170,43 litri
quindi la %(V/V) di Ne è calcolata dalla proporzione :
se in 650 Litri vi sono 170,43 litri di Ne in 100 litri ve ne sono X
650:170,43 =100:X
X= %(V/V) di Ne = 26,2 % ovviamente %(V/V) di Ar = 100 – 26,2 = 73,8 %
risposta corretta D
40. Per valutare la stabilità dei cicloalcani si usa la reazione di combustione, in cui essi reagiscono con l’ossigeno per formare biossido di carbonio e acqua secondo una reazione esotermica, Tenendo conto del calore di combustione (ΔH in Kcal/ mol) e di altre considerazioni logiche indicare l’ordine di stabilità decrescente dei seguenti cicloalcani:
-ΔH=468,7 -ΔH = 614,3 -ΔH=882,1 -ΔH = 1186,0
A) ciclopropano, ciclobutano, cicloesano, cicloottano
B) cicloottano, cicloesano, ciclobutano, cìclopropano
C) cicloesano, cicloottano, ciclobutano; ciclopropano
D) ciclopropano, ciclobutano, cicloottano, cicloesano
soluzione
un confronto sulla stabilità relativa dei cicloalcani può essere effettuato dividendo il valore del calore che si sviluppa nella combustione per il numero di atomi di C che compongono la molecola. Sappiamo che gli atomi di C che compongono un alcano sono ibridi sp3, così gli atomi di C che si legano tra loro tendono a formare angoli di 109.5 gradi . Tuttavia, la configurazione ad anello impedisce ai cicloalcani dai 3 ai 15 carboni, con l’eccezione del cicloesano, di disporre i protoni in modo sfalsato gli uni rispetto agli altri, generando quella che viene definita tensione d’anello.Il caso dell’esano è particolare perché esistono più conformazioni in equilibrio tra loro cioè: a sella ,planare, a sedia . Effettuando la divisione si ha:
valori di -ΔH/ nC (ricorda che -ΔH =Q)
ciclopropano 468,7 /3 = 156,23
ciclobutano 614,3 /4 = 153,57
cicloesano 882,1 /6 = 147,0
Cicloottano 1186 /8 = 148,25
dai risultanti valori, si nota che il valore più piccolo che corrisponde alla minor energia è pertanto il più stabile e quindi il cicloesano, è la molecola più stabile seguita dal cicloottano,ciclobutano e ciclopropano.
risposta corretta C
Qui continuano i quesiti della classe A (20)
41, Tra le seguenti formule di specie anioniche, indicare quella ERRATA:
A) anione nitrato: NO3-
B) anione ipoiodito: IO–
C) anione carbonato:CO3-2
D) anione fosfato:PO4-2
soluzione
se consideriamo i numeri di ossidazione di ogni atomo che compone ciascun anione vediamo che :
N ha n.o. +5
I ha n.o. +1
C ha n.o. +4
il P ,nello ione indicato avrebbe n.o. +6 , il che non può essere vero perchè il P può avere n.o -3, 0, +1,+3,+5 e non 6
si deduce che la risposta errata è D
42. Uno studente sta pesando un volume noto di una soluzione : quale informazione sta cercando?
A) La viscosità della soluzione
B) La concentrazione della una soluzione
C) La densità della soluzione
D) Nessuna delle tre
soluzione
Valutare il peso di una soluzione significa valutare la sua densità in quanto la
d= peso/volume
Ad esempio, dire che la densità dell’ H2SO4 è 1,27 g /ml significa conoscere quanto pesa un millilitro di H2SO4
La risposta corretta è C
43, Indicare la formula bruta del composto clorato di magnesio.
A) MgCl2
B) Mg(ClO4)2
C) Mg(ClO3)2
D) Mg(ClO2)2
soluzione
sappiamo che il Cloro può avere n.o. -1 ; 0 ; +1 ; + 3 ;+ 5 ;+ 7 ;
se consideriamo il n.o +7 è il massimo stato di ossidazione del cloro quindi è il perclorato Mg(ClO4)2
se consideriamo il n.o. +5 si ha il clorato Mg(ClO3)2
se consideriamo il n.o + 3 si ha il clorito Mg(ClO2)2
se consideriamo il n.o. + 1 si ha l’ipoclorito Mg(ClO)2
se consideriamo il n.o. -1 si ha il cloruro MgCl2
risposta corretta C
44. Indicare il numero di ossidazione del cloro in Cl2O
A) -1
B) O
C) +1
D) +2
soluzione
per valutare il numero di ossidazione di un atomo in una molecola è necessario considerare il numero di legami che lo legano all’atomo vicino e considerare se quest’ultimo è più o meno elettronegativo rispetto al primo.
Si attribuisce + 1 se l’ atomo è legato con un legame ad un altro più elettronegativo
Si attribuisce -1 se l’atomo è legato con un legame ad un altro meno elettronegativo
pertanto, sappiamo che l’ossigeno ha elettronegatività 3,5 (secondo Pauling )mentre il Cloro ha elettronegatività 3,0 nella stessa scala.
Si deduce che nella molecola Cl2O essendo ogni atomo di cloro legato all’ossigeno con 1 legame, dobbiamo attribuire ad ogni atomo di Cl un n.o. +1
risposta corretta C
45. Indicare la coppia di affermazioni vere circa la definizione di molalità:
A) La molalità indica il rapporto tra la massa di soluto, espressa in grammi, e la massa di solvente, espressa in chilogrammi; l’unità di misura si indica con m.
B) La molalità indica il rapporto tra le moli di soluto c la massa di solvente, espressa in chilogrammi; l’unità di misura si indica con m.
Cl La molalità indica il rapporto tra la massa di saluto, espressa in grammi, e il volume di solvente, espresso in litri; l’unità di misura si indica con m.
D) La molalità indica il rapporto tra le moli di soluto e il volume di solvente, espresso in litri; l’unità di misura si indica con M.
soluzione
Il concetto stesso di Molalità ci fornisce la risposta corretta, infatti la molalità è il numero di moli di soluto in 1 Kg di solvente così come la molarità è il numero di moli in 1 litro di solvente . La Molalità si indica con m.
risposta corretta
46. Quali delle seguenti quantità di sostanze elementari è costituita dal maggior numero di atomi:
A) 90,0 g di stagno
B) 120 g di silìcio
C) 200 g di uranio
D) 60 g di rame
soluzione
sappiamo che 1 mole di un atomo contiene 6,02 x 10 ²³ atomi quindi dobbiamo calcolare le moli dello Sn, Si, U , Cu
1 mole di Sn= 118,7 g
1 mole di Si = 28,09 g
1 mole di U = 238 g
1 mole di Cu = 63,54 g
se 118,7 g di Sn contengono 6,02 x 10 ²³ atomi allora 90 g ne contengono X X= 4,56 x 10²³
se 28,09 di Si contengono 6,02 x 10 ²³ atomi allora 120 g ne contengono X X= 24,99 x 10²³
se 238 g di U contengono 6,02 x 10 ²³ atomi allora 200 g ne contengono X X= 5,06 x 10²³
se 63,54 g di Cu contengono 6,02 x 10 ²³ atomi allora 60 g ne conterranno X X = 5,68 x 10²³
120 g di Si contengono il numero di atomi più grande .
risposta corretta B
47, l membri dell’astronave Enterprise, proveniente dal pianeta Terra, stanno sondando un nuovo mondo, la cui temperatura è compresa tra 273 e 300 K, per verificarne l’abitabilità. Ad un certo punto trovano un lago che, analizzato, risulta essere composto da anidride carbonica liquida. Giungono alla conclusione che il pianeta non è abitabile. Perché?
A) Le temperature sono troppo basse
B) Le temperature sono troppo alte
C) La pressione è troppo bassa
D) La pressione è troppo alta
soluzione
il diagramma di stato della CO2 è:
in questo diagramma le linee continue rappresentano i punti in cui 2 fasi sono in equilibrio per i valori di T e P . Il punto d’incontro tra le 3 linee di equilibrio è definito punto triplo ed è il punto caratterizzato dai valori di T e P (-56,6 °C e 5,2 atm ) in cui coesistono i tre stati: solido,liquido e gas.
Vediamo dal grafico che lo stato liquido esiste solo a valori di pressione al di sopra di 5,2 atmosfere ed a temperature al di sopra di -56,5 gradi C. Pertanto se gli astronauti vedono un lago di CO2 liquida allora l’ambiente non è adeguato all’uomo perché la pressione è superiore a 5,2 atmosfere.
Risposta corretta D
48. La frazione molare indica:
A) Il rapporto tra le moli di un componente di una miscela e la somma delle moli di tutti i componenti della miscela.
B) Il rapporto tra le moli di un componente di una miscela e la somma delle moli di tutti gli altri componenti della miscela.
C) Il rapporto tra la massa di un componente di una miscela e la somma delle masse di tutti i componenti della miscela.
D) Il rapporto tra la massa di un componente di una miscela e la somma delle masse di tutti gli altri componenti della miscela.
soluzione
la frazione molare è il rapporto tra le moli di un componente la miscela e le moli totali cioè le moli di tutti i componenti la miscela. Ad esempio se la miscela è costituita da 3 componenti A,B,C e le loro moli nella miscela sono na, nb,nc allora la Frazione molare di A = na/ na+nb+nc analogamente la Frazione molare di B =nb/na+nb+nc e la Frazione molare di C = Nc / na+nb+nc
E’ evidente che la somma delle frazioni molaari deve essere 1
cioè Fraz. mol. A + FRaz. mol.B + Fraz.mol. C =1
La risposta corretta è A
49. Secondo la teoria VSEPR I’anidride solforosa di formula SO2 ha geometria:
A) Planare
B) Angolata
C) Piramidale
D) A sella
soluzione
la teoria VSEPR (Valence-Shell Electron-Pairs Repulsion = repulsione tra doppietti elettronici dello strato di valenza) considera che i doppietti elettronici più esterni di un atomo, essendo cariche negative , si respingano, tendendo a disporsi il più lontano possibile tra loro , in modo tale che la forza di repulsione sia minima per rendere più stabile l’intera molecola. La teoria considera quindi solo i legami tra gli atomi e le coppie elettroniche eventualmente presenti e considera i legami doppi e tripli come se si trattasse di legami semplici ed in conseguenza la geometria di una molecola dipende unicamente dal numero di legami (indifferentemente semplici, doppi o tripli) e di coppie solitarie che presenta l’atomo centrale (numero sterico).
numero sterico = numero legami + numero coppie solitarie (lone pair)
In definitiva la forza repulsiva maggiore si ha tra coppie di elettroni non impegnati in legami (solitarie o lone pair) poi tra coppie solitarie ed elettroni di legame ed infine tra coppie di legami.
Nel caso di SO2 lo zolfo presenta un doppietto solitario e due legami con l’ossigeno quindi NS= 3
In questo caso abbiamo 2 possibilità per molecole AX3 la struttura è planare trigonale, ma in questo caso la struttura è del tipo AX2E1 dove E rappresenta il doppietto elettronico solitario, quindi la struttura è ANGOLATA.
risposta corretta B
50. Indicare la formula bruta del composto ionico formato da bario e zolfo:
A) BaS2
B) BaS
C) Ba2S¹
D) Ba3S2
soluzione
il bario appartiene al secondo gruppo della tavola periodica ed ha la struttura [Xe] 6S² e possiede quindi 2 elettroni disponibili per un legame. Lo zolfo a sua volta ha la struttura [Ne] 3S² 3Px² 3Py¹3Pz¹cciò significa che ogni atomo di Ba può legarsi 1 solo atomo di S e la formula corretta è BaS.
risposta corretta B
51. Gli atomi di C, F, e Li (in ordine alfabetico) hanno affinità elettronica AE diversa. Indicare la sequenza che riporta le corrette relazioni tra i diversi valori
Da quanto abbiamo detto risulta chiaro che F deve avere la AE più negativa, seguito da C e poi dal litio che è un metallo alcalino. Infatti risulta che F ha una AE = -328 C ha un AE = -122 e Li ha una AE = – 60 . AE viene espressa in KJ/mol .
La risposta corretta è B
52. Considerando le loro proprietà nello stato elementare, quale di questi metalli può essere fuso stringendolo per alcuni minuti nel palmo di una mano?
A) Gallio
B) Platino
C) Oro
D) Iodio
soluzione
E’ evidente che sia il platino che l’oro non possono fondere per riscaldamento all’interno del palmo di una mano , in cui la temperatura è intorno ai 37 gradi, così come lo iodio solido che fonde a circa 113°C . Il gallio invece, pur essendo un metallo, ha punto di fusione intorno ai 30°C e pertanto può fondere all’interno del di una mano.
risposta corretta A
53. Indicare le formule corrette dei composti ionici che si formano quando l’anione carbonato si lega con i cationi Na+, Ca2+ e Fe3+.
A) NaHCO3 ; Ca(HCO3)2 ; Fe(HCO3)3
B) Na2HCO3 CaHCO3. Fe2(HCO3)3
C) NaCO3 ; Ca(CO3)3; Fe(CO3)3
D) Na2CO3 CaCO3, Fe2 (CO3)3
soluzione
Lo ione carbonato è CO3-2 quindi possiamo escludere le risposte A e B .
il sodio è Na+ quindi con Co3-2 sono necessari due atomi di sodio e si forma Na2CO3
Il Calcio è Ca+2 quindi 1 di Ca si unisce ad 1 di CO3 per formare CaCO3
il ferro è +3 e quindi la formula del carbonato è Fe2(CO3)3
la risposta corretta è D
54. Ferro, cobalto, e oro sono:
A) Metalli alcalini
B) Metalli alcalino terrosi
C) Metalli di transizione
D) Alogeni
soluzione
appartengono al gruppo dei metalli di transizione detti anche metalli del blocco d o elementi del blocco d. Sono quaranta elementi con numero atomico che va dal 21 al 30, dal 39 al 48, dal 71 all’ 80 e dal 103 al 112. Nella tavola periodica occupano i gruppi da 3 a 12 ed in questi elementi gli orbitali di tipo d si riempiono in modo progressivo.
55. Nella sostanza KBr è presente:
A) un legame covalente polare
B) un legame a idrogeno
C) un legame ionico
D) un legame doppio
soluzione
il potassio K ha una struttura con un orbitale S occupato da 1 elettrone mentre il Bromo, Br possiede 7 elettroni esterni infatti le strutture di K e Br sono
K= [Ar] 4S¹ e Br= [Ar] 3d¹º4S² 4Px² 4Py²4Pz¹
ne consegue che il potassio perde facilmente l’elettrone S e rimane con una carica positiva mentre il Bromo lo acquista per accoppiare il suo elettrone Pz spaiato caricandosi così con una carica negativa.
Gli ioni format K+ e Br- si attraggono con una forza elettrostatica e si uniscono quindi con un legame ionico.
risposta corretta C
56. Il metano contenuto in recipiente del volume di 0,80 m3 a 35 °C esercita una pressione di 2,0 x 107 Pa, Quanti kg di metano contiene il recipiente?
A) 50 kg
B) 100kg
C) 25kg
D) 125 kg
soluzione
dalla equazione generale di stato dei gas PV = g/PM RT si calcolano i grammi di metano infatti
197,38 atm x 800 litri =( g/ 16 ) x 0,0821 x 303
g= 197,38 x 800 x 16 / 0,0821 x 303
g = 2526464 / 24,88
= 101546 g cioè 101, 55 Kg
risposta corretta B
57. Un sistema chiuso può
A) scambiare sia materia sia energia con l’ambiente circostante
B) non scambiare né materia né energia con l’ambiente circostante
C) scambiare materia ma non energia con l’ambiente circostante
D) scambiare energia ma non materia con l’ambiente circostante
soluzione
i sistemi possono essere di 3 tipi:
1- sistema aperto cioè un recipiente in cui è possibile scambiare sia materia che enrgia
2- sistema chiuso cioè un sistema che permette di scambiare energia ma non materia
3- siapema isolato in cui non è possibile scambiare nè energia nè materia.
ne consegue che la risposta corretta è D
58. Quanti grammi di carbonio è possibile ottenere da 37,0 g di colesterolo (C27H46O )
A) 52,7 g
B) 61,8 g
C) 49,7 g
D)31,0 g
soluzione
da una molecola di C27H46O è possibile ottenere 27 x 12 g di Carbonio, quindi da 37 grammi se ne ottengono X
386 : 324 = 37 : X X= 31,0 g
risposta corretta D
59. Analizzando una partita di vongole, si è trovato un contenuto medio di Cd nei molluschi pari a 0,238 mg/Kg. Mangiando 150,0 g di mollusco 2 volte al mese, dopo quanti mesi un individuo ha ingerito 1,00 mg di Cd?
A) 14,0 mesi
B) 24,5 mesi
C) 10,2 mesi
D) I0,0mesi
soluzione
se in 1 Kg (1000 g) di mollusco vi sono 0,238 mg in 150 g di mollusco vi sono X mg
X = 0,0357 mg
mangiandone 2 volte al mese mangia 0,0357 mg x 2 = 0,0714 mg
se in 1 mese ingerisce 0,0714 mg in X mesi ne ingerirà 1 mg
X= 1/ 0,0714 = 14,0 mesi
risposta corretta A
60. Calcolare quanti grammi di NaNO3 occorre aggiungere a 65,0 g una soluzione al 17,0% (p/p) per ottenere una soluzione al 31,0% di NaNO3
A) 27,3g
B) 44,lg
C) 13,2g
D) 37,5g
soluzione
la quantità di NaNO3 iniziale è 65 g al 17 % cioè 65 x 0,17= 11,05 g
dobbiamo ottenere una soluzione al 31%(p/p) aggiungendo ad 11,05 g iniziali, X g di NaNO3 ulteriori
sappiamo che %(p/p) = (grammi soluto / grammi solvente )x 100
ma i grammi di soluto sono 11,05 + X dove X sono i grammi di NaNO3 aggiunto
e la quantità di solvente totale è 65 g + X aggiunti
quindi possiamo scrivere 31 = ( 11,05 + X / 65 + X ) x 100
31(65+X) = (11,05 +X ) x 100
2015+ 31X = 1105 + 100 X
2015 – 1105 = (100-31) X
910= 69 X
X= 13,19 = 13,2 grammi
risposta corretta C
Qui continuano i quesiti della classe B (20)
41. Disciogliendo 120 g di un composto incognito non volatile in 4 kg di acqua si ottiene una soluzione che, raffreddando, comincia a congelare a -0,25 °C. Qual è la massa molare del composto? La costante crioscopica dell’acqua a 25°C è 1,86 K kg / mol.
A) 223 g/mol
B) 260 g/mol
C) 280 g/mol
D) 300 g/mol
soluzione
120 grammi di sostanza sono aggiunti a 4 Kg quindi in 1 Kg vi sono 120/4 =30 g di sostanza aggiunti ad 1 Kg
42.Un sistema si espande da 1.00 a 1,50 m3 contro una pressione costante pari a 100 kPa. Quanto calore deve scambiare con l’ambiente circostante affinché la sua temperatura rimanga costante?
A) 50cal
B) -50 cal
C) -50kJ
D) 50 kJ
soluzione
in una trasformazione irreversibile come nel caso specifico sappiamo che ΔΕ = Q – L
se la temperatura rimane costante ΔΕ =0 quindi Q=L che ci indica che il lavoro compiuto dal sistema viene trasformato in calore Q. Il lavoro, nel caso di una trasformazione irreversibile è
L= P(V2-V1)=Q essendo il lavoro il risultato di una forza applicata ad un corpo e che produce lo spostamento di quest’ultimo, e poichè la forza si esprime i Newton l’unità di misura è Newton x metro definita anche Jaule. 1000J=1KJ
pertanto essendo ΔV (lo spostamento) = 1,50- 1 =50 m³ cioè 50000 litri e P( la forza) =100 Pa possiamo scrivere
100 x 500 =PΔV = 50000 J = 50 KJ
risposta corretta D
43. A 20°C la costante cinetica di una data reazione del primo ordine, è 8,0 x 10-3 s-1 Sapendo che 1’energia di attivazione è 32 KJ/mol, calcolare il valore della costante cinetica a 40 °C
A) 1,8 X 10-2 s-1
B) 8,0 X 10-3 s-1
C) 8,0 X 10-2 s-1
D) 1,3 X 10-2 s-1
soluzione
La velocità di una reazione dipende dalla temperatura e l’equazione di Arrhenius mette in relazione la costante di velocità con l’energia di attivazione e la temperatura.
44. Se x è la velocità con cui si consuma l’ammoniaca nel corso della
reazione 2 NH3 (g)+ N2(g)+3 H2(g).
quale sarà la velocità con cui si produce idrogeno?
A) 3/2x
B) x
C) 2x
D) 2/3 x
soluzione
dalla reazione di formazione di H2 si vede che ogni 2 molecole di NH3 se ne formano 3 di H2, quindi il rapporto di formazione di H2 è 3/2 .
45. Il ΔΗ della reazione PCl5(g) + PCl3(g) + Cl2(g) è positivo. Come si può spostare l’equilibrio verso la formazione dei prodotti?
A) non si può influire sull’equilibrio termodinamico di una reazione
B) aumentando la temperatura elo diminuendo la pressione
C) diminuendo la temperatura
D) aggiungendo un catalizzatore
soluzione
il ΔΗ di una reazione è dato dalla differenza ∑ Hprodotti – ∑ Hreagenti. Quando il ΔΗ è positivo significa che i reagenti hanno valore di H la cui somme è più alta di quella dei prodotti e quindi la reazione è ENDOTERMICA cioè avviene con assorbimento di calore, se invece il ΔΗ è negativo la reazione avviene con produzione di calore cioè si ha una reazione ESOTERMICA.
quindi in generale
A+B ⇄ C+D + Q per una reazione esotermica
A+B ⇄ C+D – Q per una reazione endotermica
Il calore quindi può essere considerato come se si trattasse di un composto chimico per cui per una reazione endotermica si potrebbe scrivere
Q+A+B ⇄ C+D
pertanto se aggiungiamo calore nella reazione ENDOTERMICA l’equilibrio si sposterà a destra,
per una reazione esotermica
A+B ⇄ C+D + Q
se vogliamo che la reazione proceda verso destra dobbiamo toglier calore .
In una reazione endotermica, l’aumento di pressione sposterà l’equilibrio verso destra perché viene diminuito il cammino libero medio delle molecole che quindi si urteranno con maggiore frequenza e formeranno i prodotti.
Nel caso in esame,
PCls(g) +1 PCb(g) + Cl2(g) essendo ΔΗ positivo significa che
PCls(g) +1 PCb(g) + Cl2(g) – Q
la reazione è endotermica, pertanto per spostare l’equilibrio verso destra occorre aumentare la temperatura e la pressione.
risposta corretta B
46. L’anidride carbonica prodotta dall’attività umana è la causa principale dell’ effetto serra. Chimici di tutto il mondo stanno cercando metodi che ne diminuiscano il contenuto nell’atmosfera. Uno di questi è utilizzare tale gas per produrre metanolo (CELOR) tramite la reazione. catalizzata, da bilanciare:
CO2(g) + H2(g) → CH3OH(l) + H2O(l)
Indicare quanti litri di CO2 (considerare un comportamento ideale del gas in condizioni standard STP: T = 273,15 K. P = 101,3 KPa) si consumano per ogni tonnellata (1.00 x llY kg) di metanolo prodotto.
A) 7 x 103 L
B) 70 x 103 L
C) 700 x 1o3 L
D) 7000 x 103 L
soluzione
in questa reazione il C si riduce mentre l’idrogeno si ossida, infatti:
2[Cn.o.+4 +6e → Cn.o ++1,-3 =-2
6[H2 n.o.=0 → 2H+ +2 e
quindi
2 CO2(g) + 6H2(g) → 2CH3OH(l) +2H2O(l)
Sappiamo che a condizioni normali (c.n.) 1 mole di un qualunque gas occupa un volume di 22,414 litri quindi 44 g di CO2 occupano un volume di 22,414 litri e 2 x 44 = 88 g che costituiscono le 2 moli consumano 2x 22,414 litri per formare 2 moli di CH3OH cioè 2 x 32 g di CH3OH .
Ne consegue che se 2x 22,414 litri si consumano per ottenere 2 x 32 g di CH3OH allora X g di CO2 saranno consumati per ottenere 1000 Kg cioè 1 x 10 6 g di CH3OH
44,82 : 64 = X : 1 x 106
X=0,700 x 106
X= 700 x 103 Litri
risposta corretta C
47. Nella struttura di Lewis dello ione BF4- quante sono le cariche formali sul boro:
A) -2
B) -1
C) o
D) +1
soluzione
Con carica formale (FC) si indica la carica assegnata ad atomo di una molecola assumendo che gli elettroni di legame siano condivisi tra gli atomi indipendentemente dalla loro elettronegatività.Può essere calcolata con la seguente equazione:
FC = elettroni di valenza atomo nello stato fondamentale – elettroni di on legame – numero totale di legami (coppie di elettroni)
FC = EV – EN – NL
per esempio in in CH4 sono 4 gli elettroni di valenza zero quelli di non legame e 4 legami
FC= 4-0-4 =0
In NO3- l’azoto ha 5 elettroni di valenza – 0 coppie di non legame – 4 coppie di legame
FC= 5-0-4 =+1
per BF4 – la cui struttura è:
si hanno 3 elettroni di valenza 0 coppie di non legame e 4 legami quindi
FC = 3 – 0 – 4 =-1
risposta corretta B
48 Indicare. sulla base della teoria VSEPR,la coppia che presenta la stessa geometria:
A) H2O e CO2
B) CO2 e CH3- ‘
C) H2Oe Cl2O
D) CH3- e Cl2O
soluzione
sappiamo che la molecola H2O ha struttura tetraedrica
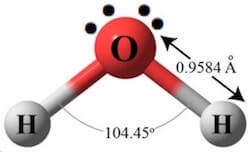
in quanto l’O è ibrido SP3 e possiede 2 doppietti liberi nei due orbitali SP3 non impegnati in legami. L’angolo di legame è inferiore ai 109°,28′ di un angolo tetraedrico perché i due doppietti tendono a stare più lontano possibile per effetto della loro carica negative e quindi i due atomi di H si avvicinano. Secondo la teoria VESPR la struttura è AX2E2 ed è angolata.
La molecola di CO2 è lineare, mentre in CH3- il carbonio è ibrido SP2 cioè gli atomi giacciono sullo stesso piano.
Cl2O ha la struttura analoga a quella dell’acqua solo che l’angolo di legame tra i due atomi di Cl è maggiore anche se di poco all’angolo di 109° infatti è 110° 9′ ciò per effetto della repulsione tra i due atomi di Cl . Per la teoria VESPR la struttura è AX2E2 e quindi angolata.
49, A 728 K il fosgene (COCl2) si decompone termicamente secondo la reazione:
COCl2(s) ⇄ CO(g) + O2{g)
Se in un recipiente chiuso del volume di 1,000 L vengono introdotti 2,451 g di fosgene la sua pressione parziale ad equilibrio raggiunto è il 50,0% della pressione totale Calcolare la costante di equilibrio (Kp). Considerare il comportamento dei gas ideale ed esprimere le pressioni in kPa.
A) 25,0
B) 12,5
C) 0,242
D) 0,125
soluzione
Moli di COCl2= 2.451/98.92=0.02478
la pressione iniziale è calcolata dall’equazione di stato dei gas
Ptot =( n/v ) RT =( 0,02478/1 )x 0,0821 x 728 =1,480 atm
All’equilibrio per la reazione
COCl2(s) ⇄ CO(g) + O2{g)
1,480-x x x
per cui otteniamo
P COCl2 = 1.480-x
P CO = P Cl2 = x
Sappiamo inoltre che la pressione totale all’equilibrio è la somma delle pressioni parziali
P=P COCl2 + P CO + P Cl2
P = 1.480-x+x+x
Pt= 1.480+x
sappiamo inoltre che Ppcocl2 = 0,5%Pt cioè COCl2 ha una pressione parziale pari al 50% di quella totale pertanto sia CO che Cl2 hanno rispettivamente una pressione parziale del 25%
Quindi x = 0.25 P
Da cui Pt = x/0.25
poichè però Pt= 1,480 +x possiamo scrivere
1.480+x = x/0.25 da cui
0.370 + 0.25x=x
0.370 = 1-0,25 x = 0.75 x
quindi possiamo calcolare x
x = 0.493 atm
P COCl2 = 1.480-x = 1.480 – 0.493 = 0.987 atm = 100,008 kPa
P CO = P Cl2 = x = 0.49333 atm = 49,987 kPa
Kp = (49,987)²/ 100,008=24,99 =25
risposta corretta A
50. 52,42 g di un carbonato di formula X2CO3 sono trasformati quantitativamente in 101,78 g del corrispondente bromuro. Di quale carbonato si tratta?
A) LiCO3
B) Na2CO3
C) K2CO3
D) Rb2CO3
soluzione
supponiamo si tratti di Li2CO3 in tal caso con la proporzione seguente otteniamo i grammi iniziali di Li2CO3 e se tali grammi coincidono co 52,43 allora il carbonato è Li2CO3
Li2CO3 : 2 LiBr = X = 101,7 X= 73,9 x 101.7 / 173,68 = 43,27 g di Li2CO3
Na2CO3 :2NaBr =X :101,7 X= 105,9 x 101,7 / 20 5,38 = 52,44 Na2CO3
K2CO3 :2 KBr = X : 101,7 X = 138,2 x 101,7/ 238 = 59,0 K2CO3
Rb2CO3 :2 RbBr = X : 101,7 X= 230,94 x 101,7 / 330,6= 71,0 Rb2CO3
il composto X2CO3 è il carbonato di sodio Na2CO3
risposta corretta B
51. Quanti grammi di PbO e di SO2 si possono ottenere mettendo a reagire 478 g di PbS e 192 g di O2 secondo la reazione da bilanciare
PbS(s) + O2(g) -+ PbO(s) + SO2(g)
A) 1328 g di PbO e 384 g di SO2
B) 669 g di PbO e 192 g di SO2
C) 446 g di PbO e 223 g di SO2
D) 446 g di PbO e 128 g di SO2
soluzione
la reazione bilanciata è
4[S-2 → SO2 +6e
6[2O + 4e → 2O-2
2PbS(s) + 3O2(g) → 2 PbO(s) +2 SO2(g)
PM 239,3 PM223,2
quindi per 2 moli di PbS si ottengono 2 PbO e 2 SO2 pertanto
2x 293 = 478 g formano 2×223 = 446 g di PbO 2 x 64 = 128 g di SO2
pertanto da 478 g di PbS si ottengono 446 g di PbO e 128 g di SO2
risposta corretta D
52,L’anione X- di un acido debole HX forma un composto poco solubile con il calcio, CaX2(s) con costante di solubilità pari a 10-10,4 . Calcolare la costante di ionizzazione di HX sapendo che il valore della costante di equilibrio della reazione che segue è :
K= 10-4
CaX2(s)+ 2H+(aq) -> Ca2+(aq) + 2HX(aq)
A) 10-3.2
B) 10-4,6
C) 10-7,1
D) 10-8,3
soluzione
CaX2(s)+ 2H+(aq) -> Ca2+(aq) + 2HX(aq) la cui costante di equilibrio è
Keq= [Ca+2] [HX]² /[H+]² = 10-4
[Ca+2] / Keq = ([H+]² / [HX]²)
la Ka di dissociazione di HX è
HX![]() H+ + X- Ka = [H+][X-] / [HX]
H+ + X- Ka = [H+][X-] / [HX]
se eleviamo tutto al quadrato Ka²= [H+]²[X-]² / [HX] ²
ma dal precedente equilibrio sappiamo che [Ca+2] / Keq = ([H+]² / [HX]²)
quindi Ka² = [X-]² [Ca+2] / Keq
ma dal valore di Kps = 10-10,4 = [Ca+2] [X-]² quindi sostituendo questo valore nella precedente espressione, che era
Ka² = [X-]² [Ca+2] / Keq si ha
Ka² = Kps /Keq cioè Ka² =10-10,4 / 10-4 = 10-6,4
per cui Ka= 10-3,2
risposta corretta A
53 25,00 mL di una soluzione acquosa di acido formico (HCOOH) 0,0500 M sono titolati con una soluzione acquosa di NaOH 0,0200 M, Calcolare il pH del punto di equivalenza.
A)7,95
B) 6,32
C) 10,21
D) 9,73
soluzione
l’acido formico è un acido debole ed al punto di equivalenza tutto l’acido è trasformato in sale sodico
HCOOH + NaOH → HCOONa
questo è un sale costituito da acido debole e base forte ed in soluzione subisce idrolisi
HCOO- +H2O⇄ HCOOH +OH-
da cui Kidr = [OH-]² / [HCOO-]
ma [HCOO-] non è altro che la concentrazione del sale che indichiamo con Csale quindi Kidr = [OH-]² / Csale ma la Kidr =Kw /Ka pertanto
[OH-] = √ Kw/Ka x Cs
Nel caso in esame la concentrazione del sale viene dalla neutralizzazione completa di HCOOH
e siccome VxM = V x M
25 x 0,05 = V x 0,02
da cui si ottiene il volume di NaOH aggiunto per ottenere la completa neutralizzazione
V= 25 x 0,05 /0,02= 62,5 ml
La concentrazione del sale è pertanto costituita dalle moli del sale formatosi cioè
25 x 0,05 = 1,25 millimoli cioè 1,25 x 10-³ moli in un volume finale di 25 + 62,5 = 87,5 ml
la concentrazione tuttavia deve essere sempre espressa in Moli /litro quindi
se in 87,5 ml vi sono 1,25 x 10-³ moli , in 1000 ve ne sono X
X= Csale = 1,25 / 87,5 = 0,01428 Molare
Il PH è calcolato dalla [OH-] = √ Kw/Ka x Cs
Ka tabulato è 1,8 x 10-4
[OH-] = √ (10-14 / 1,8 x 10-4 ) x 0,01428 =√0,5 x10-10 x 0,01428 =√0,00793x 10-10 =0,0890 x 10-5 = 8,9 x 10 -7 moli/L
[OH-] = 8,9 x 10 -7
POH = 7 -log 8,9 = 7- 0,95=6,05
PH= 14 – POH = 14- 6,05 = 7,95
PH= 7,95
risposta corretta A
54. Immergendo una barretta di Fe(s) in una soluzione acquosa 0,1 M in PbCl2, 0,1 M in MnCl2, 0,1 M in MgCl2 e 0,001 M in HCl, che cosa si osserva?
A) Si deposita Mn(s)
B) Non si osserva nulla
C) Si deposita Mg(s)
D) Si deposita Pb(s)
soluzione
Il potenziale di riduzione di una specie chimica è la tendenza a perdere o acquistare elettroni quando nella soluzione in cui si trova si aggiunge una specie chimica diversa. Una soluzione con un potenziale di riduzione più positivo o meno negativo rispetto alla specie aggiunta tenderà a ricevere da questa degli elettroni, mentre una soluzione con un potenziale di riduzione meno positivo o più negativo tenderà a perdere elettroni, cioè sarà ossidata riducendo le nuove specie.
il potenziale di riduzione standard E° per gli ioni in esame è:
Fe2+(aq) + 2 e- ==> Fe(s) -0,44 V
Pb2+(aq) + 2 e- ==> Pb(s) -0,126 V
Mn2+(aq) + 2 e- ==> Mn(s) -1,18 V
Mg2+(aq) + 2 e- ==> Mg(s) -2,37 V
2H+ +2 e ==> H2 0,0 V
Cl2(g) + 2 e- ==> 2 Cl-(aq) 1,36
sappiamo inoltre che il potenziale di una coppia redox è
E=E° + RT/nF x log [ forma ossidata]/ [forma ridotta]
per gli elementi in esame si ha
Epb = -0,126 + 0,06 / 2 log [Pb+2] = -0,126 + 0,03 x log 10-1 = -0.126 + o,03 x -1 = – 0,156 V
EMg = -2,37 + 0,06/2 log[Mg+2] = -2,37 + 0,03 log 10-2 = -2,37 + 0,03 x -2 = -2,43 V
EMn = -1,18 +0,06/2 log [Mn+2] = – 1,18 + 0,03 x log 10-1 = -1,18 + 0,03 x -1 = -1,21 V
EH2 =0 +0,03 log 10-3 = –0,09 V
ECl2 = 1,36 +0,03 log 10-3 = 1,27 V
la reazione principale da considerare è:
Fe(s) ==> Fe2+(aq) + 2 e E°=+0,44 V
è evidente che il Fe(s) si scioglie nella soluzione formando Fe+2 agisce da riducente nei confronti degli altri ioni e quello che si riduce per primo è quella specie con valore di E meno negativo che in questo caso è il Pb +2 che ha un valore di E= -0,156 V
risposta corretta D
55. Conoscendo le costanti di solubilità di AgCl e AgSCN Calcolare la costante di equilibrio della reazione:
Ag(s) + SCN- (aq) → AgSCN(s) + Cl(aq)
A) 871
B) 180
C) 288
D) 543
soluzione
K eq = [AgSCN(s)] x [ Cl-(aq)] / [Ag(s)] x [SCN- (aq)]
ma i composti allo stato solido non si considerano quindi
Keq = [ Cl-(aq)] / [SCN- (aq)]
conoscendo i valori del KPs di AgCl e AgSCN è possibile calcolare i valori di
[ Cl-(aq)] e di [SCN- (aq)]
infatti KPs1 /[Ag+] = [ Cl-(aq)] e KPs2/[Ag+] = [SCN- (aq)]
quindi Keq= KPs1/[Ag+] / Kps2 /[Ag+]= KPs1/[Ag+] x [Ag+] /Kps2 =Kps1/Kps2 =1,8 x 10-10 / 1,0 x 10-12 = 1,8 x 102
Keq = 180
risposta corretta B
56, Ad una soluzione acquosa 0,01 M in Na2CrO4 e 0,020 M in NaCl si aggiunge lentamente AgNO3(s). Si verificano le seguenti reazioni:
Cl-(aq) + Ag+(aq) —–> AgCl(s)
CrO4-2(aq) + 2Ag+(aq) —-> Ag2Cr04(s)
Calcolare la concentrazione di Cl- quando inizia la precipitazione di Ag2Cr04(s).
A) 2,9x 10-7M
B)2,7x 10-5 M
C) 6 ,0 X 10-6 M
D) 4,2 X 10-8 M
soluzione
essendo [Cl-]= 0,02 M la [Ag+] necessaria alla precipitazione è 1,8 x 10-10 / 0,02 = 1,8 x 10-8
se Ag2 CrO4 comincia precipitare significa che viene raggiunto il valore del Kps di Ag2CrO4 , ed in questo caso si ha:
Kps Ag2CrO4 = [Ag+]² x [CrO4-2] da cui possiamo conoscere la [Ag+] al momento della precipitazione
[Ag+] =√ Kps / [CrO4-2]
ma Ag+ ha reagito prima con Cl- facendo precipitare AgCl quindi Kps AgCl = [Ag+] x [Cl-]
e sostituendo ad [Ag+] il valore trovato sopra cioè √ Kps / [CrO4-2] avremo KpsAgCl=√ Kps / [CrO4-2] x [Cl-]
dalle tavole dei Kps sappiamo che Kps AgCl = 1,8 x 10-10 e Kps Ag2CrO4 = 9 x 10-12
1,8 x 10-10= √9 x 10-12 /0,02 x[ Cl-]
1,8 x 10- 10= 3 x 10 -5 x Cl Cl= 0,6 x 10 -5 =6 x 10-6
quindi quando comincia a precipitare Ag2CrO4
[Cl-] = 6,0 x 10 -6 moli /L
risposta corretta C
57. Una soluzione contenente lo ione Pb2+ in concentrazione 0,0010 M; lo ione Mn2+ in concentrazione 0,50 M e lo ione Mg2+ in concentrazione 0,05 M viene alcalinizzata gradualmente per aggiunta di NaOH(s). Indicare l’ordine di precipitazione dei metalli sotto forma di idrossidi.
A)Pb,Mg,Mn
B) Mg,Pb,Mn
C) Pb,Mn,Mg
D) Mn,Pb,Mg
soluzione
per rispondere al quesito è necessario conoscere i valori di Kps per gli idrossidi.
KPSPb(OH)2 = 2,8 10-16
KPSMn(OH)2 = 4,6 10-14
KPS Mg(OH)2 = 1,5 10-11
ricordiamo che precipita prima lo ione che richiede minor quantità di reattivo e la quantità di OH– richiesta nei tre casi è:
[OH-] = √ KPS/ [Pb+2 ] = 2,8 x 10 -16 / 0,001 = √2,8 xx 10 -13 = 5,29 x 10-7 moli /L
[OH-] = √ KPS/ [Mn+2 ] =√ 4,6 x 10 -14 / 0,5 = √ 9,2 x 10 -14 = 3,0 x 10- 7 moli/L
[OH-] = √ KPS/ [Mg+2 ] = √ 1,5 x 10-11 / 0,05 =√3,0 x 10 -10 = 1,7 x 10- 5 moli / L
la minore quantità di [OH-] è richiesta dallo ione Mn+2 seguito dal Pb+2 e quindi dal Mg+2
da questi valori si evince che precipita prima lo ione Mn+2 poi lo ione Pb+2 ed infine Mg+2
risposta corretta D
58. Una soluzione satura di Bil3(s) contiene 589,7 mg di sale in 1 ,00. L di acqua. Calcolare la costante di solubilità di BiI3.
A) 4,76 x 10-10
B) 6,35 x 10-8
C) 8,21 x 10-9
D) 2,70 x 10-11
soluzione
BiI3 (s) ⇄ Bi+3(aq) + 3 I-(aq)
se indichiamo la solubilità di Bi+3 con S la solubilità di I- è 3S
pertano il KPS = S x (3S)³ = 27 S4
ed essendo S= 589,7 mg /l = 0,5897 g /l = 0,5897 /589,7 moli /L = 0,001 M si ha
KPS= 27 ( 0,001)4
KPS = 27(10-3)4
KPS =27 x 10-12 = 2,7 x 10-11
risposta corretta D
59. Per trattamento con HBr il geraniolo produce il bromuro riportato. Qual è la sequenza di eventi più plausibile per spiegare la formazione di tale prodotto?

A) Protonazione del gruppo OH, eliminazione di H20, stabilizzazione del carbocatione formato e addizione dell’anione bromuro.
B) Addizione di HBr al doppio legame, protonazione del gruppo OH ed eliminazione di HzO.
C) Deprotonazione del gruppo OH, formazione di un intermedio ciclico a 4 termini, attacco dell’anione bromuro con eliminazione di H20.
D) Protonazione del gruppo OH, eliminazione di HzO con formazione di un diene coniugato, addizione di HBr.
soluzone
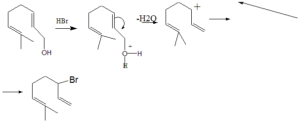
il primo attacco avviene sull’ossigeno dell’OH del geraniolo che attira gli elettroni del doppio legame vicino e che si stacca come H2O mentre contemporaneamente forma il nuovo doppio legame con la somma del Br sul Carbocatione
la risposta corretta è A
60. Disporre in ordine di basicità crescente i seguenti anioni: cloruro, acetiluro, etossìdo, metiluro.
A) Cloruro, acetìluro, metiluro, etossido
B) Cloruro, etossido, acetiluro, metiluro
C) Metiluro, acetiluro, etossido, cloruro
D) Etossido, cloruro, acetiluro, metiluro
soluzione
un aceltiluro ha la forma



Lascia un commento