GIOCHI DELLA CHIMICA 2013 FASE REGIONALE CLASSI A e B
1. Una soluzione è una miscela:
A) di due o più componenti, uno liquido (solvente) e uno solido (soluto)
B) di due o più sostanze
C) omogenea di due o più sostanze
D) omogenea liquida di due o più sostanze
soluzione
Una soluzione è una miscela in cui una o più sostanze sono contenute in una fase che può essere liquida,solida,gassosa generalmente in quantità più elevate (chiamata solvente) rispetto alla sostanza contenuta (soluto). Si evince che si possono avere soluzioni liquide, soluzioni solide,soluzioni gassose.
Una soluzione omogenea contiene particelle di diversa natura mescolate in modo uniforme cosicchè la soluzione presenta la medesima composizione in ogni suo punto.Per fare un esempio, lo zucchero sciolto in un bicchiere d’acqua è una soluzione omogenea.L’acqua è il solvente, lo zucchero è il soluto.La soluzione è omogenea perché qualsiasi campione di soluzione prelevato in qualsiasi punto del bicchiere ha sempre la stessa composizione in zucchero.
La soluzione è eterogenea se presenta differente composizione in almeno due punti.
In una soluzione, il soluto generalmente ha dimensioni inferiori ad 1 nm,( 10-8 cm) tuttavia, quando le dimensioni delle particelle risultano comprese tra 1 e 1000 nm, si parla di soluzione colloidale ed il soluto è detto colloide.
Da quanto esposto si deduce che la risposta corretta è C
2. Completare in modo corretto. La molalità (m) del soluto di una soluzione:
A) non dipende dalla T
B) dipende dalla T
C) è data dalla quantità chimica di soluto presente in 1 L di solvente puro
D) è data dalla quantità chimica di soluto presente in 1 L di soluzione
soluzione
la Molalità è uno dei modi con cui si esprime la concentrazione di un soluto in una soluzione. E’ infatti definita come la quantità in MOLI di soluto contenuta in 1 Kg di solvente.
la Molarità invece è definita come la quantità in MOLI di soluto in 1 LITRO di solvente.
Ma per quale motivo e quando si usa la Molalità ?
E’ preferito l’uso della Molalità quando si ha da fare con lavori di chimica fisica, perchè la Molalità è indipendente dalla temperatura. Infatti, se consideriamo un litro di acqua dove sia disciolta una mole di una certa sostanza, all’aumentare della temperatura il volume dell’acqua aumenta mentre la sua massa rimane costante (a parità di moli di soluto), per cui la molalità rimane uguale, mentre la molarità sarà diminuita (infatti le stesse moli di soluto dopo il riscaldamento si troveranno in un volume maggiore di liquido).
Pertanto la riposta corretta è A
3. I composti ionici sono prevalentemente solubili in solventi
A) polari
B) aprotici
C) protici
D) apolari
soluzione
i composti ionici sono quei composti che nello stato cristallino si trovano sotto forma di ioni. Un esempio è il cloruro di sodio NaCl ,

in questo cristallo gli ioni Sodio con carica positiva si trovano ai vertici di un reticolo cubico intervallandosi con lo ione Cloro con carica negativa.Le attrazioni elettrostatiche (legame ionico) tengono insieme gli ioni nel cristallo. Quando il cristallo è immesso nell’acqua, poiché questa è costituita da molecole che presentano sull’ossigeno una carica parziale negativa δ- e sull’idrogeno una carica parziale positiva δ+ (la molecola di acqua possiede un momento dipolare)si avvicinano agli ioni Sodio del cristallo con la parte dell’ossigeno carico negativamente e dalla parte dell’idrogeno carico positivamente con una forza di attrazione che attrae i singoli ioni del cristallo : questo indebolisce l’attrazione tra gli ioni nel cristallo e rompe la struttura cristallina. Immediatamente l’acqua circonda ogni singolo ione creandogli intorno una sfera di solvatazione.Il processo continua con tutti gli ioni del cristallo sino a che tutti gli ioni passano in soluzione circondati dalle molecole di acqua.Il processo è detto solvatazione.
Si deduce che la risposta corretta al quesito è A
A) NA = 6,0226 ·1023 mol–1; simbolo variato
B) N = 6,0226 ·1023 mol–1; simbolo invariato
C) NA = 6,0226 ·10–23 mol-1; simbolo variato
D) NA = 6,0226 ·10–26 mol–1; simbolo variato
soluzione
Il numero di Avogadro è l’unità di misura di una quantità ed è costituita da 6,02x 10²³ unità. Per esempio, così come una dozzina indica 12 unità ed una decina si riferisce ad una quantità di 10 unità, allo stesso modo il numero di Avogadro (NA ) indica 6,02x 10²³ unità. In una quantità in grammi pari al peso atomico di un qualunque elemento (che si definisce 1 grammoatomo) vi sono sempre NA atomi di elemento cioè 6,02x 10²³ atomi ed in una quantità in grammi pari al peso molecolare di una qualunque molecola ( definita 1 mole) contiene una quantità di molecole pari 6,02x 10²³ molecole. Un numero di Avogadro NA di elettroni sono 6,02x 10²³ elettroni ed un numero di Avogadro NA di ioni sono 6,02x 10²³ ioni.
Questo permette di calcolare ad esempio quante molecole reali vi sono in un certo numero di grammi di una molecola. Considera l’H2O il cui peso molecolare è 18 grammi se desideriamo conoscere quante molecole reali di H2O vi sono in 60 grammi di acqua dobbiamo fare la proporzione :
se in 18 g (cioè peso molecolare) vi sono 6,02x 10²³ molecole in 60 grammi ve ne saranno X cioè
X= 60 x 6,02x 10²³ / 18 = 20 x 10²³ molecole cioè in generale
numero di molecole(atomi,ioni) = grammi x 6,02x 10²³ /Peso molecolare (peso atomico,peso dello ione)
da quanto esposto si evince che la risposta corretta è A
5. Una soluzione acquosa di CH3COOH (1 L, a 25°C; Ka = 1,8 ·10–5 a 25 °C) ha titolo incognito. Per salificarla completamente con KOH si usano 0,64 mol di base. Pertanto il pH della soluzione iniziale e quello della soluzione a salificazione completata (punto di equivalenza) sono:
A) pH iniziale = 4,3 ; pH al p.eq. neutro
B) pH iniziale = 2,5 ; pH al p.eq. basico
C) pH iniziale = 5 ; pH al p.eq. neutro
D) pH iniziale = 5,6 ; pH al p.eq. basico
soluzione
inizialmente il PH è quello di un acido debole:
CH3COOH <===> H+ + CH3COO-
Ka= [H+] [CH3COO-] / [CH3COOH] = 1,8 x 10 -5
essendo [H+] = [CH3COO-] ed essendo [CH3COOH] = concentrazione iniziale dell’acido, si ha [H+]² = Ca Ka
per calcolare il PH iniziale dobbiamo conoscere Ca che si ottiene dai dati della sua titolazione
infatti sappiamo che l’acido viene completamente salificato con 0,64 moli che sono equivalenti alle moli di acido prwesenti pertanto sapendo che nella titolazione
volume x concentrazione dell’acido = volume x concentrazione base usata cioè
Ca x Va = moli di base adoperati
avremo
Ca x 1 litro = 0,64 moli pertanto adesso possiamo calcolare il PH calcolando prima l'[H+] iniziale che per un acido debole abbiamo visto è
[H+]= √Ka x Ca
PH iniziale = – log [H+] dove [H+]= √Ca x Ka = √0,64 x 1,8 x 10 -5 =√11,52x 10-6 =3,39 x 10-3
PH = -log 3,39 x 10-3 = 3-0,5 = 2,5
Alla fine della titolazione, tutto il CH3COOH è stato trasformato in CH3COONa per cui il PH deriva dall’idrolisi di questo sale
CH3COO- + H2O <===> CH3COOH + OH- [OH-]² = Cs x Kb ma Kb= Kw/Ka quindi
da cui [OH-] =√(Kw/Ka) x Cs
da cui [OH-]= √10-14 x 0,64 / 1,8 x 10-5 = √0,35 x 10-9
POH = -log 1,8 x 10-5 = 5-0,27 =4,73
PH = 14- 4,73= 9,27
Il PH è quindi Basico
risposta corretta B
6. Il valore della massa molecolare relativa, detta anche peso molecolare, è:
A) espresso da un numero puro adimensionale trattandosi di una grandezza relativa
B) espresso in u.m.a. o in Da
C) espresso solo in u, il vecchio u.m.a. non si usa
D) espresso in g mol–
soluzione
L’unità di massa atomica unificata (u) detta anche dalton (Da) è l’unità di misura della massa che pur non facendo parte del Sistema S.I. è tuttavia utilizzata internazionalmente in chimica biochimica e biologia. I suoi precedenti simboli amu (dall’inglese atomic mass unit) o uma, l’acronimo in lingua italiana non sono più utilizzati. L‘ unità di massa atomica unificata è la dodicesima parte della massa del nuclide 12C pertanto si tratta di un valore relativo.La massa molecolare è quindi la somma delle masse atomiche relative degli atomi presenti nella molecola. Essendo le masse atomiche relative alla massa del nuclide 12C, è evidente che la massa molecolare non ha dimensioni. Ad esempio la massa dell’idrogeno è 1 u /12 u e semplificando u , la massa è 1/12 di quella del C12 quindi non ha dimensioni.
Risposta corretta A
7- Bisogna preparare una soluzione di K2Cr2O4(1,00 ·10–1 L; 5,00 ·10–2 M). Indicare il volume di soluzione 2,5 x 10-¹ che bisogna usare:
A) 2,00 ·10–2 L
B) 2,00 ·10–1 L
C) 1,00 ·10–1 L
D) 3,50 ·10–1 L
soluzione
sappiamo che:
volume x conc = volume x conc quindi 1,00 ·10–¹ x 5,00 ·10–² = V x 2,5 x 10-¹ da cui è agevole calcolare il volume :
V = 5x 10-³ / 2,5 x 10-¹ V = 2 x 10-² L
risposta corretta A
8. Indicare la massa di PCl3 che si può ottenere dalla reazione quantitativa di 125 g di P4 con 325 g di Cl2:
A) 420 g di PCl3
B) 210 g di PCl3
C) 549 g di PCl3
D) 105 g di PCl3
soluzione
la reazione è P4 + 6 Cl2 →4 PCl3
la quantità stechiometrica di Cl2 necessaria per far reagire 125 g di P4 è così calcolata :
se i grammi che costituicono una molecola di fosforo (che è tetratomica P4) reagiscono con i grammi di 6 molecole di cloro, 125g di P4 reagicono con X grammi di Cl2 cioè:
P4 :6Cl2 = 125 😡 X= 125 x 426/ 123,8 =430 g tuttavia il quesito ci dice che mettiamo a reagire 325 g non 430 g per cui
se 4 di PCl3 si ottengono da 430 g di Cl2 X si ottengono da 325 perciò:
4PCl3 : 430 = X : 325 X= 4×137,5 x 325 / 430 = 416 g
9. Indicare tra i seguenti gruppi della tavola periodica quello che contiene esclusivamente
elementi non metallici: IA, IIIA, VA, VIIA, VIIIA,
A) IA
B) IIIA
C) VA
D) VIIA
soluzione
I metalli sono buoni conduttori di elettricità e calore, lucidi, duttili e malleabili. I non metalli, invece, sono cattivi conduttori di elettricità e calore, in genere sono gassosi a temperatura ambiente.diamo uno sguardo alla tavola periodica degli elementi:

in questa tabella viene indicata la vecchia nomenclatura cioè IA IIA ecc assieme a quella attuale 1,2,3,4 sino a 18 (VII A)
In base alla configurazione elettronica degli elementi, è possibile suddividere la tavola periodica in 4 blocchi :
1 – Il blocco s : gli elementi che ne fanno parte hanno gli elettroni più esterni in orbitali s. Fanno parte di questo blocco i metalli alcalini, i metalli alcalini-terrosi e l’idrogeno (gruppi IA e IIA) che anche facendo parte di questo blocco, non ha proprietà in comune con gli altri elementi di questo gruppo.
2 – Il blocco p : chiamato così poichè gli elementi presentano gli elettroni più esterni in orbitali p. In questo gruppo sono presenti i gas nobili, gli alogeni, i non metalli, i semimetalli e alcuni metalli.
3 – Il blocco d : ne fanno parte tutti i metalli di transizione e sono caratterizzati da elettroni che occupano orbitali d nel loro guscio più esterno
4 – Il blocco f : rappresentato dagli elementi di transizione interna i cui elettroni più esterni vanno ad occupare orbitali f. Sono tutti metalli e si suddividono in lantanidi e attinidi.
Sulla sinistra della tavola periodica troviamo gli elementi con caratteristiche metalliche e sono separati dai non metalli, disposti sulla destra separati da una ipotetica linea diagonale che va dal boro all’attinio .Gli elementi vicini alla diagonale o appartenenti alla diagonale, quali boro,silicio arsenico germanio,tellurio e polonio sono semimetalli. Ovviamente, gli elementi non metallici si trovano all’estrema destra della tavola e corrispondono agli elementi del gruppo IVA V A VI A VIIA. Tuttavia il gruppo che contiene solamente non metalli è il gruppo VIIA.
10. Una bombola contiene 48,5 L di N2 alla P di 3,22 ·103 kPa e a 23 °C. Indicare la massa (in g) di Ne che bisogna aggiungere nella bombola per portare la P a 7,6 ·103 kPa:
A) 8,0 ·102 g di Ne
B) 1,7 ·103 g di Ne
C) 3,4 ·103 g di Ne
D) 2,2 ·104 g di Ne
soluzione
dall’equazione di stato dei gas è possibile calcolare le moli n1 di gas Azoto iniziali conoscendo P,V e T infatti:
PV = n1 x RT pertanto 3,22 ·10³ x 48,5 = n1 x 8,314 x 300 da cui
n1 = 62,65 moli di N2
quando aggiungiamo il gas Neon (Ne) le moli diventano n1+n2 dove con n2 indichiamo le moli di Ne aggiunte. La pressione diverrà allora 7,6 x 103 kPa. Pertanto applicando l’equazione generale di stato dei gas avremo
PV=(n1+n2)RT cioè 7,6 x 103 x 48,5 = (n1+n2) 8,314 x 300 da cui
n1+n2= 7,6 x 103 x 48,5 / 2494,2 = 368600 /2494,2 =147,78 moli
ma le moli di azoto iniziali erano n1 = 62,65 moli, quindi le moli di Ne (Pat=20,2) sono:
n2=moli Ne = 147,8 – 62,65= 85,2 cioè g= 85,2 x 20,2 =1,7 x 103
risposta corretta B
11. Completare in modo corretto: Nella reazione: 2 H2S + SO2 → 3 S + 2 H2O
si osserva che:
A) per una mole di H2S si formano 3 mol di S
B) i due terzi dello S ottenuto si formano da H2S
C) per 1 g di SO2 si formano 3 g di S
D) la somma delle quantità chimiche dei reagenti è uguale alla somma delle quantità chimiche dei prodotti, in accordo con la legge di Lavoisier
soluzione
dalla reazione si evince che 2 atomi di zolfo derivano da H2S ed 1 atomo deriva da SO2. Pertanto 2 atomi di S su 3 (cioè i 2/3) provengono da H2S mentre 1/3 proviene da SO2.
La risposta corretta è B
12. Indicare nell’ordine la più bassa carica formale degli atomi di zolfo e di ossigeno nella struttura di Lewis più plausibile per H2SO4:
A) S = 0 ; O = 0
B) S = +6 ; O = –2
C) S = +1 ; O = +1
D) S = +2 ; O = –1
soluzione
|O|
._ || ._
|O===S——O—H
| **
|O|
|
H
13. Marya Sklodovska, ovvero Marie Curie, la prima donna a insegnare alla Sorbona, nello studiare se anche l’uranio metallico fosse radioattivo, si accorse che la pechblenda conteneva un elemento radioattivo a cui lei e il marito diedero il nome della Patria di uno di loro, rappresentato dal simbolo:
A) Bi
B) Po
C) Ra
D) Fm
L’elemento scoperto nella Pechblenda venne chiamato Polonio essendo Marie Curie di origini polacche.
risposta corretta B
14. Indicare in modo inequivocabile la quantità chimica di cloro che bisogna far reagire, perché la seguente reazione che coinvolge 5 mol di atomi di sodio sia completa:
2 Na + Cl2 → 2 NaCl
A) 2,5 mol di molecole di cloro
B) 5,0 mol di molecole di cloro
C) 5,0 mol di cloro
D) 1,0 mol di molecole
soluzione
se 2 moli di sodio reagiscono con 1 mole di cloro da 5 moli di Na reagiranno X moli di Cl2
5 x1 /2= 2,5 moli oppure si può eseguire il calcolo
45,97 : 71 =114,93:X X= 8160/ 45,97 = 177,5 grammi che corrispondono a 177,5/71 = 2,5 moli
risposta corretta A
15. L’ammoniaca usata in laboratorio è una soluzione acquosa di NH3 gas (14,8 M) con una densità pari a 8,98 ·10–1 g mL–1. Ciò permette di calcolare la sua frazione molare:
A) 6,4 ·10–5
B) 7,0 ·10–1
C) 2,92 ·10–1
D) 3,2 ·102
soluzione
la frazione molare di una miscela di composti A e B è il rapporto tra moli A /moliA + moli B
pertanto
massa soluzione = densità x volume = 0,898 x 1000 ml =898 g
massa NH3 = 14,8 x 17 = 251,6 g
massa di H2O = massa della soluzione – massa NH3 = 898-251,6 = 646,4 g
moli H2O = 646 /18 = 35,9 moli
frazione molare NH3 = x = moli NH3/ moli NH3 + moli H2O = 14,8/ 14,8 + 35,9 = 0,292
risposta corretta C
16. Individuare i coefficienti, disposti in ordine casuale, che permettono di bilanciare la seguente reazione: H2S + NO3 – + H+ → NO + SO4-2 + H2O
A) 3, 2, 2, 3, 4, 6
B) 3, 2, 8, 3, 4, 4
C) 4, 8, 8, 3, 8, 3
D) 4, 2, 2, 3, 4, 8
soluzione
la reazione è un’ossidoriduzione in quanto S-2 forma SO4-2 per cui il numero di ossidazione da -2 diviene +6
ovviamente l’NO3- si riduce ad NO cioè il n.o. dell’azoto da +5 si riduce a +2
la reazione redox bilanciata è pertanto:
3 [ S-2 4 H2O → SO4-2 + 8 H+ + 8 e
8 [NO3- 4 H+ +3e → NO +2 H2O
__________________________
3 S-2 + 8NO3- +12 H2O+ 32 H+ → 3 SO4-2 + 24H+ + 8 NO +16 H2O
3 S-2 +8NO3- + 8 H+ → 3SO4-2 + 8NO + 4 H2O
i coefficienti sono 3,8,8, 3,8,4
la risposta corretta è C
17. Indicare l’affermazione ERRATA a proposito della teoria acido base di Bronsted e Lowry:
A) le basi coniugate degli acidi forti in acqua sono basi talmente deboli da poter essere considerate ioni a carattere neutro
B) la base coniugata di un acido debole in acqua è una base forte
C) in acqua l’acido più forte esistente è H3O+
D) l’acqua livella la forza degli acidi che in essa si comportano da forti (HNO3, HClO4, HCl, etc.)
soluzione
un acido debole di Bronsted e Lowry si dissocia secondo la reazione:
HA<==> H+ + A- e di in questo caso la base coniugata dell’acido cioè A- è una base forte
la risposta corretta è B
18. Completare in modo corretto. Un ossido basico è un composto binario formato da:
A) un non metallo e ossigeno
B) un metallo e ossigeno
C) un alogeno e ossigeno
D) un metallo alcalino e ossigeno
soluzione
Gli ossidi basici si formano per reazione di un metallo e l’ossigeno. Si definiscono basici perché quando reagiscono con l’acqua, formano gli idrossidi cioè basi. Per esempio Na2O è un ossido formato dal metallo Na e dall’ossigeno: Na2O in acqua forma NaOH infatti : Na2O + H2O→ 2NaOH . L’NaOH che si forma è una base forte. Analogamente CaO è costituito da un metallo alcalino Ca e l’ossigeno e sciolto in acqua forma
CaO+ H2O→ Ca(OH)2 Ca(OH)2 è una base forte
la risposta corretta è B
19. La densità di un campione di una sostanza gassosa presente in natura è di 1,481 g L–1 a 27 °C e 9,86 ·104 Pa. Indicare la sua massa atomica o molecolare media e la sua natura chimica:
A) 37,5 u; Ar
B) 28,0 u; CO
C) 16,0 u; CH4
D) 32,0 u; O2
soluzione
dall’equazione generale di stato dei gas sappiamo che
PV=( gr/pM ) x RT
inoltre la densità di un gas indica quanto pesa il volume unitario cioè 1,481 g/l significa che un litro di gas pesa 1,841 g pertanto V=1 litro ed il peso è 1,481 g pertanto:
9,86 ·104 x 1 = 1,481 /PM x 8,314 x 300 da cui
PM= 2494,2x 1,481/9,86 ·104 = 3693,9/9,86 ·104 = 37,46 u il composto chimico dovrebbe essere il gas Ar il cui peso atomico è 39,9 u
20. Individuare i coefficienti, disposti in ordine casuale, della seguente ossidoriduzione:
NO3– + Zn + OH– → ZnO2-2 + NH3 + H2O
A) 1, 2, 3, 1, 2, 7
B) 1, 4, 4, 1, 2, 7
C) 2, 2, 4, 3, 5, 8
D) 6, 2, 2, 5, 5, 8
soluzione
la reazione è la seguente
2 [NO3- + 6H2O + 8e → NH3 + 9OH- ( N passa dal n.o. +5 a -3 )
8[Zn + 4OH- → ZnO2-2 + 2H2O + 2e
__________________________
NO3- +4 Zn + 16OH- +6H2O → NH3 + 4ZnO2-2 + 9OH- + 8 H2O
NO3- +4 Zn + 7OH- → NH3 + 4ZnO2-2 + 2H2O
i coefficienti sono: 1,4,7,1,4,2
risposta corretta B
21. Indicare il volume al quale deve essere portato 1 mL di una soluzione acquosa contenente 40 mg di AgNO3 per ottenere una soluzione di concentrazione pari a 16 mg mL–1 di AgNO3:
A) 5 mL
B) 2,5 mL
C) 3 mL
D) 4 mL
soluzione
moli di AgNO3 iniziali in 1 litro = (0,04 g/169,9 ) x 1000=0,2354 M
moli finali di AgNO3 in 1 litro = (0,016 /169,9) x 1000= 0,0942 M
il rapporto è 0,2354/0,0942 = 2,5 quindi occorre diluire 1 ml sino a 2,5 ml
si perviene allo stesso risultato effettuando il rapporto 40/16 = 2,5
22. Se si pone in freezer (-14°C) una bottiglia di vetro chiusa e colma di H2O liquida fino all’orlo e la si dimentica per 24 ore:
A) la si recupera, vuota per il 10%, con l’H2O liquida solidificata
B) la si recupera immutata nella forma con l’H2O liquida solidificata
C) la bottiglia si rompe a causa dell’ espansione dell’ H2O liquida che solidificando si espande e la rompe
D) l’acqua rimane di egual volume e liquida a causa della pressione che ha abbassato il suo punto di congelamento
soluzione
L’acqua, contrariamente agli altri liquidi, quando solidifica diminuisce la propria densità,(infatti, il ghiaccio galleggia sull’acqua) poichè
densità= massa /volume, se la densità diminuisce deve necessariamente aumentare il volume. Ne consegue che se si pone l’acqua nelle bottiglia di vetro e si sottopone alla temperatura del freezer essa congela aumentando il volume e la bottiglia di vetro si spezza.
La risposta corretta è C
23. Completare in modo corretto. Nell’espressione PV = nRT i simboli indicano:
A) pressione, volume, numero di moli, costante generale del gas perfetto e temperatura assoluta
B) pressione, volume, quantità di materia, costante generale del gas perfetto e temperatura assoluta
C) pressione, volume, quantità di sostanza,costante generale del gas perfetto e temperatura assoluta
D) Pa, L, quantità di sostanza, costante generale del gas perfetto e Kelvin
soluzione
P= pressione
V= volume
n= quantità di sostanza (non è il numero di moli perché la mole è un’unità di misura della quantità di sostanza)
R= costante generale dei gas perfetti
T = temperatura assoluta (T= C° + 273)
la risposta corretta è C
24. Indicare l’affermazione ERRATA a proposito dell’idrogeno:
A) H ha un solo elettrone, nella configurazione 1s1, per cui viene messo nel primo gruppo della tavola periodica
B) poiché H, come gli alogeni, ha un elettrone in meno rispetto alla configurazione del gas nobile He, viene anche inserito nel gruppo 17 (o VIIA) della tavola periodica
C) H viene anche messo nel gruppo 17 (VII A) della tavola periodica perché somiglia molto agli alogeni nelle proprietà chimiche
D) H forma composti binari, detti idruri, con gli altri elementi. Tali composti, in alcuni casi (es. metalli alcalini, Ca, Sr e Ba), hanno carattere salino
soluzione
L’idrogeno possiede un solo elettrone esterno e come gli alogeni viene inserito nel gruppo degli elementi del gruppo 17 della tavola periodica. Questo gruppo nella nomenclatura precedente era denominato VIIB o VIIA a seconda di due diverse convenzioni usate in Europa e negli Stati Uniti d’America.
La risposta corretta è quindi C
25. Indicare l’affermazione ERRATA a proposito dell’osmosi, fenomeno che comporta il passaggio del solvente attraverso una membrana semipermeabile dal solvente puro a una soluzione, o da una soluzione più diluita a una soluzione più concentrata:
A) la misura della pressione osmotica di una soluzione è data dall’espressione π = MRT, dove M è la molarità delle particelle del soluto in soluzione
B) la pressione osmotica è il meccanismo più importante per il trasporto di acqua nelle piante
C) la grande presenza di zucchero nelle marmellate è essenziale per impedire la sopravvivenza di batteri che vengono distrutti perché immersi in una soluzione ipertonica di zucchero
D) la pressione osmotica di una soluzione è π = mRT, dove m è la molalità delle particelle del suo soluto. m non può essere sostituita da M (molarità) che risulta molto diversa. Infatti, π non è una proprietà colligativa e perciò non riguarda soluzioni molto diluite ( CM≤ 10–3 M), dove M può essere sostituita da m
soluzione
La pressione osmotica è una proprietà colligativa delle soluzioni ( una proprietà che dipende solo dal numero di particelle , molecole, ioni o aggregati supramolecolari presenti in soluzione e non dalla natura delle particelle). Se due soluzioni costituite da uno stesso solvente ma con concentrazioni diverse di soluto sono separate da una membrana che lascia passare solo il solvente e non il soluto(semipermeabile) il solvente si sposta dalla soluzione con minore concentrazione a quella con maggiore concentrazione al fine di eguagliare le concentrazioni.
La pressione necessaria per impedire il passaggio del solvente è la Pressione Osmotica che si calcola da
π Volume =moli x RT
o meglio se in soluzione si formano i particelle
π x Volume = numero i di particelle x moli x RT
è evidente che la risposta errata è D
26. Una soluzione acquosa satura di NaCl, per definizione contiene:
A) la massima quantità di NaCl sciolta nell’acqua alla T in cui si trova e non può sciogliere nessun altro sale
B) la massima quantità di NaCl sciolta nell’acqua alla T in cui si trova e può sciogliere altri sali
C) la massima quantità di NaCl sciolta nell’acqua che si deve trovare in presenza di NaCl come corpo di fondo
D) la massima quantità di NaCl sciolta nell’acqua: uguale a qualsiasi T. Essa può sciogliere un qualsiasi altro sale, non deve contenere per definizione NaCl come corpo di fondo
soluzione
La massima quantità di soluto che può sciogliersi in un dato solvente si chiama solubilità e dipende dalla struttura chimica sia del soluto che del solvente e dalla temperatura. Per una soluzione in cui il soluto che si scioglie è un solido, la solubilità è direttamente proporzionale alla temperatura, cioè più alta è la temperatura più solido si scioglie.Quando nelle soluzione è presente la massima quantità di soluto che il solvente è in grado di sciogliere a quella temperatura, si dice che la soluzione è Satura. Se si aggiunge ulteriore solido, questo non si scioglie più e precipita come corpo di fondo e tra le particelle di solido sul fondo e le particelle di soluto del liquido, si stabilisce un equilibrio dinamico nel senso che tante particelle vengono attratte dalla superficie del solido, tante particelle ripassano in soluzione.Soluzioni che contengono disciolto più soluto di quanto il solvente sia normalmente in grado di sciogliere ad una determinata temperatura si dicono soprassature e sono sistemi instabili che in seguito a perturbazioni meccaniche (agitazione, scuotimento, aggiunta di corpi estranei) liberano l’eccesso di soluto disciolto riformando il corpo di fondo e si trasformano in soluzioni sature.Se ad una soluzione soprassatura si aggiunge un cristallo, attorno a questo si depositano ulteriori cristalli ed il metodo viene usato per la loro preparazione (cristallizzazione).
Una soluzione satura, tuttavia, pur non potendo sciogliere ulteriori quantità di un soluto, può però sciogliere uno o più tipi diversi di sale: infatti, una soluzione satura di KNO3 scioglie anche grandi quantità di NaCl e cosa più notevole è che se si aggiunge ulteriore KNO3 questo si scioglie ancora anche se non in buone quantità.
Da ciò che abbiamo scritto è chiaro che la risposta corretta è B cioè la massima quantità di NaCl sciolta nell’acqua alla T in cui si trova e può sciogliere altri sali
27. Indicare la molalità di una soluzione acquosa di H2SO4 contenente 24,4 g di acido in 198 g di acqua:
A) 3,12 m
B) 2,43 m
C) 1,52 m
D) 1,26 m
soluzione
la molalità è la misura della concentrazione di una soluzione. E’ definita come la quantità di moli in 1 Kg di solvente. Viene preferita alla Molarità ( moli in 1 litro di solvente) perché la massa non cambia al variare della temperatura, cosa che invece non succede col volume di una soluzione che dipende dalla temperatura.
nel caso in esame 24,4g/98 =0,2489 moli di H2SO4 contenute in 198 g di solvente.Pertanto per ottenere il numero di moli in 1 Kg (cioè la molalità) basta fare la proporzione:
se in 198 g vi sono 0,2489 moli in 1000 g ve ne saranno X X= 1,26 molare = 1,26 m
risposta corretta D
28. Indicare la molecola che risulta apolare pur presentando legami polari:
A) HCl
B) H2O2
C) BF3
D) NH3
soluzione
Nel legame covalente tra atomi con elettronegatività diversa, la nuvola elettronica è asimmetrica perché spostata verso l’atomo con elettronegatività maggiore.Una nuvola elettronica di legame è tanto più polarizzata, quanto più grande è la differenza di elettronegatività. Un dipolo è rappresentato da un vettore detto momento di dipolo elettrico ed indicato con μ dove μ=q.d dove q=carica, d=distanza fra i baricentri delle cariche cioè dal baricentro positivo al baricentro negativo μ si misura in Debay. Molecole come HCl, HF sono dipoli elettrici, contraddistinti dal vettore momento di dipolo elettrico μ. con μ diverso da 0 cioè μ≠0. L’ammoniaca NH3 ha una struttura tetraedrica come l’acqua ed ha con μ =1,47 Debay

29. Le moderne marmitte catalitiche delle auto,dette trivalenti, sono progettate, tra l’altro, per:
A) ossidare sia CO che NOx
B) ridurre sia CO che NOx
C) ossidare CO e ridurre NOx
D) ridurre CO2 e NOx
soluzione
nel motore a scoppio avviene la combustione di una miscela di benzina ed aria in modo esplosivo quindi molto rapida per cui gli idrocarburi di cui è composta la benzina non possono bruciare in modo completo per produrre solo CO2 ed H2O. Può accadere inoltre che, alle condizioni di combustione (2400 °C, 10 atm), l’azoto dell’aria che forma la miscela di combustione, produca derivati dell’azoto NOx che sono fortemente inquinanti.La reazione che si verifica è:
HC + O2 + N2→ CO2 + H2O + HCincombusto+ COx + NOx + calore
Quindi nel gas di scarico oltre ad H2O e CO2, ci sono anche i prodotti di una combustione incompleta: monossido di carbonio (CO) ed idrocarburi parzialmente combusti.
La marmitta catalitica è un dispositivo incorporato nel sistema di scarico di un’automobile che riduce la quantità di sostanze inquinanti nei suoi gas di scarico. Essa contiene un elemento in ceramica, con struttura a nido d’ape, rivestito di una pellicola sottile di metalli catalizzatori quali il palladio, il rodio ed il platino (3 o 4 grammi).
Quando i gas di scarico passano attraverso il convertitore catalitico, questi metalli favoriscono le reazioni chimiche che trasformano gli agenti inquinanti, monossido di carbonio ( COx) ossidi di azoto (NOx) e certi idrocarburi (RH ), in composti innocui, come CO2, N2 ed H2O.
Esse son costituite da due parti di cui una contiene il catalizzatore ossidante l’altra il catalizzatore riducente.
Il catalizzatore riducente è a base di rodio Rh e favorisce la decomposizione dell’ossido di azoto che non è una molecola molto stabile per cui a temperature tra i 300 ed i 900 °C si trasforma in N2 e O2 più stabili.
2NO →N2 + O2 (riduzione )
Il catalizzatore ossidante utilizza l’ossigeno ancora presente nei gas di scarico per ossidare completamente sia gli idrocarburi a COx
RH + CO + O2 → CO2 + H2O + calore
Il rapporto di combustione aria/benzina ideale è 14,7/1 che è il rapporto stechiometrico ed è regolato e mantenuto da una sonda detta lambda, che è un sensore di O2, presente nella marmitta catalitica e collegata al sistema di iniezione elettronica della miscela di aria e benzina nel motore..
La risposta esatta pertanto è C
30. Un campione di un idrocarburo di formula empirica C5H4 (7 ,85 g) è sciolto in benzene (301 g). Sapendo che la soluzione ha un punto di congelamento di 1,05 °C sotto quello del benzene puro (Kf = 5,12 °C/m), si può concludere che la formula molecolare del composto è:
A) C10H8
B) C6H12
C) C7H14
D) C15H12
soluzione
sappiamo che ΔT =molalitàx Kf
sostituendo a ΔT il valore 1,05 ed m la molalità (grammi/PM) /Kg solvente si ha
1,05 = (7,85 /PM)x5,12 /0,301 1,05 x 0,301 = 7,85/PM da cui PM = 7,85 x5,12 /1,05 x 0,301 = 128
poiché il composto dovrebbe avere il PM= 128 allora la molecola è C10H8 infatti 10 x 12=120 +8 =128
risposta corretta A
31- Indicare l’affermazione ERRATA:
A) una soluzione è una miscela omogenea
B) nelle soluzioni di elettroliti, l’interazione tra ioni porta alla formazione di coppie ioniche
C) oltre a considerazioni energetiche, l’altra forza trainante che giustifica la dissoluzione del soluto in una soluzione è il disordine derivante dal miscelamento di solvente e soluto
D) una soluzione è una miscela omogenea di due o più elementi di composizione fissa e costante
soluzione
abbiamo già definito una miscela nel quesito n.1 a cui rimandiamo per la spiegazione.
La risposta errata è D perchè pur essendo vero che una soluzione è una miscela omogenea di due o più sostanze, non è altrettanto vero che la soluzione debba avere una composizione fissa e costante.
32. La solubilità di KNO3 è 155 g per 100 g di acqua a 75 °C e 38,0 g a 25 °C. Indicare la massa di KNO3 che andrà sul fondo del recipiente della soluzione se 100 g esatti di una soluzione satura a 75 °C vengono raffreddati a 25 °C:
A) 32,5 g
B) 28,31 g
C) 41,28 g
D) 45,9 g
soluzione
La soluzione contiene 155 g di KNO3 in 100 g di acqua quindi in totale la soluzione pesa 100 + 155 g = 255 g
la soluzione a 25° contiene 100 g + 38 g di KNO3 cioè 138 g
pertanto se nel passare da 75° a 25° da 255 g ne rimangono 138, da 100 g ne rimarranno in soluzione x
X= 138 x 100 /255 = 54,1 g
ovviamente se su 100 g di soluzione rimangono 54,1 g è evidente che 100 – 54,1 saranno precipitati come corpo di fondo.
pertanto la massa di KNO3 che precipita come corpo di fondo è = 100 -54,1 =45,9
33. Indicare il volume di H2O che bisogna aggiungere a 700 mL di una soluzione acquosa di NaOH 1,1 M per ottenere una soluzione 0,35 M. Si ammettano additivi i volumi:
A) 2,0 L
B) 1,5 L
C) 1,0 L
D) 1,2 L
soluzione
possiamo fare il calcolo impostando il sistema a croce
1,1 NaOH 0,35 di NaOH
0,35 NaOH
H2O 0,75 di H2O
da questo si evince che per 0,35 ml di soda 1,1 M si devono usare 0,75 ml di acqua quindi per 700 ml di soda 1,1 se ne dovranno usare X
0,35 : 0,75 = 700 : X X= 1500 ml = 1,5 L
risposta corretta B
34. L’unità di massa atomica u (l’obsoleta u.m.a.) corrisponde per definizione alla massa:
A) esatta di un protone o di un elettrone che sono uguali
B) degli elettroni più esterni di un elemento
C) di un protone, che è il doppio di quella di un neutrone
D) della dodicesima parte della massa del nuclide 12C
soluzione
L’unità di massa atomica unificata (u) detta anche dalton (Da) è l’unità di misura della massa che pur non facendo parte del Sistema S.I. è tuttavia utilizzata internazionalmente in chimica biochimica e biologia. I suoi precedenti simboli amu (dall’inglese atomic mass unit) o uma, l’acronimo in lingua italiana non sono più utilizzati. l’ unità di massa atomica unificata è la dodicesima parte della massa del nuclide 12C
risposta corretta D
35. Una sostanza formata da un solo tipo di atomi è detta:
A) composto
B) ione
C) elemento
D) isotopo
solzione
una sostanza costituita da una sola tipologia di atomi è definita ELEMENTO CHIMICO.
risposta corretta C
36. Tra le molecole di H2O allo stato liquido i legami a idrogeno si formano e si riformano casualmente permettendo alle molecole di formare gruppi in continuo rimodellamento. Nel ghiaccio le molecole sono incastonate ai vertici del reticolo cristallino che ne blocca i movimenti. Pertanto l’angolo di legame di H2O nel ghiaccio vale:
A) 105° come nell’acqua liquida
B) 107° come in NH3, maggiore che in H2O
liquida
C) 109° 28′ come in un perfetto tetraedro
D) 120° come nell’etilene
soluzione


nell’acqua liquida , la cui molecola è tetraedrica, i legami sono flessibili e risentono delle repulsioni tra i doppietti elettronici liberi presenti sull’ossigeno per cui l’angolo di legame HOH tende a contrarsi e formare un angolo di 104°circa. Nel ghiaccio, invece, la struttura è rigida per cui permane la forma tetraedrica originale con un angolo HOH di 109°,28′
risposta corretta C
37. Completare in modo corretto. L’argon, che appartiene al gruppo 18 della tavola periodica, ha molecola:
A) monoatomica e non ha il guscio elettronico esterno completo
B) diatomica ed è poco reattivo in assenza di fiamme o filamenti incandescenti
C) octa-atomica come lo zolfo
D) monoatomica e lo strato esterno completo di tutti gli elettroni possibili
soluzione
L’Argon (dal greco argon che significa pigro) ha come simbolo Ar e possiede 18 elettroni con la seguente struttura atomica
| [Ne] 3s2 3p6 |
questo significa che possiede tutti gli elettroni accoppiati e non può avere una molecola diversa da quella monoatomica.
risposta corretta D
38. Indicare l’affermazione ERRATA.
La forza di attrazione tra l’estremità negativa di una molecola dipolare e quella positiva di un’altra molecola dipolare ha un effetto importante nel determinare alcune proprietà dell’acqua e di altre sostanze. Ad esempio:
A) sul punto di ebollizione
B) sul punto di congelamento
C) sulla loro capacità di aderire ai vetri
D) sulla loro caratteristica grande capacità di sciogliere le sostanze organiche apolari e
inorganiche polari
soluzione
si tratta di una forza dipolo-dipolo che in particolare nell’acqua, si manifesta sotto forma di legame idrogeno. Ne consegue che è necessario utilizzare dell’energia per spezzare quel legame e ciò si evidenzia nell’aumento del punto di ebollizione e diminuzione del punto di congelamento oltre che sulla capacità dell’acqua di aderire a superfici vetrose.
Ne deriva che la risposta errata è D
39. Un quesito chiede quanti atomi sono presenti in una mole di zolfo e riporta le seguenti risposte. Indicare quella corretta
A) 6,023 ·1023 molecole
B) 4,984 ·1024 atomi
C) 1,205 ·1024 atomi
D) Non posso rispondere, l’autore cerchi di rispettare le indicazioni della IUPAC per non creare ambiguità!
soluzione
in una mole di zolfo vi sono 6,02x 1023 atomi e non molecole ! Le risposte A,B,C, sono errate mentre è corretta la risposta D
40. Indicare la quantità chimica di HNO3 che resta a fine reazione e la quantità chimica di Cu(NO3)2 che si ottiene se 4 mol di atomi di Cu vengono poste a reagire con 16 mol di HNO3, nella seguente reazione da bilanciare:
Cu + NO3– + H+ →Cu2+ +NO + H2O
o Cu + HNO3 → Cu(NO3)2 + NO + H2O
A) 5,33 mol di HNO3 e 4 mol di Cu(NO3)2
B) 2,37 mol di HNO3 e 3 mol di Cu(NO3)2
C) 1,13 mol di HNO3 e 4 mol di Cu(NO3)2
D) 4,23 mol di HNO3 e 4 mol di Cu(NO3)2
soluzione
la reazione è:
3[Cu → Cu+2 +2e
2[NO3- + 4H+ +3e → NO +2H2O
___________________________
3Cu + 2 NO3- + 8 H+ → 3Cu+2 + 2 NO + 4H2O
cioè 3Cu+ 8HNO3 → 3 Cu(NO3)2 + 2NO + 4 H2O
da cui si evince che se per 3 moli di Cu si consumano 8 HNO3, per 4 moli se ne consumeranno X
X= 4 x 8 / 3 =10,67 moli pertanto delle 16 moli di HNO3 messe a reagire ne rimangono 16-10,67 =5,33 moli
Poichè inoltre da 3 moli di Cu si ottengono 3 moli di Cu(NO3)2 da 4 moli se ne ottengono 4.
la risposta corretta è A
Qui sotto continuano i test della classe A.
Quelli della classe B riprendono dopo l’ultimo della A.
41. Indicare il pH di una soluzione acquosa di HCl 1 ·10–3 M a 25 °C:
A) 2,0
B) 3,0
C) 1,3
D) 4,0
soluzione
ricordiamo che PH = -log [H+] pertanto PH= -log 10-3 = -(-3) log10 ma log 10 in base 10 =1 perciò
PH = 3
42. Si dà il nome di idracido o non-ossoacido (non-oxoacìdo) a un acido:
A) poliprotico
B) formato da un atomo di idrogeno e uno di alogeno
C) di Bronsted-Lowry
D) che non contiene ossigeno
soluzione
un idracido è una molecola che contiene idrogeno e non contiene ossigeno.
Infatti HCl è un idracido che contiene un alogeno ed ovviamente l’idrogeno, ma anche H2S è un idracido e non contiene alogeno. Quindi, in generale, pur essendo vero che una molecola contenente idrogeno ed alogeno è un idracido è più generalmente vero che un idracido contiene idrogeno e non contiene ossigeno.
la risposta corretta è D
43. La reazione di un ossido di un non-metallo con acqua forma:
A) un oxoacido
B) un idracido
C) un idrossido
D) un sale acido
soluzione
un ossido di un non metallo ( detto anche anidride) nell’acqua forma sempre un acido contenente ossigeno cioè un oxoacido .Per esempio SO3 triossido di zolfo o anidride solforica con H2O forma H2SO4 (acido solforico), il biossido di Carbonio CO2 comunemente noto come anidride carbonica, con H2O forma H2CO3 (acido carbonico).
Risposta corretta A
44. Indicare lo stato di aggregazione del bromo a temperatura e pressione ambiente:
A) solido
B) liquido
C) gassoso
D) vetroso
soluzione
il bromo, un alogeno, deve il suo nome al caratteristico odore, infatti bromos in greco significa puzza.A temperatura ambiente è un liquido di colore rosso bruno,e la sua molecola è biatomica Br2 ed evapora facilmente ed ha un odore molto sgradevole.
è un ossidante e se messo in acqua forma sia BrO- (ipobromito) sia Br- (Bromuro) cioè Br2 (numero di ossidazione zero) si disproporziona cioè forma un elemento con numero di ossidazione inferiore Br- (-1) ed uno con numero di ossidazione più alto (Br+1 nell’ipobromito)
45. Completare in modo corretto. Un qualsiasi elemento del VII gruppo della tavola periodica:
A) ha un’energia di ionizzazione (Ei) relativamente più bassa degli elementi del I gruppo
B) ha un’elettronegatività relativamente più bassa degli elementi del I gruppo
C) ha un’energia di affinità elettronica (Eae) relativamente più bassa, in valore assoluto, rispetto agli elementi del I gruppo
D) ha un’energia di affinità elettronica (Eae) relativamente più alta, in valore assoluto, rispetto
agli elementi del I gruppo
soluzione
L’ENERGIA DI IONIZZAZIONE è la quantità di energia necessaria a staccare un elettrone di un atomo gassoso nel suo stato fondamentale per formare uno ione positivo (Catione). L’energia è espressa in KJ/mole
se consideriamo un atomo neutro, l’espulsione di un elettrone crea uno ione positivo che attrae con maggior forza gli elettroni rimasti, per cui per staccare un secondo elettrone è necessaria una maggior quantità di energia e così via per allontanare un terzo elettrone. Più grande è la carica positiva che si determina su un atomo dopo l’espulsione di elettroni, maggiore sarà l’energia necessaria a staccare un successivo elettrone. L’energia necessaria per staccare il primo elettrone viene detta energia di prima ionizzazione e quindi per il secondo elettrone si ha l’energia di seconda ionizzazione e così via. L’energia di ionizzazione dipende dal raggio atomico infatti se guardiamo la tavola periodica notiamo che andando da sinistra a destra, quindi lungo un periodo, il raggio atomico aumenta e naturalmente aumenta anche l’energia di ionizzazione
| Li 520 | Be 899 | B 800 | C 1086 | N 1402 | O 1314 | F 1680 |
lungo un gruppo, tuttavia, l’Ei diminuisce poiché anche se il raggio atomico aumenta, aumenta anche il numero di elettroni più interni che esercitano sulla carica positiva del nucleo un effetto schermante quindi l’energia richiesta per estrarre l’elettrone è più bassa. Maggiore è la forza schermante minore sarà l’Ei.
LI 520 Kj/mol
Na 496 ” “
K 419 ” “
Rb 408 ” “
i metalli alcalini gruppo IA hanno pertanto Ei più bassa degli elementi del VIIA
l’ affinità elettronica, quindi, ha un valore negativo, ma se ad uno ione negativo si aggiunge un’altra carica elettronica allora occorre un’energia maggiore a causa della resistenza che lo ione negativo oppone all’ingresso della seconda carica ed il valore diviene positivo.
L‘affinità elettronica, in valore assoluto e con rare eccezioni, aumenta lungo un periodo (poiché diminuisce lievemente il raggio atomico per via della forza attrattiva esercitata dal nucleo e per l’ aumento del numero di elettroni nel livello più esterno. L’A.E. diminuisce scendendo lungo un gruppo a causa della distanza dal nucleo e per l’aumento del numero atomico.
L’elettronegatività è la tendenza che ha un atomo di attrarre verso di sè gli elettroni di un legame e la differenza di elettronegatività produce una polarità nella molecola.
46. Indicare il nome del composto rappresentato dalla formula Ca(H2PO4)2 secondo la nomenclatura internazionale:
A) diidrogenofosfato di calcio
B) diidrogenofosfato di monocalcio
C) metafosfato di calcio
D) pirofosfato di calcio
soluzione
Diidrogenofosfato di calcio.
47. Indicare l’elemento che ha la molecola monoatomica:
A) H
B) Rn
C) Cl
D) O
soluzione
sia H che Cl e l’ossigeno hanno molecola biatomica quindi il Rado possiede una molecola monoatomica.
48. Indicare l’affermazione corretta.
A) i massimi assoluti dell’energia di prima ionizzazione corrispondono agli elementi del II
gruppo della tavola periodica
B) i minimi assoluti dell’energia di prima ionizzazione corrispondono ai gas nobili
C) la carica nucleare efficace per i metalli alcalini ha il valore più alto
D) i minimi assoluti dell’ energia di prima ionizzazione corrispondono ai metalli alcalini
soluzione
nell’esempio 46 abbiamo visto l’andamento dell’energia di ionizzazione nei periodi e nei gruppi pertanto la risposta corretta è D
49. È noto che gli elementi chimici possono essere classificati nei due grandi gruppi dei metalli e dei non metalli, un tempo anche detti, con un brutto termine, metalloidi. Indicare l’affermazione ERRATA a proposito di tale classificazione:
A) gli atomi dei non metalli sono caratterizzati da forze attrattive di notevole entità che legano gli elettroni più esterni al nucleo favorendo anche l’addizione di altri elettroni
B) il carattere metallico di una specie chimica è tanto più accentuato quanto più bassa è l’energia di ionizzazione dell’ elemento considerato
C) il carattere metallico di una specie chimica semplice si manifesta anche con il carattere acido del suo ossido
D) gli atomi dei metalli sono caratterizzati da forze attrattive relativamente deboli che legano glielettroni più esterni al nucleo
soluzione
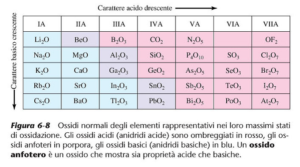
il carattere acido degli ossidi degli elementi aumenta lungo il periodo nella tavola periodica mentre il carattere basico aumenta lungo il gruppo.Il carattere metallico diminuisce lungo i periodi per cui si può individuare il carattere metallico di un elemento conoscendo il carattere acido o basico del suo ossido.
La risposta corretta è C
50. Indicare l’affermazione ERRATA.
Percorrendo la tavola periodica degli elementi da sinistra a destra si osserva che:
A) l’elettronegatività aumenta
B) l’energia di prima ionizzazione aumenta
C) l’affinità elettronica aumenta
D) il raggio atomico aumenta
soluzione
tra le proprietà indicate si osserva che solo il raggio atomico aumenta in modo costante mentre le altre proprietà dipendono dalla posizione dell’elemento nel periodo e nel gruppo.
risposta corretta D
51. Indicare l’atomo tra i seguenti, Na, K, Mg e Ca, che ha l’energia di prima ionizzazione minore:
A) Na
B) Mg
C) K
D) Ca
soluzione
L’energia necessaria per staccare il primo elettrone del livello più esterno di un atomo viene detta energia di prima ionizzazione e quindi per staccare il secondo elettrone viene detta energia di seconda ionizzazione e così via. L’energia di ionizzazione dipende dal raggio atomico, infatti, se guardiamo la tavola periodica notiamo che andando da sinistra a destra, quindi lungo un periodo, il raggio atomico aumenta e naturalmente aumenta anche l’energia di ionizzazione. Lungo un gruppo, tuttavia, l’Ei diminuisce poichè anche se il raggio atomico aumenta, aumenta anche il numero di elettroni più interni che esercitano sulla carica positiva del nucleo un effetto schermante quindi l’ energia richiesta per estrarre l’elettrone è più bassa. Maggiore è la forza schermante minore sarà l’Ei. Si deduce che il potassio ha l’Ei minore.
52. Indicare l’affermazione ERRATA a proposito dei legami chimici.
A) ogni legame tra due atomi diversi A e B può essere considerato come un legame covalente con una maggiore o minore percentuale di carattere ionico
B) se l’ammontare del carattere ionico tra due atomi diversi A e B supera il 50%, il legame viene
considerato essenzialmente ionico
C) le caratteristiche di un legame tra due atomi A e B sono determinate solo dalla differenza di
elettronegatività tra di essi ma non dalle dimensioni atomiche e dal loro stato di valenza
D) tra due elementi diversi A e B si possono avere più composti caratterizzati da legami di diverso carattere che non può essere suggerito dai soli valori di elettronegatività
soluzione
le caratteristiche di un legame non dipendono esclusivamente dall’elettronegatività degli atomi che si legano ma anche dalle caratteristiche atomiche e quindi dal loro numero di elettroni disponibili per il legame.
risposta errata C
53. Completare in modo corretto la seguente affermazione. Il legame a idrogeno è un legame che si forma tra un atomo di idrogeno legato ad un atomo molto elettronegativo (F, O, N, … ) e l’atomo elettronegativo X:
A) di un’altra molecola o della stessa molecola formando un legame intra- o inter-molecolare
B) di un’altra molecola formando un legame intermolecolare
C) della stessa molecola formando un legame intramolecolare
D) della stessa molecola o di un’altra molecola di un acido protico non contenente ossigeno
soluzione

la figura mostra il legame idrogeno tra molecole di acqua che si instaura a causa del dipolo che vi è nella molecola (δ+ sull’idrogeno e δ- sull’ossigeno) . Questo tipo di legame può esistere anche tra molecole diverse o all’interno della stessa molecola. Un esempio il legame idrogeno tra gli amminocidi di una proteina che ne determina la struttura terziaria cioè la disposizione nello spazio
la risposta corretta è A
.
54. Nello ione H2AsO3 – il numero di ossidazione dell’arsenico è:
A) +l
B) +2
C) +3
D) +5
soluzione
il numero di ossidazione n.o. è un numero che viene attribuito ad un atomo in funzione del numero di legami che lo legano ad un altro atomo con elettronegatività minore o maggiore di quella che esso stesso possiede.Si attribuisce +1 per ogni legame che lo unisce ad un atomo più elettronegativo e – 1 per ogni legame che lo unisce ad un atomo meno elettronegativo mentre si attribuisce 0 per ogni legame che lo unisce ad un atomo dello stesso tipo.Per esempio
nel caso dello ione in esame As è legato a 3 atomi di ossigeno che è più elettronegativo ognuno con 2 legami quindi si attribuisce 3x 2 =+6 ; è legato anche a 2 atomi di idrogeno, che è meno elettronegativo (-2) e poiché nello ione vi è una carica negativa si ha ancora -1.
In definitiva il n.o. dell’arsenico nella molecola H2AsO3- è + 6 -2 -1 = +3
la risposta corretta è C
55. Indicare le formule corrette dei composti ionici che si formano quando il catione alluminio si lega agli anioni fluoruro, solfuro e nitrato:
A) AlF3, AlS3, Al2(NO3)3
B) AlF, Al2S, AlNO3
C) AlF3, Al2S3, Al(NO3)3
D) AlF, AlS, Al(NO3)2
soluzione
Al+3 ed F-1 quindi il composto è AlF3
Al+3 S-2 quindi il composto è Al2S3
Al+3 ed NO3– pertanto il composto è Al(NO3)3
la risposta corretta è C
56. Indicare l’affermazione ERRATA a proposito di un catalizzatore:
A) a reazione avvenuta deve essere chimicamente inalterato (può essere invece fisicamente modificato)
B) aumenta, o diminuisce se inibitore, la velocità di una reazione chimica
C) è utilizzato in quantità inferiori alle stechiometriche rispetto ai reagenti
D) deve essere presente nella stessa fase di reagenti e prodotti
soluzione
il catalizzatore è inalterato dopo la reazione anche se talvolta può essere fisicamente modificato, esso serve per abbassare l’energia di attivazione di una reazione e quindi accelera (o inibisce) una reazione chimica. Le quantità utilizzate sono certamente inferiori a quelle dei reagenti di cui deve catalizzare la reazione.La fase del catalizzatore solitamente non è la stessa dei reagenti per cui la risposta corretta è D
57. Porre le sostanze, BaCl2, H2, CO, HF, Ne, in ordine crescente di punto di ebollizione:
A) BaCl2, H2, CO, HF, Ne
B) H2, BaCl2, CO, Ne, HF
C) H2, Ne, CO, HF, BaCl2
D) BaCl2, H2, HF, CO, Ne
soluzione
la temperatura alla quale la tensione di vapore di un liquido eguaglia la pressione esterna viene chiamata Temperatura di ebollizione o Punto di ebollizione. Il calore che viene ceduto al liquido perché questo inizi a bollire, deve inizialmente spezzare le forze di attrazione che esistono tra le molecole. Si deduce che, se tra le molecole esistono forze quali legami idrogeno o più in generale le forze di Van der Waals, è necessaria una maggior quantità di calore perché il liquido vada in ebollizione. Ciò significa che se in una molecola si forma un dipolo elettrico ed a seconda della forza di interazione dipolo-dipolo tra molecole, occorre maggior calore per raggiungere la temperatura di ebollizione. Tra le molecole indicate nel quesito l’H2 non forma alcun dipolo così come il Neon mentre l’ossido di carbonio forma un dipolo poiché l’ossigeno ha un’elettronegatività 3,44 secondo Pauling. Il fluoro ha elettronegatività pari a 3,98 ed cloro 3.16 ma la molecola di BaCl2 è costituita da 3 atomi ed il Bario forma 2 legami col cloro.
Si deduce che la temperatura di ebollizione aumenta da H2,Ne,CO,HF,BaCl2
risposta corretta C
58. Se si mescolano volumi uguali di due soluzioni acquose aventi la stessa concentrazione
molare, una di un acido debole monoprotico e una di una base forte monoprotica, il pH risultante:
A) è maggiore di 7
B) è 7
C) può essere maggiore o minore di 7 in funzione
della specifica natura chimica dell’acido e della base
D) è minore di 7
essendo l’acido un acido debole, solo una parte dell’H+ che contiene si dissocia e naturalmente la sua concentrazione sarà inferiore a quella della concentrazione analitica Ca. Infatti [H+] = √ Ka x Ca mentre la concentrazione di OH- proveniente dalla base sarà uguale alla concentrazione analitica Cb. Pertanto se Ca=Cb è evidente che l’OH- della base neutralizzerà tutto l’H+ in soluzione e rimarrà una quantità di OH- in eccesso e naturalmente il PH sarà maggiore di 7.
risposta corretta A
59. Indicare il commento ERRATO a proposito della tavola periodica:
A) i metalli alcalini sono leggeri, relativamente meno densi e con punto di fusione relativamente più basso degli altri metalli
B) i metalli alcalini hanno energia di ionizzazione relativamente più bassa degli altri metalli
C) i metalli alcalino-terrosi sono più reattivi degli alcalini nei confronti dei non metalli
D) l’idrogeno è un elemento particolare capace di formare composti covalenti con i non metalli e ionici con i metalli
soluzione
L’andamento periodico del punto di fusione è legato al fatto che più forte è la forza di legame che agisce tra le molecole di una sostanza più questo è alto. Esso aumenta nel periodo ad es Li<Be<B<C mentre diminuisce nel gruppo ad es Li>Na>K .il punto A è quindi vero .
L’energia di ionizzazione varia a seconda della distanza crescente del guscio elettronico più esterno dal nucleo e il crescente effetto di schermo esercitato dai gusci elettronici interni sulla carica nucleare. L’energia di ionizzazione è minima negli elementi del primo gruppo (metalli alcalini) e massima nei gas nobili . Anche l’affinità elettronica, che è definita come l’energia liberata da un atomo quando acquista un elettrone, mostra un andamento periodico. Questa segue lo stesso andamento dell’ energia di ionizzazione, cioè diminuisce lungo il gruppo e aumenta lungo il periodo da sinistra verso destra . La risposta B è corretta
La risposta D è altrettanto corretta in quanto l’H può formare con i non metalli legami (es CH4) covalenti e ionici con i metalli .
Ne consegue che la risposta errata è la C
60. Completare in modo corretto. I tre isotopi più abbondanti dell’ossigeno naturale sono 16O, 17O ed 18O:
A) il primo è stabile e gli altri due sono radioattivi
B) i primi due sono stabili e il terzo è radioattivo
C) essi sono tutti stabili
D) di essi è radioattivo l’isotopo con numero di massa dispari
soluzione
nessuno degli isotopi dell’ossigeno è radioattivo ed i tre isotopi si riscontrano facilmente in natura e sono stabili.
risposta corretta C
Qui sotto riprendono i quesiti della classe B.
41. La semi-reazione che avviene in una batteria è:
PbO2 + 4 H+ + SO4–2 + 2 e– → PbSO4 + 2 H2O
Pertanto, durante il funzionamento, all’elettrolita succede che:
A) aumentano densità e pH
B) aumenta la densità e diminuisce il pH
C) diminuiscono densità e pH
D) diminuisce la densità e aumenta il pH
soluzione
Al catodo avviene la semi-reazione di riduzione:
- PbO2 + 4H+ + 2e− → Pb2+ + 2H2O
All’anodo avviene l’ ossidazione:
- Pb → Pb2+ + 2e−
La presenza dello ione SO42− fa precipitare lo ione Pb2+. Inizialmente la densità viene determinata dall’H2SO4 che però diminuisce man mano che la batteria si usa nel tempo e quindi la densità diminuisce. Nel contempo viene consumato H+ e quindi il PH aumenta col tempo.
La risposta corretta è D
42. Indicare l’energia termica sviluppata nella combustione completa di 1,00 kg di saccarosio
(C12H22O11), sapendo che per la reazione:
C12H22O11 (s) + 12 O2 (g) → 12 CO2 (g) + 11 H2O (l) ΔH = -5,65 ·103 kJ /mol
A) -11,4 ·104 kJ
B) +1,65 ·104 kJ
C) -1,65 ·104 kJ
D) +11,4 ·104 kJ
soluzione
1 mole di glucosio pesa 342 g quindi se per una mole cioè per 342 g di glucosio si sviluppano 5,65 x 103 kJ per 1000 g se ne svilupperanno X X = 5,65 x 103 x 103 / 342
X = 5,65x 106 / 342 = 0,0165 x 106 = 1,65 x 104 kJ
risposta corretta B
43. Sapendo che l’energia di legame di H2 vale -436 kJ mol–1, indicare il valore che si ritiene più vicino a quello delle energie di legame di H2+ ed He2+
A) -650 kJ mol–1
B) -110 kJ mol–1
C) -872 kJ mol–1
D) -220 kJ mol–1
soluzione
l’energia del legame H-H deriva dall’unione di 2 atomi di H con 1 elettrone
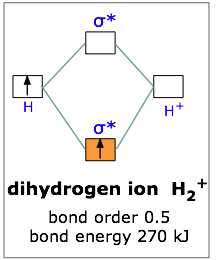
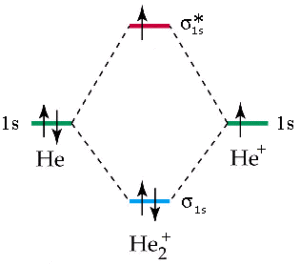
la molecola H2+ ha una lunghezza di legame di 1,06 A° e quella di He2+ 1,08A°
l’energia di legame di H2 è -436 KJ/mole H2+ è -253 KJ/mole mentre per He2+ e -270 KJ/mole. Ciò è deducibile ricordando che nella molecola di H2+ vi è un solo elettrone di legame e quindi l’energia di legame di H2+ dovrebbe essere la metà dell’energia di legame di H2. Per quanto riguarda la molecola di He2+ vi sono 2 elettroni di legame ma anche 1 elettrone di antilegame per cui l’energia del legame di He2+ dovrebbe essere simile a quella di H2+.
Il risultato corretto è quindi D
44. Indicare i valori più vicini alla solubilità di Ag2CrO4 a 25 °C in acqua e in soluzione acquosa di K2CrO4 5,00 ·10–3 M:
A) 2,1 ·10–5 mol L–1 e 2,2 ·10–4 mol L–1
B) 1,0 ·10–4 mol L–1 e 1,5 ·10–2 mol L–1
C) 1,8 ·10–4 mol L–1 e 3,1 ·10–3 mol L–1
D) 1,3 ·10–4 mol L–1 e 2,1 ·10–5 mol L–1
soluzione
dalle tabelle si osserva che il KPS Ag2CrO4 = 9 x 10-12
la solubilità è quindi Kps= (2S)2x S da cui 4S² x S = 4S³ =Kps perciò S³ = Kps/4 S³ = 9 x 10-12 /4
S = 1,3 x 10-4 mol/l
Se però Ag2CrO4 viene posto in una soluzione di K2CrO4 0,003 M la dissociazione di Ag2CrO4 in 2Ag+ + CrO4-2 viene inibita ed ovviamente la solubilità diminuisce per effetto dello ione a comune.
Kps =[Ag+]² x [CrO4-2] da cui Kps= X² ( X+ 0,005) X³ +0,005 X² – Kps =0
da cui X = 2,1 x 10-5 mol/l
la risposta corretta è
45 curve con l’andamento mostrato in figura spesso si riferiscono a reazioni nelle quali è presente un catalizzatore.
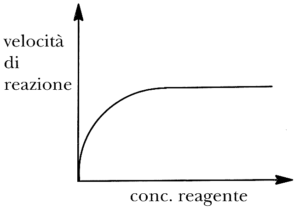
La parte piatta della curva è meglio attribuita al fatto
che:
A) non si forma più prodotto
B) la reazione ha raggiunto l’equilibrio
C) tutti i siti catalitici sono occupati
D) tutti i reagenti sono stati consumati
soluzione
Questa curva rappresenta un modello cinetico in cui, quando la concentrazione di substrato disponibile per la reazione col catalizzatore (spesso un enzima) la cui concentrazione si suppone costante, aumenta anche di poco, la velocità di reazione aumenta esponenzialmente, fino ad un massimo ( Vmax ) .
La velocità, da questo punto in poi rimane costante perché tutti siti del catalizzatore sono occupati dal substrato e l’aggiunta di altro substrato non modifica la velocità della reazione per mancanza di siti disponibili cui legarsi.
Risposta corretta C
46. Avvalendosi anche delle tabelle del fascicolo, indicare, tra i seguenti, i composti solubili e quelli insolubili in acqua:
a) ZnCO3
b) (NH4)2S
c) FeS
d) BaSO4
A) b (solubile); a, c, d (insolubili)
B) c, d (solubili); a, b (insolubili)
C) c (solubile); a, b, d (insolubili)
D) a, b (solubili); c, d (insolubili)
soluzione
per rispondere a questa domanda basta osservare i valori del Kps di ogni composto da cui si evince che
ZnCO3 Kps= 6 x 10-11 poco solubile; (NH4)2SO4 solubilità =750 g/l molto solubile ; FeS Kps = 3,7 x 10-19 poco solubile BaSO4 Kps= 1 x 10-10 poco solubile
risposta esatta A
47. L’acido acetico CH3COOH è solubile in acqua in tutti i rapporti. Esso è anche solubile in benzene e in tetracloruro di carbonio. Questo perché:
A) acqua, benzene e tetracloruro sono solventi polari e il simile scioglie il simile
B) forma legami a ponte di idrogeno con il benzene e gli atomi di cloro del tetracloruro
C) nei solventi riportati si ionizza rendendo il solvente polare per polarità indotta
D) l’acido, polare in acqua, in benzene e in tetracloruro di carbonio forma dimeri con molecole legate con due legami a ponte di idrogeno che lo rendono meno polare
soluzione
Solventi e soluti sono generalmente classificati come polari e non polari . La maggiore o minore polarità di un solvente è dovuta al valore della costante dielettrica o del momento dipolare. I solventi polari hanno valori elevati della costante dielettrica e del momento di dipolo, mentre i solventi apolari hanno bassi valori. Solventi polari sciolgono meglio composti polari e solventi non polari sciolgono meglio composti non polari. “similia similibus solvuntur cioè il simile scioglie il simile”. L’acqua è un solvente polare, per cui scioglie meglio le sostanze polari, mentre benzene e tetracloruro di carbonio sono solventi apolari e sciolgono le sostanze apolari. Nei solventi apolari, tuttavia, una sostanza polare come l’acido acetico non si dissocia facilmente, in quanto non c’è più l’azione solvatante dell’acqua che è polare e stacca in parte l’idrogeno sotto forma di H+, per cui l’idrogeno del gruppo COOH non si stacca facilmente anzi viene impegnato in un legame elettrostatico con l’ossigeno del carbonile CO di una molecola vicina. Ne consegue che nei solventi polari l’acido acetico forma un dimero ( un gruppo formato da due molecole) che non permette la formazione di H+ come avviene nei solventi polari. Ciò comporta che diminuendo la ionizzazione dell’acido, contemporaneamente aumenta la sua apolarità per cui si scioglie anche nei solventi apolari quali benzene e tetracloruro di carbonio.
Risposta corretta D
48. Indicare, sulla base della teoria VSEPR, (Valence Shell Electron Pair Repulsion), in quale specie gli atomi giacciono nello stesso piano:
1. 1. CH3+ ; 2. CH3–
A) solo in 1
B) solo in 2
C) sia in 1 che in 2
D) né in 1 né in2
soluzione
la teoria VESPR si basa sul fatto che i doppietti elettronici in una molecola tendono a disporsi il più lontano possibile fra loro e se vi sono coppie di elettroni non impegnate in legami esse si respingono e questa interazione influisce sulla disposizione degli altri elettroni della molecola. Le coppie elettroniche tendono ad occupare la posizione più adatta per minimizzare la repulsione, massimizzando quindi lo spazio interposto tra gli elettroni. Nel caso in esame in CH3- la molecola presenta un doppietto elettronico libero e tre legami CH e secondo la VESPR la struttura deve essere una piramide triangolare (E rappresenta i 2 elettroni)
invece in CH3+ la molecola non presenta doppietti elettronici liberi per cui la struttura è planare
(secondo la teoria degli elettroni di valenza il Carbonio in CH3- ha struttura tetraedrica perché ibrido SP3 con angoli di 109° e nella molecola CH3+ è planare perché il Carbonio è ibrido SP2 con angoli di 120°).
la risposta corretta è A
49. La seguente reazione è endotermica: N2O4 (g) ⇄ 2 NO2 (g)
Indicare quali cambiamenti potrebbero spostare l’equilibrio verso destra:
A) addizione di un catalizzatore
B) abbassamento della temperatura
C) aumento del volume del reattore
D) addizione di un gas inerte per aumentare la P
soluzione
Una reazione endotermica è una reazione in cui si ha un aumento di entalpia del sistema e dunque un trasferimento di calore dall’ambiente al sistema stesso e, per convenzione, alla variazione di entalpia ΔH si attribuisce un valore positivo.
il ΔH di una reazione è dato dalla differenza ∑H prodotti – ∑H reagenti
cioè ΔH = ∑H prodotti – ∑H reagenti
Nella reazione N2O4 (g) ⇄ 2 NO2 (g) ΔH = 58.0 kJ
se si aumenta la temperatura l’equilibrio tende a spostarsi nel senso in cui avviene l’assorbimento di calore ovvero, in questo caso, verso destra essendo la reazione endotermica, pertanto se si diminuisce la temperatura la reazione favorita è la reazione verso sinistra.
L’aggiunta di un catalizzatore comporta un abbassamento dell’ energia di attivazione e si osserva una variazione della velocità della reazione ma la presenza del catalizzatore, non modifica la direzione verso cui tende una reazione (diretta→ inversa o viceversa).Con l’aggiunta di un catalizzatore l’ equilibrio si raggiunge in un tempo minore ma le concentrazioni del reagente e del prodotto rimangono invariate, pertanto il catalizzatore non ha alcun effetto sula direzione dell’equilibrio.
L’aggiunta di un gas inerte, ad esempio N2, che non partecipa alla reazione provoca l’aumento della pressione totale del sistema. Poichè la costante di equilibrio Kp dipende dalle pressioni parziali
Pparz = faz.molare per Ptot
se si modifica Ptot che compare in ogni termine dell’ epressione analitica dell’ equilibrio, il valore di Kp non cambia quindi si deduce che l’aggiunta di un gas inerte non sposta l’equilibrio nè a destra nè a sinistra.
50. Un campione (107 g) di una miscela di solfito e solfato di calcio (contenente il 69,4% in massa di CaSO3) viene trattato con HCl aq in eccesso. In tali condizioni, avviene la reazione da bilanciare:
CaSO3 + HCl → CaCl2 + H2O + SO2
Indicare la massa di SO2 prodotta se reagisce solo il CaSO3:
A) 64,5
B) 57,1
C) 89,2
D) 39,6
soluzione
la reazione bilanciata è CaSO3 +2 HCl → CaCl2 + H2O + SO2
Occorre calcolare per prima la quantità di CaSO3 presente nella miscela considerato che SO3 proviene solo da quel composto. Pertanto, sappiamo che solo il 69,4% è rappresentato da CaSO3 quindi
se in 100 vi è il 69,4 di CaSO3 in 107 ve ne sarà X X= quantità di CaSO3 = 107 x 69,4/100 = 74,25 g
se da CaSO3 si ottiene SO2 da 74,25 se ne otterranno X
120,14 : 64,06 = 74,25 : X X= 39,6 g
risposta corretta D
51. Un minerale di ferro è formato da Fe2O3 impuro. Se nella produzione di Fe metallico puro,
ottenuto per trattamento a caldo dell’ossido con carbone, da 812 kg di minerale si ottengono 486 kg di Fe puro, con resa quantitativa, si può concludere che il minerale contiene una percentuale in massa di Fe2O3 pari a:
A) 8,56%
B) 85,6%
C) 43,0%
D) 56,0%
soluzione
per calcolare la % di Fe2O3 dobbiamo calcolare quanto Fe2O3 è presente in 812 kg di minerale – Per questo occorre così ragionare:
se da Fe2O3 si ottengono 2 di Fe da X se ne ottengono 486 quantità di Fe2O3 presente nel minerale che produce 486 kg di Fe.
esprimendo tutto i Kg 0,1597 : 0,1117 = X : 486 X= 694,8 kg di Fe2O3 contenuti in 812 kg d minerale
La % di Fe2O3 è quindi 812: 694,8 =100 :X X=85.56 %
52. Indicare, tra le seguenti reazioni, quella che produce la maggiore quantità di O2 (g) a partire da una stessa massa di reagente:
A) 2NH4NO3 →2N2 + 4H2O + O2
B) 2N2O →2N2 + O2
C) 2Ag2O → 4Ag + O2
D) 2Pb(NO3)2 →2PbO +4 NO2 + O2
soluzione
2 NH4NO3 : 32 = 100 😡 2x 80 :32=100:x X=20
2N2O:32 =100:X 44 2x 44:32 = 100:X X=36,36
2Ag2O:32 =100 :X 231,7 2x 231:32 = 100 :X X= 6,92
2Pb(NO3)2 : 32 = 100 :X 2x 331,2 :32 = 100 :X X=0,207
risposta corretta B
53. Una soluzione di HNO3 al 27,0% in massa ha una densità di 1,16 g mL–1. Pertanto, le sue molarità e molalità (M e m) sono nell’ordine più vicine a:
A) 4,97 ; 5,87
B) 1,56 ; 5,20
C) 2,34 ; 4,31
D) 3,20 ; 2,72
soluzione
essendo la densità pari a 1,116 g/ml 1 litro conterrà 1160 g di HNO3 ed essendo questo al 27% la quantità in grammi è 1160 x 0,27 =313,2 g cioè 313,2 /63 = 4,97 Moli cioè la molarità è 4,97 M
essendo la molalità la quantità di moli in 1000 g di soluzione e poiché 1000 ml pesano 1160 g allora occorre fare la proporzione
se in 1000 vi sono 4,97 g in 1160 ve ne saranno x da cui X= 4,97 x 1160 /1000 = 5,8
risposta corretta A
54. Indicare la specie avente geometria molecolare piramidale a base quadrata:
A) XeF4
B) SF6
C) XeO4
D) BrF5
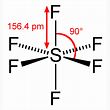
soluzione
secondo la teoria VESPR lo XeF4 possiede una struttura planare quadrata in quanto lo Xenon ha due coppie di elettroni non condivise poste sopra e sotto il piano. La molecola di esafluoruro di zolfo SF6 ha struttura ottaedrica mentre Xe O4 ha struttura tetraedrica . La molecola piramidale a base quadrata è BrF5 in cui il bromo ha numero di coordinazione 5 e possiede un doppietto elettronico libero.
risposta corretta D
55. Una soluzione di quattro gas ha la seguente composizione in volume: SO2 40,00%, N2 20,00%, O2 30,00%, H2O 10,00%. Calcolare la composizione percentuale in massa:
A) SO2 = 13,10%; N2 = 60,15%; O2 = 22,53%; H2O = 4,22%
B) SO2 = 60,10%; N2 = 10,15%; O2 = 25,53%; H2O = 4,22%
C) SO2 = 60,10%; N2 = 13,15%; O2 = 22,53%; H2O = 4,22%
D) SO2 = 60,10%; N2 = 13,15%; O2 =12,53%; H2O = 14,22%
soluzione
la quantità in grammi di ogni gas è calcolata da % x PM pertanto
0,40 x 64 = 25,6 g SO2
0,20 x 28 = 5,6 g N2
0,30 x 32 =9,6 g O2
0,10 x 18 = 1,8 g H2O
la quantità totale in grammi è 25,6+5,6+9,6+1,8 =42,6 g
le percentuali saranno pertanto:
42,6:25,6=100 😡 X=60,1 % SO2
42,6:5,6=100 : X X=13,15 % N2
42,6 :9,6 =100: X X= 22,53 % O2
42,6 : 1,8 = 100 :X X= 4,22 % H2O
risposta corretta C
56. Indicare due importanti motivi per cui le densità dei gas differiscono da quelle dei solidi e dei liquidi:
A) aumentano all’ aumentare della T e diminuiscono all’ aumentare della P
B) aumentano in modo direttamente proporzionale all’ aumentare della P e della T (Boyle)
C) dipendono fortemente dalla P e dalla T e sono proporzionali alla loro massa molare D) non esiste alcuna relazione tra la densità e la loro massa molare. Tale relazione esiste invece nei liquidi e nei solidi
soluzione
La densità assoluta (d) di un gas è data dal rapporto tra il peso e il volume :
essendp PV=nRT ed essendo n= numero di moli = grammi /PM si ha g /PM/V =P/RT ma n/V= densità perciò
d =g/V = P x PM/RT
da questa formula si evince che le risposte A e B sono errate, in quanto la densità di un gas diminuisce all’aumentare di T ed aumenta all’aumentare di P. La risposta D è certamente errata perché la densità è sempre in relazione alla massa molare cioè al numero di moli.
Nei liquidi la densità è sempre espressa in Grammi/volume o mg/ml . Un aumento di temperatura provoca un aumento del volume e quindi una diminuzione della densità ma per l’acqua, al contrario, il volume aumenta col diminuire della temperatura(ecco perchè il ghiaccio galleggia sull’acqua) . La pressione influenza anche la densità perché un aumento di pressione avvicina le molecole tra loro ed è anche ovvio che la pressione non influenza minimamente la densità di un solido.
Risposta corretta C
57. Indicare la relazione che si può riferire alla stessa cella elettrolitica:
A) ΔG0 > 0; E0 = 0
B) ΔG0 > 0; E0 > 0
C) ΔG0 < 0; E0 = 0
D) ΔG0 < 0; E0 > 0
soluzione
in una cella elettrolitica il potenziale elettrochimico E° è in relazione alla variazione di energia libera di Gibbs infatti ΔG° = – nF ΔE° e da questa espressione si vede che ΔG° è < 0 e ΔE° deve necessariamente essere >0
la risposta corretta è D
58. Indicare tra i seguenti fattori quelli che sicuramente possono influenzare la velocità di una reazione:
a) aumento (reazioni endotermiche) o diminuzione (reazioni esotermiche) della T
b) presenza di metalli finemente suddivisi o ossidi metallici
c) aumento della concentrazione di un reagente
d) eliminazione di un prodotto
e) variazione della T
A) a, b, c
B) e
C) a, b
D) a
soluzione
il fattore più importante che regola la velocità di una reazione è la variazione di temperatura.
dove k è la costante di velocità ; k0 è un fattore costante per variazioni di temperatura non troppo elevate ; ΔE† è l’energia di attivazione anch’essa costante per variazioni di temperatura non troppo elevate ;R è la costante dei gas e T è la temperatura assoluta (273+C°).
Risposta corretta B
59. L’urea è un importante fertilizzante prodotto nel mondo in grandi quantità. Per produrla si parte da miscele che contengono NH3 e CO2 in rapporto molare 3:1 anche se la reazione è: 2 NH3 + CO2 →CO(NH2)2 + H2O
Sapendo che, nel processo, da una mole di CO2 si ricavano solo 47,7 g di urea, indicare, nell’ordine, la resa teorica, reale e percentuale della reazione:
A) 30,1 g ; 24,7 g ; 82,4%
B) 50,1 g ; 42,3 g ; 79,4%
C) 30,1 g ; 32,7 g ; 40,4%
D) 60,1 g ; 47,7 g ; 79,4%
soluzione
dalla reazione si osserva che da 1 mole di CO2 (44g) si ottiene 1 mole di CO(NH3)2 cioè 60,1 g
pertanto la resa teorica sarebbe 60,1 g
poichè però invece che 60,1 g si ottengono 47,7g di urea, allora la resa reale è 47,7 g
la percentuale di resa % della reazione è calcolabile dalla proporzione 60,1 : 47,7 = 100 :X X=79,4 %
60. I reattivi di Grignard, RMgX, appartengono alla grande classe dei reattivi organometallici. Indicare l’affermazione ERRATA che li riguarda:
A) sono preparati per reazione di un alogenuro alchilico o arilico con Mg metallico in un solvente tipo etere, comunemente CH3CH2OCH2CH3
B) per reazione con un qualsiasi chetone formano un alcool terziario
C) la loro preparazione è effettuata in assenza di acqua perché l’acqua trasformerebbe il Grignard in un alcool o in un fenolo e idrossido
D) per reazione con un’aldeide formano un alcool primario o secondario a seconda dell’ aldeide usata.
soluzione
Quando il carbonio si lega ad un metallo forma un legame Carbonio-Metallo polarizzato, in cui la densità di carica negativa si trova sul carbonio perché la maggior parte dei metalli sono meno elettronegativi del carbonio. I composti che contengono un legame carbonio-metallo vengoni chiamati composti organometallici. I reattivi di Grignard sono composti organometallici in cui il metallo è il Magnesio e le molecole di solvente coordinano il magnesio

la struttura elettronica del Mg è [Ne] 3S2
e nello stato eccitato forma la struttura [Ne] 3S¹ 3P¹ : il radicale R col suo elettrone si accoppia con l’elettrone 3S e radicale alogenuro X si unisce all’elettrone 3P formando RMgX.Poichè vi sono disponibili altri due orbitali P vuoti, essi vengono occupati da due molecole di solvente dalla parte dell’ossigeno che fornisce il dopp
I reattivi di Grignard si preparano come si vede dalla precedente reazione, per trattamento di un alogenuro alchilico con magnesio metallico in solvente anidro.
come si vede, per reazione con acqua il Grignard formerebbe un alcano non un alcol o fenolo ed idrossido.
La risposta errata è C






Lascia un commento