NAZIONALI classi A-B
1- ANNULLATA
2. Secondo la definizione di Lewis, si comporta da base una specie:
A) in grado di cedere ioni H+ ad un’altra detta acido
B) in grado di accettare ioni H+ da un’altra detta acido
C) in grado di accettare una coppia di elettroni daun’altra detta acido
D) in grado di donare un doppietto elettronico ad un’altra detta acido
soluzione
base, secondo Lewis, viene definita una specie in grado di cedere un doppietto elettronico. Infatti NaOH è una base in quanto OH- possiede un doppietto elettronico che viene facilmente ceduto ad una specie in grado di acquisirlo (ad esempio H+ acquisice i due elettroni di OH- per formare H2O).
3. La somma della pKa di un acido e del pKb della sua base coniugata, a 298 K, vale:
A) 7
B) 14
C) 10
D) dipende dall’acido e dalla base
soluzione
sappiamo che se si ha un acido debole HA esso possiede un Ka che è in relazione al suo Kb secondo l’espressione
Ka x Kb = Kw quindi PKa+PKb =14
4. per la combustione completa di 0,5 mol di un idrocarburo occorrono 2,5 mol O2 e vengono prodotte 1,5 mol CO2 . Individuare l’idrocarburo
A) C3H6
B) C3H4
C) C3H8
D) C3H7
soluzione
la reazione da considerare, secondo i dati che ci vengono forniti,è la seguente:
0,5 X + 2,5 O2 → 1,5 CO2 + 2 H2O o meglio
1 X + 5 O2 → 3 CO2 + 4H2O
considerato che reagiscono 10 atomi di Ossigeno e che solo 3 x2 = 6 formano CO2, allora gli altri 4 atomi di ossigeno devono reagire con 8 atomi di idrogeno per formare acqua. Da quanto detto, si deduce che nella molecola X vi devono essere 3 atomi di C e 8 atomi d H.
La molecola è pertanto C3H8
5. Individuare le due molecole a geometria planare tra le seguenti:
1) CH2=CH2 2) NH2-NH2 3) PH3 4) BF3
A) l e 4
B) l e 3
C) 2 e 4
D) 2 e 3
soluzione
l’etilene CH2=CH2 ha struttura con gli atomi di c sullo stesso piano ibridi SP2 legati agli atomi di H con angoli di 120° . Nella figura l’etilene è vista dall’alto ed il doppio legame si ha per sovrapposizione di 2 orbitali Pz non ibridi non indicati in figura.
Nell’idrazina NH2-NH2 l(molecola n.2)’azoto è ibrido SP3 e quindi ha struttura tetraedrica. La fosfina PH3, come l’idrazina ha struttura tetraedrica mentre BF3 ha struttura planare con orbitali ibridi SP2 ed angoli di circa 120°. Gli orbitali Pz delocalizzano gli elettroni
1 2
3
4

le molecole planari sono la 1 e la 4
6. Completare in modo corretto la frase: le forze di Van der Waals sono forze
A) di interazioni tra ioni
B) interrmolecolari con energia di legame confrontabile con quella di un legame covalente
C) intermolecolari con energia di legame compresa tra l’ energia del legame covalente e oueìla del legame idrogeno
D) intermolecolari con energia di legame inferiore a quella del legame idrogeno
soluzione
per forze di Van der Waals si intendono 3 tipi di interazioni molecolari:
- forza dipolo permanente-dipolo permanente (o forza di Keesom);
- forza dipolo permanente-dipolo indotto (o forza di Deby);
- forza dipolo istantaneo-dipolo indotto (o forze di london).
le forze di van der Waals sono deboli se paragonate alla forza dei legami chimici tra atomi e differiscono da questi in quanto dipendono dalle fluttuazioni nella distribuzione delle cariche elettroniche nelle molecole cioè dai momenti di dipolo permanenti, istantanei o indotti. Le Forze di Van der Waals dipendono pertanto dall’orientamento relativo delle molecole: le interazioni di dipolo permanente- indotto (forze di Debye) e di dispersione dipolo istantaneo-indotto(forze di London) sono sempre attrattive, indipendentemente dall’orientamento delle molecole. Le interazioni dipolo permanente-permanente (forze di Keesom) tuttavia, cambiano segno con la rotazione delle molecole per cui la forza elettrostatica può essere di repulsione o attrazione.Le forze di London si presentano in molecole che non hanno momento dipolare permanente. Per esempio, nelle molecole non polari come gli alogeni, gli elettroni che si muovono intorno alle molecole si distribuiscono in modo non equilibrato istante per istante: nel momento in cui gli elettroni non sono equamente distribuiti sulla molecola si forma un dipolo temporaneo che interagisce con altri dipoli vicini e induce le altre molecole a formare, a loro volta, dipoli indotti. Le forze di Deby sono forze dovute all’interazione tra un dipolo permanente e un dipolo indotto (noto anche come polarizzazione della molecola). riscontriamo queste forze tra una molecola polare ed una apolare. Infatti,la molecola polare induce su quella apolare una separazione di carica (dipolo indotto) ed i due dipoli, si attraggono. Questo tipo di interazione dipende dalla polarizzabilità, cioè dalla facilità con cui la nuvola elettronica di una molecola apolare (o un atomo) può essere deformata, e questa aumenta con le dimensioni molecolari o atomiche.Le forze di Keesom (interazioni dipolo-dipolo) sono forze attrattive che si verificano se dipoli permanenti di molecole polari si allineano tra loro con il polo positivo di una molecola diretto verso quello negativo di un’altra molecola vicina. Il Legame idrogeno è considerato una forma estrema di forze di Keesom.L’energia media delle forze dipolo-dipolo è circa 4 KJ/mole che è molto debole rispetto a quella di un legame covalente (circa 400 KJ/mole).la figura 1 mostra le forze di Deby tra una molecola di Cloro e l’acqua la figura 2 mostra il legame idrogeno nell’acqua, la figura 3 rappresenta le forze di London tra molecole di Iodio
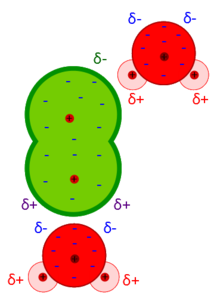


forze di Deby legame idrogeno forze di london molecole di I2
la risposta corretta è la D
7. Quali tra le seguenti proprietà degli elementi ha un andamento periodico?
A) La massa atomica
B) il numero atomico
C) l’affinità elettronica
D) il numero dì massa
soluzione
l’affinità elettronica è una proprietà periodica che aumenta lungo un periodo e diminuisce lungo il gruppo. L’affinità elettronica e l’energia di ionizzazione, anch’esse proprietà periodiche, contribuiscono al calcolo dell’elettronegatività. Né la massa atomica né il numero atomico né il numero di massa hanno un andamento periodico, infatti non variano né nel periodo e tantomeno nel gruppo.
risposta corretta C
8-Quale delle seguenti configurazioni elettroniche di un atomo neutro non è corretta?
A) 2S² 2P6
B) 4S² 3d10 4P¹
C) 6S² 4f10
D) 4S² 2d5
soluzione
la risposta errata è D 4S2 2d5 in quanto non può esistere un livello 2d
i livelli sono infatti 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
9- Durante un’autopsia sotto la lingua del paziente viene trovata una polvere bianca . L’analisi rivela una percentuale in peso di Na+ del 33,18 %. Quale delle seguenti sostanze può essere la polvere bianca?
A) Na2P2O7
B) Na3AsO3
C) Na3PO4
D) Na3AsO4
soluzione
per individuare la molecola occorre eseguire il calcolo
Na2P2O7 : 2Na+ = 100 :33,18 265,9 : 46 5,76 > ( 100/33,18 =3,01 )
Na3AsO3 :3 Na+= 100:33,18 191: 69 2,77 < 3,01
Na3PO4: 3Na+ = 100:33,18 164: 69 2,37 <3,01
Na3AsO4 : 3Na+ = 100 : 33,18 208 :69 3,01 = 100/33,18
si deduce che la polvere bianca è costituita da Na3AsO4
10- Qual è l’angolo dì legame FXF in un fluoruro XF 3, se X e un elemento la cui configurazione elettronica nello stato fondamentale è 1S² 2S² 2P ¹
A) 60°
B) 109°
C) 120°
D) 180°
soluzione
l’elemento che nello stato fondamentale ha 5 elettroni è il Boro ed il composto è BF3-
Gli orbitali del boro in questo caso assumono la struttura 1S² 2S¹ 2Px¹2Py¹ e quindi si ibridizzano SPtali orbitali formano angoli di 120 gradi e la struttura è :
11- il volume molare di un gas ideale alla temperatura di 25° ed alla pressione di 1 bar è:
A) 22,414 l/mol
B) 24,465 l/mol
C) 22,711 l/mol
D) 24,790 l/mol
soluzione
1bar =100 kPa
pertanto PV = nRT n=1 P= 1 / 105 R=8,314 T= 298
V= ( 1x 8,314 x 298/1oo kPa)= 24,78 l/mol
12- indicare l’affermazione ERRATA tra le seguenti:
A) l’energia degli orbitali atomici dell’idrogeno dipende solo dal numero quantico n
B) l’energia di un generico orbitale atomico dipende dai numeri quantici n ed l
C) il numero quantico l dà indicazioni sulla “forma” dell’orbitale atomico
D) l’ energia dì un generico orbitaie atomico dipende dai numeri quantici n, l ed m
soluzione
la risposta errata è la B perché l’energia di un orbitale non dipende dai numeri quantici n ed l insieme perché l definisce la “forma” dell’orbitale non l’energia.
13 – Nella reazione
NH4+(aq) + H2O(l) <=> NH(aq) + H3O+(aq)
l’acqua si comporta da:
A) acido
B) ossidante
C) base
D) riducente
soluzione
l’acqua riceve il protone dall’NH4+ mettendo a disposizione uno dei doppietti elettronici liberi localizzati sull’ossigeno, quindi per la definizione di Lewis si comporta da Base.
14. La percentuale di sodio in una miscela costituita solo da NaCl e Na2CO3 è del 42,0 % (m/m). Calcolare la composizione percentuale del campione.
A) 32,6% Na2CO3 67,4% NaCl
B) 50% Na2CO3 50% NaCl
C) 67,4% Na2CO3 32,6% NaCl
D) 73,2% Na2CO3 26,8% NaCl
soluzione
su 100 g di miscela i 2/3del sodio provengono da Na2CO3 e 1/3 da NaCl
i 2/3 di 42 corrispondono al 42 :2/3×42 =100:x x=66,7 % Na2CO3 è quindi li 66,7% della miscela
1/3 di 42 corrisponde a 42: 1/3×42 =100:x x= 33,3 % NaCl è il 33,3 % della miscela
15. Quale dei seguenti campioni è costituito da circa 6,02 x 10 23 atomi di ossigeno legati?
A) 33,0 g di CaCO3
B) 156 g di H2SiO3 78
C) 76,0 g di Cr2O3 152
D) 63,0 g di HNO3 63
soluzione
100:48=33:x X=16 g
78:48=156:x X=96 g
152:48=76:x x= 24 g
63:48_ 63:x X=48 g
dal momento che 6,02 x 10 23 è il numero di Avogadro e rappresenta il numero di atomi o molecole presenti in 1 grammoatomo o 1 mole di una qualunque sostanza, si vede che in CaCO3 vi sono 16 g di ossigeno legato e questi grammi corrispondono ad 1 grammoatomo di ossigeno e pertanto in CaCO3 vi è contenuta una quantità di atomi di ossigeno pari a 6,02 x 10 23
16. Quale delle seguenti sostanze è un solido di tipo molecolare?
A) BaO (s)
B) KCI (s)
C) C (s) diamante
D) CO2(s)
soluzione
un cristallo molecolare è costituito da molecole che stabiliscono tra loro legami deboli secondari come le forze di Vander Waals o forze di London o interazioni dipolo-dipolo o legame idrogeno .Le molecole polari formano legami dipolo-dipolo e legami idrogeno, mentre quelle non polari sono soggette alle più deboli forze indicate sopra. Tra le molecole proposte, il solido molecolare è costituito da CO2 che è una molecola che ha momenti di dipolo diretti in senso opposto e quindi nell’insieme è apolare. Nella CO2 solida le molecole sono tenute insieme dalle forze di Van der Waals e forze di London ed il solido è chiamato ghiaccio secco.Ciò, spiega anche perché passa dallo stato solido a quello aeriforme (sublimazione) .
17. Indicare, secondo la teoria VSEPR, la geometria di una molecoia di SO2
A) trigonale planare
B) lineare
C) angolare
D) a T
soluzione
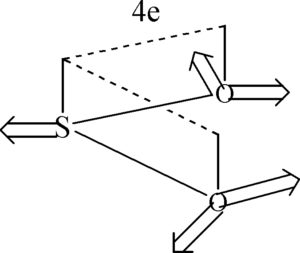 La struttura è planare ma con gli atomi ibridi SP2 e quindi con angoloso di circa 120°
La struttura è planare ma con gli atomi ibridi SP2 e quindi con angoloso di circa 120°
18. Per calcolare la molarità di una soluzione acquosa di glucosio (C6H12O6), di cui si conosce il volume, quale ulteriore informazione è necessaria?
A) la densità dell’acqua
B) la densità della soluzione e la massa del glucosio
C) La massa del glucosio
D) La densità dell’acqua e la massa molare del glucosio
soluzione
la molarità M è definita dal rapporto M= moli/1 litro , pertanto noto il volume è necessario conoscere la massa del glucosio per poter calcolare le moli e quindi M.
19. Una soluzione 0,001 M di LiOH ha pH:
A) 14
B) 3
C) 11
D) 10-3
soluzione
[OH-]=0,001 = 1 x 10-3 POH = 3 PH= 14-POH = 14-3 =11
20. Elementi che hanno lo stesso numero di elettroni nella configurazione elettronica esterna:
A) fanno parte dello stesso gruppo della tavola periodica
B) hanno la stessa affinità elettronica
C) hanno la stessa energia di ionizzazicne
D) fanno parte dello stesso periodo della tavola periodica
soluzione
appartengono allo stesso gruppo infatti ad esempio
H 1s¹
Li 1S² 2S¹
Na 1S² 2S² 2P6 3S¹
21. individuare l’agente ossidante neila reazione spontanea:
Zn (s) + Cu+2(aq)→ Zn+2(aq) + Cu(s)
A) Cu(s)
B) Zn (s)
C) Zn+2 (aq)
D) Cu2+(aq)
soluzione
poiché lo Zn metallico si ossida è evidente che l’ossidante è Cu+2
infatti
Zn→ Zn+2 +2e
Cu+2+ 2e → Cu
l’ossidante si riduce(acquista elettroni) e lo zinco si ossida (cede elettroni al Cu+2 e lo riduce) quindi lo Zn è riducente e Cu+2 l’ossidante
22. Un recipiente chiuso contiene n moli di un gas ideale. Una delle pareti è un pistone libero di scorrere su cui agisce una forza imposta dall’esterno. Le altre pareti sono rigide. Se la forza viene raddoppiata, per mantenere costante il volume del gas, si dovrà:
A) mantenere la temperatura costante
B) aumentare la temperatura
C) diminuire la temperatura
D) non si può dare una risposta, in mancanza di informazioni aggiuntive
soluzione
In questo esempio il gas viene sottoposto ad una forza esterna attraverso il pistone quindi la sua pressione viene modificata ed il volume diminuisce. Per mantenere lo stesso volume è necessario che la pressione interna del gas aumenti e ciò può avvenire solo aumentando la temperatura da T1 a T2. Siha pertanto
P1V1/T1 = P2V2/T2 in questo caso
V1 deve essere =V2 ; P1 dovrà essere uguale a P2 e quindi bisogna necessariamente aumentare la temperatura da T1 a T2
23. Due recipienti contenenti rispettivamente 100 g di acqua alla temperatura di 25°C e 60 g di etanolo alla temperatura di 5 °C sono posti a contatto attraverso una parete conduttrice diatermica (conduttrice di calore). Se le altre pareti dei due contenitori sono adiabatiche (isolanti), qual è la temperatura del sistema quando si raggiunge l’equilibrio? Le capacità termiche specifiche di acqua ed etanolo sono 4,184 J K-1 g-1 e 2,460 j K-1 g-1
A) circa 15 °C
3; circa 2o °C
C) circa 18 °C
Dj circa 10 °C
soluzione
se si considerano due corpi che si trovano a temperature diverse T1 e T2, con T1>T2, e se li mettiamo in contatto si può osservare che il corpo più caldo si raffredda mentre quello più freddo si riscalda. In un sistema di assi cartesiani in cui sull’asse delle ascisse poniamo i valori del tempo trascorso dal momento del contatto t e sull’asse delle ordinate la temperatura T l’andamento delle temperature dei due corpi, sopra, descritto è facilmente oservabile : il corpo più caldo si raffredda nel tempo mentre il corpo più freddo si riscalda.

Si vede pertanto che dopo un certo tempo i due corpi finiscono col trovarsi praticamente alla stessa temperatura,detta temperatura di equilibrio Teq, quando i due corpi raggiungono l’ equilibrio termico.
Siano T1, m1, c1 e T2, m2, c2 rispettivamente la temperatura, la massa e il calore specifico del primo e del secondo corpo e supponiamo che t1<t2allora , come abbiamo detto,il calore fluirà dal corpo più caldo a quello più freddo e dopo un certo tempo, i due corpi raggiungeranno una medesima temperatura di equilibrio Teq.
Si deduce ovviamente che la quantità di calore Q2 ceduta dal corpo con temperatura T2 dovrà essere uguale alla quantità di calore Q1 acquistata da quello con temperatura T1. Sapendo che Q= cm ΔT si avrà pertanto: Q1=Q2 ovvero
 da cui si ottiene :
da cui si ottiene :
24 . La molecola 03 ha geometria (posizione media relativa degli atomi)
A) la molecola 03 non esiste
B) lineare
C) angolare o lineare, in dipendenza dall’ambiente esterno
D) angolare
soluzione
gli atomi di ossigeno nell’ozono sono ibridi SP2 con gli orbitali Pz che si sovrappongono con delocalizzazione degli elettroni.
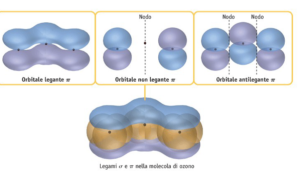
25 ANNULLA TA
26. Confrontando 1 L di soluzione acquosa 1 m di NaCl con 1 L di soluzione acquosa 1 M di NaCl, la prima soluzione:
A) contiene una quantità minore di NaCl
B) contiene una quantità maggiore di NaCI
C) contiene una quantità minore di acqua
D) ha una densità maggiore
soluzione
Molarità (M)
è il numero di moli di soluto per litro di soluzione M = n° moli di soluto / volume di soluzione pari ad 1 L
Tenendo presente che: n° moli = grammi di soluto / peso molecolare del soluto n° moli = g/(g/mol)
Molalità (m),
è il numero di moli di soluto contenuto in 1kg di solvente
m = n°moli di soluto / kg di solvente [m] = mol/kg
NaCl 1m = 58,44 g in 1 Kg di solvente NaCl 1 M = 58,44 in 1000 ml di solvente
quindi NaCl 1 M in questo caso sarà 58,44 g /1000 mentre 1 molale significa 1 mole cioè 58,44 g in 1058,44 cioè in 1 Kg è 0,945 e questa è una quantità inferiore rispetto alla molarità.
la risposta corretta è A
27. Calcolare le moli di NO che si ottengono quando si trasformano 2,0 mol di (NH4)2Cr207 secondo la reazione (da bilanciare)
(NH4)2 Cr2O7 → NH3 + Cr2O3 +NO + H2O
A) 1,5 mol
B) 4,0 mol
C) 6,4 mol
D) 2,4 mol
soluzione
la reazione redox è:
10 (5) [Cr2O7-2 + 6 e + 8H+ → Cr2O3 + 4H2O
6 (3) [2NH4+ + 4 H2O → 2NO + 4H+ +10 e
________________________________
5Cr2O7-2 + 6NH4+ + 4H+→ 5Cr2O3 + 6 NO + 14H2O
quindi da 5 moli di Cr2O7-2 si ottengono 3 moli di NO pertanto da 2 moli si otterranno
5:6 =2: X X= 6×2/5 = 2,4 moli
28. Una soluzione satura di KNO3 ha una concentrazione 3,1 7 M e una densità di 1,055 g/mL a 293 K, Determinare la solubilità di KNO3 espressa come % (m/m) a 293K
A) 28,4%
B) 55,3%
C) 30,4%
D) 43,5%
soluzione
la soluzione 3,17 M contiene 3,17 x 101,1 (Peso Molecolare) = 320,5 g quindi 320 g /1055 g = 0,3037 cioè
% (m/m ) =30,4
29. A 25°C, le densità dell’acetone e dell’etanolo sono, rispettivamente, 0,791 g/mL ; 0,789 g/ml.. Indicare quale delle seguenti soluzioni di acetone-in etanolo contiene la maggiore quantità di acetone espressa in grammi di acetone per 100 mL di soluzione
A) 12% (m/m)
B) 12% (m/V)
C) 12% (V/V)
D) 12 Kg/m3
soluzione
12%(m/m) significa che vi sono 12 g in 100 g di soluzione che corrispondono a 0,12 x 1000 g (g di soluzione)= 120 g
di acetone
12%v/v 12 ml in 100 ml quind 120 ml corrispondono a 120x 0,791 = 94,99 g di acetone
12% m/v 12 g in 100 ml di soluzione 12 x 0,791 = 9,49 g in 100 ml 94,92 in 1000 ml
la risposta corretta è A
30. Qual è, a 303 K, la densità (g/L) di una miscela gassosa ideale, costituita da CO2 (g) e N2 (g) alle pressioni parziali di 0,858×105 Pa e 0,955x 105 Pa rispettivamente?
A) 1,55 g/L
B) 2,56 g/L
C) 1,09 g/l
D) 2,04 g/L
soluzione
dmiscela =∑ (P1x PM1+ P2xPM2) / RT dmiscela = (0,858 x 44 ) + ( 0,955 x 28 ) x 105 /8,314 x 303
dmiscela = 2,56 g/ L
31. in un reparto di saldatura la concentrazione di NO (g) nell’aria è 15,0 ppm alla temperatura di 290 K ed alla pressione di 1,01x 105 Pa. Qual è la concentrazione di NO,(g) (in mg/m³)?
A) 35,6 mg/m³
B) 11,6 mg/m³
C) 22,7 mg/m³
D) 17,9 mg/m³
soluzione
15 ppm = 15 mg = 0,015 g
siccome ppm=mg/volume mg=ppm x volume
PV = n RT n/V V=(g/PM) x RT /P V= 8,314 x 290 x (0,015/30) / 1,01x 105 = 1194 L
mg= 15 x 1,194 =17,9 mg/m³
32 – 5,00 L di una sostanza gassosa X, misurati alla temperatura di 310 K e alla pressione di 2,1×105 Pa, hanno lo stesso peso di 2,50 L di ossigeno molecolare misurati nelle stesse condizioni di temperatura e pressione. Calcolare la massa molare del gas.
A) 85,7 g/mol
B) 16,0 g/mol
C) 44,9 g/mol
D) 76,3 g/mol
soluzione
PV = nRT n = g/32= 2,1×105 x 2,5 /8,314 x 310 = 203,7 m0li 203 x 32 = 6518,3 g
quindi PV = 6518,3 /PM RT da cui PM = 6,1518,3 8,314 x 310 / 2,1×105 x 5 = 16,0 PM=16
33. .La reazione di equilibrio A (g) + B (g) <==> C (g) ha una costante Kc= 0,877 (espressa in concentrazioni molari). Determinare per quale valore della concentrazione molare di B, all’equilibrio, si ha [C] = [A].
A) 1,07
B) 1,55
C) 1,14
D) 2,13
soluzione
Kc= [C]/[A][B] = 0,877 calcoliamo [B] quando [C]=[A] [B] = ([C] /[A] 0,887) =1/0,877 = 1,14
34. Analizzando la carne di una trota di fiume si è trovato che conteneva Hg in una concentrazione pari a 7,40 pg/kg. Mangiando 0,310 kg di pesce 2 volte la settimana, in quante settimane un individuo ingerisce 1 mg di Hg?
A) 218 settimane
B) 325 settimane ,
C) 421 settimane
D) 186 settimane
soluzione
7,4 picogrammi corrispondono a 7,4 x 10-9 mg
se mangiando 1 Kg introiterebbe 7,4 x 10-9 mg, mangiandone 0,310 x 2 a settimana ne introita X
X= 0,620 x 7,4 x 10-9
= 4,59 x 10-9 mg introitati in 1 settimana.
Pertanto se in 1 settimana introita 4,59 x 10-9 mg quante settimane occorrono per introitare 1 mg?
1 :4,59 x 10-9 mg = X settimane : 1 mg X=1 /4,59 x 10-9 = 218 settimane
35. Calcolare quanti kg di N2, sono contenuti in 5,30 m³ di aria misurati a 304 K e alla pressione di 1,01 x 105 Pa (composizione dell’aria (V/V): 21% o, e 79% N2)
A) 5,32 kg
B) 3,99 kg
C) 6,51 kg
D) 4,69 kg
soluzione
5,3 m³ corrispondono a 5300 litri di aria. Calcoliamo n dall’ equazione di stato dei gas PV=nRT
n= PV/RT = 1,01 x 105 x 5300 /8,314 x 304 = 2,12 x 105
100 :79 = 2,12 x 105 : X X = 1,67 x 105 moli di N2 pari a 1,67x 28 =4,69 Kg
36. 3,0 moli di un idrocarburo di formula C2Hx reagiscono CO ossigeno secondo la reazione:
C2Hx (g) + (2+x/2) O2 (g) —> 2 CO2 (g) +H2O(l)
Sapendo che si producono 6,0 moli di acqua, determinare la formula dell’idrocarburo
A) C2H8
B) C2H6
C) C2H4
D) C2H2
soluzione
non può essere C2H8 perchè si avrebbe una reazione non bilanciata
C2H8 +(2+8/2) O2 → 2 CO2 + 4 H2O
non può essere nemmeno C2H6
la reazione in tal caso sarebbe
2C2H6 +2 (2+6/2)O2 → 4CO2 + 6H2O
l’ossigeno non è bilanciato.
considerato che si ottengono 6 molecole di H2O allora la reazione deve essere:
C2H4 + (2+4/2) O2 → 2 CO2 + 2 H2O
3C2H4 +3x(2+4/2) O2 → 6CO2 + 6H2O
3C2H4 + 9 O2 → 6CO2 + 6H2O
37. Il metano brucia secondo la reazione (da bilanciare). CH4(g) + O2(g) → CO2 + H2O (l)
Se si bruciano 2.5 L di CH4 misurati alla temperatura di 308 K e alla pressione di 1,01 x 105 Pa quali sono i volumi di O2 consumato e di CO2 formata, misurati nelle stesse condizioni di temperatura e pressione?
A) 5,0 L O2, 2,5 L CO2
B) 3,4 L O2, 1,33 L CO2
C) 6,1 L O 4,0 L CO2
D) 2,9 L O2 3,5 L CO2
soluzione
la reazione bilanciata è CH4(g) + 2 O2(g) → CO2 +2 H2O (l)
calcoliamo il numero di moli iniziali di CH4 n=PV/RT n= 1,01 x 105 x 2,5 /8,314 x 308 =98,60
le moli di CO2 sono 1: CO2 = 98,6 😡 x = 98,6 moli che corrispondono a 2,5 litri
le moli di O2 sono il doppio di CH4 quindi sono 98,6 x 2 = 197,2 che corrispondono a 5,0 litri
38. Un minerale che contiene il 2,50% (m/m) di zolfo, brucia secondo la reazione: S (s) + O2 (g) SO2 (l) Quanti grammi di aria sono necessari per la combustione di 1,OO Kg di minerale? (composizione dell’aria (V/V): 21,0% O2 79,0% N2)
A) 232,7 g
B) 107,0 g
C) 143.9 g
D) 554,8 g
soluzione
in un Kg vi è il 2,5 % di S cioè 25 g
dalla reazione si evince che per 32 g di S sono necessari 32 g di O2 quindi in questo caso la quantità di O2 necessaria è 25 g tuttavia l’ ossigeno nell’aria(v/v) è solo il 21 % e l’aria ha una densità paria 1,12 a 20° C per cui in realtà la % di ossigeno nell’aria (in g) è 21 x 1,12 = 23,52 % quindi la quantità in g di aria necessaria alla combustione è 25/0,23,52 = 106,3 g
39. Determinare i grammi di oro che si “sciolgono” in 200 mL di una soluzione 0,15 M di KCN, secondo la reazione (da bilanciare):
Au + CN- + O2 + H2O → Au(CN)4- + OH-
A) 3,22 g
B) 1,04 g
C) 2,55 g
D) 1,48 g
soluzione
la reazione bilanciata è Au +4 CN- + O2 + 2H2O → Au(CN)4- + 4OH-
in 200 ml di KCN 0,15 M vi sono 200x 0,15 = 30 mmoli di KCN cioè 0,03 moli
poiché dalla reazione si evince che per 4 moli di CN- si scioglie 1 mole di Au si ha
4 : 1 = 0,03 😡 X= 0,0075 moli cioè 197 x 0,0075 = 1,48 g
40. In 100 mL di una soluzione satura dì ossigeno in acqua, sono contenuti 3,16 mL di O2, misurati alla temperatura di 298 K e alìa pressione di 1,01 x 105 Pa. Determinare la solubiìità di O2 in mol/L
A) 2,07×10-3 M
B) 1,29×10-3 M
C) 1,01 x 10-3 M
D) 1,65 x10-3 M
soluzione PV=nRT n = 1,01 x 105x 0,0316/8,314 x 298 = 1,29 x 10-3 moli di O2/l
Qui continuano gli ultimi 20 quesiti della classe A
41. Una norma prevede che la concentrazione massima di metanolo nell’aria in un luogo di lavoro non possa superare 250 ppm. Quali tra i seguenti valori, espressi in % (V/V), supera il limite normativo?
A) 0,0027%
B) 0,0260%
C) 0,0099%
D) 0,0122%
soluzione
250 ppm significa che su 1 x 106 unità vi sono 250 unità quindi in 100 😡 250x 100/1 x 106
il limite è pertanto 0.0250 e nel quesito proposto il dato che supera il valore limite è 0,0260 (risposta B)
42. Essiccando per 24 orc a 180 “C, un campione di 1,54 g di Na2SO4 . n H20 si allontana tutta l’acqua di idratazione e il peso del campione diventa 0,68 g. Calcolare il numero “n” di molecole dì acqua di idratazione dei sale.
A) 2
B) 4
C) 8
D) 10
soluzione
1,54 g/PM+g =0,68g/PM dove g sono i grammi di H2O ed essendo il PM di Na2SO4 =142 si ha 1,54/142+g = 0,68/142
142+g = 142×154 /68 =321,6 quindi g= 321,6- 142 =179,6 g di acqua che corrispondono a n=179,6 / 18 = 9,98 quindi
la formula è Na2SO4. 10 H2O
43. Immergendo in un cilindro graduato contenente metanolo, una scheggia di un solido impermeabile che pesa 5,94 g, il livello del metanolo nel cilindro si innalza. Per riportare il metanolo allivello iniziale è necessario prelevare dal cilindro 4,08 g di metanolo. Calcolare la densità del solido. (densità metanolo = 0,792 g/ml.),
A) 1,01 g/ml,
B) 1,15 g/ml.
C) 1,22 g/rnl.
D) 1 ,35 g/ml
soluzione
4,08 g di metanolo corrispondono ad un volume di V=4,08 /0,792 = 5,15 ml
la densità del solido è quindi 5,94/5,15 = 1,15 g/ml
44. Qual è il volume di un recipiente che contiene 0,30 kg di etano a 40 °C alla pressione di 1,0’107 Pa?
A) 1,4 m3
B) 2,6 m3
C) 5,2 m3
D) 2,6 m3
soluzione
PV=nRT V= nRT/P quindi V= (300/10 ) x 8,314 x 313 / 1,01 x 105
V= 2,6 litri(dm³)
45. Sono funzioni di stato:
A) l’energia interna il lavoro ed il calore
B) il lavoro ed il calore, ma non “energia interna
C) l’energia interna ed il calore, ma non il lavoro
D) l’energia interna, ma non il calore ed il lavoro
soluzione
Una funzione di stato è una funzione che dipende esclusivamente dallo stato iniziale e finale del sistema e non dal cammino seguito per giungere allo stato finale. Ad esempio, il lavoro esercitato da un gas contro una pressione esterna in condizioni di irreversibilità è L= -P(V2-V1) mentre in condizioni di reversibilità (cioè quando due stati successivi del sistema cambiano in modo infinitesimo) il lavoro è dato da L= -RT∫ δv/v
cioè L=-RTln v2/v1. Il calore a sua volta in condizioni isobare (a P=k)o isocore (a V=k) assume valori diversi quindi, calore e lavoro singolarmente dipendono dal modo con cui vengono ottenuti invece la la loro somma è una funzione di stato perché essa rappresenta l’energia interna del sistema :
E= Q-Lavoro (il segno meno si riferisce al lavoro compiuto dal sistema).
46. Aumentando la temperatura di una soluzione, quale delle seguenti grandezze non cambia?
A) molarità
B) molalità
C) densità
D) nessuna delle risposte precedentisoluzione
la densità è funzione della temperatura così come la molarità essendo questa il numero di moli in 1 litro di soluzione, in quanto la densità del solvente varia con la temperatura. La molalità invece non dipende dalla temperatura in quanto essa è data dal numero di moli per Kg di solvente (il peso non cambia con la temperatura).
47. I motori di alcuni razzi funzionano tramite la combustione completa del butano (C4H10) con ossigeno liquido. Quanti kg di ossigeno devono essere iniettati per ogni kg di butano che brucia?
A) 3,58 kg
B) 7,16kg
C) 535 kg
D) 1,78 kg
soluzione
la reazione di combustione del Butano è 2 C2H10 + 13 O2→ 8CO2 + 19H2O
cioè per 2 x 58 g di butano sono necessari 13 x 32 g di O2 pertanto per 1000 grammi sono necessari 116:416 = 1000:X X= 3,58 Kg
48. L’energia di prima ionizzazione di un atomo è:
A) l’energia minima richiesta per allontanare a distanza infinita l’elettrone più esterno da un atomo isolato
B) l’energia liberata quando uno ione carico negativamente perde un elettrone
C) l’energia liberata dalla reazione tra un elettrone e une ione positivo allo stato gassoso
D) l’energia minima richiesta per allontanare a distanza infinita un generico elettrone dall’atomo isolato
E’ l’energia necessaria per allontanare un elettrone esterno di un atomo isolato a distanza infinita.(risposta A)
49. Indicare il prodotto gassoso che si libera quando si introduce Zn metaI!ico in una soluzione acquosa concentrata di HCl
A) Cl2
B) H2
C) O2
D) ZnCCl2
soluzione
dai valori di Potenziale standard di riduzione dello Zinco , dell’idrogeno e del cloro vediamo che E° Zn+2 + 2 e → Zn = – 0,7628 V E°Cl2 +2e → 2Cl- = 1,36 V
e per l’ idrogeno E° 2H+ +2e → H2 = 0,00 per convenzione.
Poiché lo zinco +2 ha un valore di E° più piccolo dell’idrogeno e del cloro, agirà da riducente nei confronti di ambedue ma si ridurrà prima l’idrogeno che ha un valore di E° (0,00) più basso di quello del Cloro (1,36)
50. Il composto Na2O2 è:
A) perossido
B) ossido
C) superossido
D) idrossido
soluzione
I perossidi sono composti in cui vi sono due atomi di ossigeno uniti tra loro con legame covalente σ. Nell’Na2O2 i due atomi di ossigeno si trovano sulle stesso piano mentre gli atomi di sodio sono legati ai due atomi di ossigeno e si trovano uno al di sopra e l’altro sul piano su cui si trovano gli atomi di ossigeno. La struttura è simile a quella del perossido di idrogeno (acqua ossigenata).
51. Secondo il modello atomico di Thomson un atomo è costituito da:
A) un nucleo positivo e particelle cariche negative che vi ruotano intorno secondo orbite ben definite
B) una massa carica negativamente all’interno della quale sono distribuite in maniera uniforme particelle cariche positivamente
C) una massa carica positivamente all’interno della quale sono distribuite in maniera uniforme particelle cariche negativamente
D) una massa neutra all’interno della quale sono distribuite in maniera uniforme particelle cariche negativamente
soluzione
il modello di Thomson è stato il primo tentativo di attribuire una struttura all’atomo che si sapeva essere costituito da cariche positive e negative. L’idea di Thomson era che l’atomo fosse costituito da cariche positive al cui interno vi erano gli elettroni carichi negativamente come se si trattasse di uvetta in un panettone. La risposta al quesito è quindi la C.
52. Quando una reazione ha raggiunto l’equilibrio:
A) le moli di prodotto sono uguali alle moli di reagente
B) la massa di prodotto è uguale alla massa di reagente
C) le quantità chimiche di reagente e prodotto non cambiano se cambia la pressione e/o la temperatura
D) nessuna delle risposte precedenti
soluzione
una reazione si dice sia all’equilibrio quando la velocità di formazione dei prodotti è uguale a quella di formazione dei reagenti dai prodotti cioè:
aA +bB <===> cC + dD V1= k1 [A]a [B]b V2 =k2 [C]c [D]d si ha l’equilibrio quando V1=V2
K2/K1 = Keq = [C]c [D]d / [A]a [B]b
si deduce che la risposta al quesito è la D
53. Quale delle seguenti specie presenta l’atomo con il numero di ossidazione più alto?
A) Mn04-
B) Cr2O7-2
C) IrCl6-2
D) OsO4
soluzione
il numero di ossidazione è il numero che individua la somma algebrica delle cariche risultanti dai legami con doppietti elettronici tra l’atomo in esame e gli atomi a cui è legato. Si attribuisce all’atomo il segno +1 per ogni doppietto che lo lega ad un atomo più elettronegativo e si assegna un valore -1 se è legato con un doppietto ad un atomo meno elettronegativo e 0 se è legato ad un atomo della stessa specie.
Nel quesito proposto, il Mn in Mno4- è legato all’ossigeno (più elettronegativo) con 4 x 2 doppietti quindi si ha 4×2=8 ma bisogna sottrarre la carica negativa per cui in MnO4- il Mn ha n.o. 7.
Nel Dicromato i 2 atomi di cromo sono legati a 2×7 doppietti degli atomi di ossigeno quindi per 2 atomi di cromo si ha un n.o. +7 x 2 =14 e sottraendo le 2 cariche negative si ha 12 . Quindi per 1 atomo di cromo il n.o. = 12/2 =6
in IrCl6-2 l’Iridio è legato al cloro (più elettronegativo) per cui il n. o. =6 meno 2 cariche negative n.o.=4
In OsO4 l’osmio è legato all’ossigeno con 4 doppietti elettronici quindi il n.o. è 4×2=8
Si deduce che la risposta al quesito è la D
54. In un solido metallico:
A) elettroni e ioni metallici sono liberi di muoversi nel reticolo
B) le molecole occupano posizioni definite nel reticoìo e sono legate da forze di Van der Waals
C) gli ioni metallici occupano posizioni definite mentre gli elettroni sono liberi di muoversi all’interno del reticolo
D) gli ioni metallici possono muoversi liberamente nel reticolo mentre gli elettroni occupano posizioni definite
soluzione
secondo il modello di Fermi un solido metallico ha una struttura in cui gli ioni metallici occupano le posizioni di un reticolo il quale è immerso in un “mare ” di elettroni come se ad esempio avessimo un cesta immersa in un ruscello in cui la cesta rappresenta il reticolo e l’acqua gli elettroni. Il modello a bande descrive, tuttavia, molto meglio i solidi metallici.
La risposta al quesito è la C
55. indicare in quale delle seguenti sostanze il legame è dovuto principalmente a forze elettrostatiche:
A) sodio
B) cloruro di sodio
C) acido cloridrico
D) diamante
soluzione
Tra le molecole indicate solo nel cristallo di cloruro di sodio vi sono degli ioni quali Na+ e Cl- che sono tenuti insieme da forze elettrostatiche mentre nelle altre molecole si hanno legami covalenti e nel sodio metallico si hanno solo atomi e non ioni.
56. Quante moli di Fe2O3 si possono ottenere se si hanno a disposizione dieci moli di Fe?
A) 20
B) 5
C) 30
D) 15
soluzione
dalla formula si evince che in 1 mole di Fe2O3 vi sono 2 moli di ferro quindi da 10 moli di Fe possiamo ottenere 5 moli di Fe2O3.
57. Quale delle seguenti è la configurazione elettronica di un gas nobile
A) 1s22s1
B) 1S2 2S2 2p5
C) Is2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
D) 1s2 2s2 2p6 3s2 3p6 4s2 3d10
soluzione
il gas nobile deve avere nella struttura più esterna tutti gli orbitali accoppiati, quindi è evidente che il gas nobile è quello che possiede 10 elettroni nei 5 orbitali d. (risposta D)
58. A 20,0 mL di una soluzione 0.03 M di Cd+2 vengono aggiunti 98,4 mg di Na3P04 (s). Quanti grammi di fosfato di cadmio precipitano?
A) 0,316 g
B) 0,105 g
D) 0,125
soluzione
la quantità di Cadmio utilizzata è 20 x 0,03 = 0,6 millimoli cioè 0,06744 mg
Cd3(PO4)2 : 3 Cd = X : 0,06744 526 : 337,4 = x : 0,06744 X= 0,105 g
59. L’anidride ftalica (CgH403) viene prodotta industrialmente dall’ossidazione controllata del naftalene (C10H8) secondo la reazione:
2 C10H8 + 9 O2 → 2 C8H4O3 + 4 CO2 + 4 H2O
Se da 1,0 kg dì naftalene si ottengono 808 g di anidride ftalica, qual è la resa percentuale della reazione?
A) 80,8%
B) 70,1%
C) 100%
D) 0,81%
soluzione
1000 g/ 128=7,81 moli di naftalene e 808/ 148 =5,46 moli di anidride
7,81:5,46 =100: X X= 70 %
60. Quando avviene la reazione spontanea: 4 P+ 3 KOH + 3H2O → 3 KH2PO4 + PH3
A) solo il fosforo si è ridotto
B) solo il fosforo è ossidato
C) ii fosforo non si è né ossidato né ridotto
D) il fosforo si è ossidato e ridotto
soluzione
si tratta di una reazione di dismutazione in cui una parte del P si ossida a fosfato n.o.+5 ed un’altra si riduce a PH3 dove il fosforo ha n.o. -3. La reazione è la seguente:
3 [ P +8OH- → PO4-3 +5 e +4H2O
5 [ P +3H2O + 3 e → PH3 + 3OH-
_______________________________________
8P (2P4) + 24OH- + 15 H2O → 3 PO4-3 + 5PH3 + 12H2O + 15OH-
e semplificando si ha
2P4 +3H2O +9OH- → 3PO4-3 + 5PH3
Qui riprendono gli ultimi 20 quesiti della classe B
41 In un reattore chiuso di 5,00 L sono contenute 1,40 mol di pentano e 3,50 mol di 2-metilbutano in equilibrio a 310 K secondo la reazione
pentano (l) <==> 2-metilbutano (I)
Se in questo sistema si aggiungono 1,00 moli di pentano, quale sarà la concentrazione di pentano nella nuova condizione di equilibrio?
A) 0,15 M
B) 0,88 M
C) 0,34 M
D) 0,79 Mb
soluzione
l’ equilibrio del sistema è dato dalla Keq = 2-metilbutano/pentano
quindi [2-metilbutano] = 3,5 moli/5 = 0,7 moli/l e [ pentano]= 1,4/5 = 0,28 moli/l
Keq= 0,7 / 0,28 = 2,5 se aggiungiamo 1 mole di pentano l’equilibrio si sposta verso destra
la nuova concentrazione di pentano è 1+1,4/5 = 0,48 M
pertanto, la nuova situazione è la seguente:
moli iniziali di pentano = 0,48
moli iniziali di 2 metilpentano = 0,7
moli di 2 metilpentano formate dopo l’aggiunta = X
moli all’equilibrio : pentano = 0,48 – X 2metilpentano = 0,7 + X
e conoscendo Keq si può calcolare X 0,7+X / 0,48-X = 2,5 da cui 0,7+X =2,5 (0,48-X) = 1,2 -2,5 X
1,2-0,7 = 2,5X+X = 3,5 X pertanto X = 1,2-0,7/3,5 =0,5/3,5 X= 0,142
pertanto dopo aggiunta di 1 mole all’equilibrio avremo
0,48- 0,142 = 0,337 = 0,34 moli di pentano /litro
risposta corretta C
42. Il grado di dissociazione di un acido debole HA in una sua soluzione è 20%. Di quante volte bisogna aumentare il volume di tale soluzione, diluendo con H2O, perchè il grado di dissociazione diventi 50%?
A) 2 volte
B) 4 volte
C) 10 volte
D) 3,5 volte
soluzione
HA <==> H+ + A-
1-α α α
Keq= α2/1-α = 0,04 /0,8 = 0,05 dovendo calcolare il volume quando α =0,50 allora
Keq=(0,5/V)² / 1-0,5 /V cioè 0,05 =(0,25/V²) /1- 0,5/V 0,25/V = 0,05 (1-0,5)
V= 0,25/ 0,05 – 0,025 = 0,25/0,025 = 10
occorre diluire 10 volte con acqua per avere un grado di dissociazione che cambi da 20% al 50%
43. Un campione di minerale costituito da Au (s) e da SiO2 (s) ha un volume V = 38,0 mL e densità = 9,80 g/ ml. Calcolare la massa di Au (s) nel campione, sapendo che la densità dell’oro è 19,32 g/ml, e quella della silice è 2,20 g/ml..
A) 330 g
B) 318 g
C) 341 g
D) 326 g
soluzione
i grammi di oro sono forniti dal prodotto densità x volume = d x Voro
i grammi di SiO2 d x Vsil
se i volumi sono additivi, allora possiamo scrivere Vcamp = Voro + Vsil
peso del campione = peso oro + peso silice
d x Vcamp = d x Voro + d x Vsil
poichè Vcamp= Voro+ Vsil
Vsil=Vcamp – Voro
pertanto possiamo scrivere:
d x Vcamp = d x Voro+ d xVsil = d x Voro+ d x Vcamp -Voro
possiamo quindi calcolare il Voro
9,8 x 38 = 19,32 x Voro + 2,2 x (38 – Voro)
da cui Voro = 9,8 x 38- 2,2 38/ 19,32 – 2,2 = 16,87 ml
noto il volume dell’oro possiamo calcolare i grammi di oro:
grammi oro= densità oro x Voro
grammi oro = 19,32 x 16,87 = 325,9 g = 326 g
risposta corretta D
44. Una bombola contenente 8,0 m³ di una miscela gassosa misurati a 303 K contiene He e N2 alla pressione complessiva di 85,0 x 105 Pa. Calcolare la %( V/V) di He nella miscela sapendo che nella bombola sono presenti 87,0 kg di N2.
A) 88,5%
B) 45,3%
C) 65,9%
D) 77,8%
soluzione
per ottenere % (V/V) dobbiamo calcolare il volume a cui corrispondono 87Kg di N2 e poi per differenza calcoliamo % di He. 87Kg corrispondono a 87000 g pertanto
PV=nRT V = nRT/P = ( 87000/28) x 8,314 x303 / 85,0x 105
= 2,19 x 108 / 85,0x 105 = 0920 m³ quindi la % in volume di N2 è 8,0 : 0920 =100 :X X= 11,5%
pertanto la % in volume di He = 100-11,5= 88,5
45. Una soluzione acquosa dì 0,5 L, che contiene 2 moli di un acido debole HA ed l mole di NaOH, ha pH 5,4. Calcolare la costante acida di HA.
A) 7,3 x10-5
B) 8, 1x 10-7
C) 4,0x 10-6
D) 2,9x 10-4
soluzione
siamo in presenza di un acido debole ed una base forte (soluzione tampone) pertanto sappiamo che [H+]= Ka Ca/Cs
essendo l’acido e la base discioti nello stesso volume di solvente si può sostituire alle concentrazioni il numero di moli cioè na ed nb pertanto [H+] = Ka na/nb
sappiamo che na =2 moli ma dopo l’aggiunta di 1 mole di base si ha na = 1 ed nb=1 pertanto [H+]=Ka
essendo PH =5,4 allora [H+] = 10-5,4 da cui [H+] = 3,99 x 10-6 pertanto Ka = 3,99 x 10-6
46. Per preparare una soluzione al 23,0% (m/m) di KF avendo a disposizione 90,0 g di una soluzione al 18,0% (m/m) dello stesso sale, quanti grammi di KF (s) occorre aggiungere?
A) 5,84g
B) 8,43g
C) 7,S5g
D) 3,22g
soluzione
sappiamo che %(m/m) = ( massa di soluto / massa di soluto + massa di solvente ) x 100
essendo la massa della soluzione pari a 90 g quindi la massa di soluto è data da 90 x 0,18 = 16,2 g
per conoscere quanti grammi occorre aggiungere a 16,2 g di soluto per avere una soluzione al 23 %(m/m)
si ricorre al calcolo seguente 16,2 + x/ 90 +x = =0,23
da cui 0,23 x (90+x) = 16,2 +x 20,7 +0,23X = 16,2 + X da cui 0,77 X = 20.7- 16,2 X= 4,5/ 0,77 = 5,84
47. Un minerale contiene il 95,0% (m/m) di HgO. Se 40,0 g di tale minerale sono decomposti secondo la reazione da bilanciare: HgO (s) –+ Hg+ O2 (g) si ottengono 0,0714 moli di O2• Calcolare la resa percentuale della reazione.
A) 81,4%
B) 92,3%
C) 78,6%
D) 88,1%
soluzione
la quantità di HgO iniziale è 40 x 0,95 = 38 g da cui si ottengono 0,0714 x 32 = 2,28 g di O2
dalla reazione 2HgO → 2Hg +O2 si evince che si dovrebbero ottenere 2 HgO :O2 = 38 : X X = 38 x 32 /( 2 x 216,6 ) = 2,8 g di O2
pertanto essendo la resa di una reazione (quantità sperimentale / quantità teorica) x 100 si ha (2,28 /2,8 ) x 100 = 81,4 %
48. introducendo 173 g di un composto non volatile in 2,00 kg di acqua si ottiene una soluzione ideale che ha una tensione di vapore pari a 3,09 kPa a 25 cc. Qual è la massa molare del composto? La tensione di vapore dell’acqua a 25°C è 3,17 kPE.
A) 40 g mol-l
B) 50 g mol “
C) 60 g mol “
D) 45 g mol-1
soluzione
sappiamo che la frazione molare di un soluto in una soluzione è
X = Tvap solvente- Tvap soluzione / Tvap solvente perciò
X = 3,17 – 3,09/ 3,17 = 0,025 (frazione molare del soluto) a sua volta la fraz. molare è data da
Fraz. mol.= moli soluto/ moli soluto + moli solvente quindi se indichiamo con X le moli del soluto avremo
0,025 = X / 2000/18 + X da cui 0,025 x (111,11 + X) =X 2,78 + 0,025 X = X 2,77= 0,975 X X = 2,87 moli di soluto . La massa molare o peso molecolare si ottiene ricordando che 2,87= 173 /PM quindi PM = 60,2 g
49. Riducendo il volume di un sistema gassoso ideale, mantenendo la pressione fissa a 101,3 kPa, il sistema cede 20 kJ all’ ambiente. Di quanto deve diminuire il volume se si vuole che la temperatura del sistema non cambi?
A) 1970 cm³
B) 197 dm³
C) 197 m³
D) 19,7 dm³
soluzione
a p=K E= P ΔV ed essendo la quantità di calore q = E = 2000 J, se la temperatura deve rimanere costante, anche l’energia interna deve rimanere costante quindi sarà sempre 2000 j. la variazione di volume può essere calcolata da
Q = p (V2-V1) = P ΔV da cui ΔV = Q/ P ΔV = 20000/101300 = 0,197 m³ cioè 197 dm³ = 197 litri
(ricorda che quando il calore è espresso i Jaule il volume è espresso in m³ e la P in Pascal)
50. Sì consideri la reazione In cui l’ozono spontaneamente forma ossigeno molecolare. Indicando con X la velocità con cui si consuma l’ozono, quale sarà ia velocità con cui sì forma l’ossigeno molecolare?
A) 1/2 x
B) x
C) 2 x
D) 3/2 x
soluzione
2 O3 → 3O2 da questa reazione si evince che se X è la velocità con cui si consuma l’ozono, la velocità di reazione
3O2→ 2O3 deve essere i 3/2 della prima.
51 – si consideri la reazione:
2 SO2 (g) + O2 (g ) -> 2 SO3 (g)
per la quale il ΔH è negativo. Come è possibile spostare l’equilibrio verso la formazione dei prodotti?
A) non si può influire sull’equilibrio termodinamico di una reazione
B) aggiungendo SO3
C) diminuendo la temperatura e/o aumentando la pressione
D) aggiungendo un catalizzatore
soluzione
trattandosi di una reazione esotermica possiamo influire sulla formazione dei prodotti diminuendo la temperatura ed aumentando la pressione
52. La costante cinetica per una data reazione del primo ordine è 5 .10-3 S-1 a 10°C, mentre il suo valore è 7,2 x 10-3 a 20°C. L’energia di attivazione della reazione vale:
A) 25 kJ/mol
B) 250 kJ/mol
C) 2500 j/mol
D)250 J/mol
soluzione
l’equazione di Arrhenius ci permette di valutare l’energia di attivazione noti i valori delle costanti cinetiche a differenti temperature.
K = A e-Ea/RT in forma logaritmica si ha: ln K = ln A – Ea/RT
a due diverse temperature T1 e T2 con costanti di velocità K1 e K2 si ha :
ln K1= ln A – Ea/RT1
ln K2= ln A – Ea/RT2
sottraiamo la seconda equazione dalla prima abbiamo
ln K1 – ln K2= – Ea/RT1 + Ea/RT2 = Ea/R ( 1/T2 – 1 /T1) ln K1/K2= Ea/R ( 1 /T2 – 1/T1)
in queste equazioni
K è la costante specifica della reazione;
A la costante caratteristica della reazione ( fattore di frequenza);
Ea l’energia di attivazione;
R costante universale dei gas; =8314 J
T temperatura assoluta.
pertanto Ea= ln 7,2 x 10-3 / 5 x 10-3 x 8314 (1/283- 1/293) = ln 1,44 x 8314 /( 3,53x 10-3 – 3,41 x 10-3 )
Ea= ln1,44 x 8314 /0,12= 0,36 x8314 /0,12 =24,9 KJ/mol
53. Il paracetamolo viene preparato per reazione del p-amminofenolo con anidride acetica. Perché l’acetilazione avviene preferenzialmente sul gruppo NH2 rispetto a quello OH?
A) per ragioni di mgombro sterico
B) per la maggior eietrrofilicità del gruppo amminico
C) per la maggior nucieofilicità del gruppo amminico
D) dipende dall’anidride scelta
soluzione
il meccanismo di reazione è descritto sotto:

il p-aminofenolo possiede l’azoto con un doppietto elettronico disponibile ed essendo il gruppo NH2 un elettronattrattore sposta ancor più la densità di carica sull’ azoto. Questa densità di carica attira la carica positiva del C dell’anidride acetica in cui il doppio legame del CO si apre dando origine al C+ e O-.Una volta legato all’azoto, l’ossigeno del C riforma il doppio legame CO premettendo al resto dell’anidride di staccarsi sotto forma di CH3COO- che a sua volta attrae e stacca un atomo di H dall’azoto per formare CH3COOH ed il paracetamolo. Da quanto sopra, è evidente che la reazione avviene sull’azoto perché è molto nucleofilo.
54. La basicità delle alchilammine aumenta, in fase gassosa, passando dalle ammine primarie alle terziarie, H2R < NHR2 < NR3, a causa dell’effetto elettrondonatore dei gruppi alchilici. In soluzione acquosa, invece, le ammine terziarie risultano essere meno basiche delle ammine primarie. Indicare la spiegazione più corretta:
A) in soluzione si verifica un’inversione dell’effetto induttivo dei gruppi alchilici, che diventano elettronattrattori
B) in soluzione i tre gruppi alchilici legati all’atomo di azoto interferiscono con la solvatazìone del catione trialchilammonio che, quindi, è meno stabilizzato
C) in soluzione si osserva una modifica di” ibridazione dell’ atomo di azoto da SP3 a SP2
D) in soluzione le ammine terziarie son0 facilmente ossidabili, generando specie poco basiche
soluzione
in fase gassosa l’ordine di basicità è 3′ > 2′ > 1′> NH3 a causa dell’effetto induttivo dei gruppi alchilici elettrondonatori che destabilizzano il doppietto solitario dell’azoto rendendo quest’ultimo più basico. In soluzione acquosa invece l’ordine di basicità è 2′> 1′> 3′ > NH3. Infatti in soluzione acquosa il protone dell’acqua si lega all’azoto formando uno ione ammonio quaternario
NH3 + H2O → NH4+ + OH-
CH3-NH2 + H2O → CH3-NH3+ +OH-
(CH3)2-NH + H2O → (CH3)2NH2+ + OH-
(CH3)3-N + H2O → (CH3)3-N+ + OH-
tutti gli ioni positivi formati hanno caratteristiche acide infatti possono cedere il Protone ad una molecola di acqua
ad es NH4+ + H2O → NH3 + H3O+ ed il suo PKa =9,26
CH3-NH3+ + H2O → CH3-NH2 + H3O+ PKa= 10,66
(CH3)2NH+ + H2O → (CH3)2N + H3O+ PKa= 10,73
(CH3)3-N+ + H2O → (CH3)3-N + H3O+ PKa = 9,81
dai dati del PKa notiamo che l’ammoniaca è la base più debole. Tutte le ammine sono più basiche dell’ammoniaca ma le primarie e le secondarie sono più basiche in quanto il solvente stabilizza lo ione ammonio. Nelle ammine terziarie il terzo gruppo alchilico inibisce stericamente la solvatazione e diminuisce l’ abilità del solvente di stabilizzare il corrispondente ione ammonio causando una tendenza inversa del gruppo alchilico che normalmente tende a diminuire l’acidità ed aumentare la basicità.
55. Il primo metodo per l’arricchimento dell’uranio prevedeva l’utilizzo della diffusione di Uf 6 gassoso. Utilizzando questa tecnica, viene sfruttata la differenza di velocità tra gli isotopi: in particolare si riesce a separare 235 dal più pesante isotopo 238. Qual è il rapporto tra la velocità del gas contenente l’isotopo 235 e quella del gas contenente l’isotopo 238 ?
A) 1,004
B) 0,996
C) 1,025
D) 0,976
soluzione
In genere, il minerale costituito dagli isotopi 238 e 235 dell’Uranio contiene solo una quantità intorno a 0,7% di isotopo 235U, e la maggior parte è invece costituita dall’ isotopo 238 U. Il processo di separazione e quindi di arricchimento dipende dall’utilizzazione cui è destinato. Nelle centrali nucleari l’isotopo 235 deve essere intorno al 3-5% anche se qualche centrale utilizza uranio non arricchito. Per le bombe atomiche l’uranio 235 deve essere circa il 90% .Nel primo dei metodi di separazione dei due isotopi adoperato, e per il suo arricchimento in uranio 235, il minerale viene fatto reagire con Fluoro per formare esafloruro di uranio di ambedue gli isotopi (UF6) che viene fatto diffondere attraverso una membrana e la quantità di isotopo 235 viene arricchita con numerosi passaggi attraverso la membrana. Una volta arricchito di U235 il gas viene conservato in forma liquida in contenitori dove vien fatto raffreddare e solidificare ed in tal modo si traforma nel vero e proprio combustibile nucleare sotto forma di palline. La velocità di diffusione di un gas è regolata dalla legge di Graham :
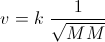 per una miscela di due gas come nel caso dei fluoruri dell’uranio il rapporto tra le velocità di diffusione è :
per una miscela di due gas come nel caso dei fluoruri dell’uranio il rapporto tra le velocità di diffusione è :
V1/V2 = √M2/M1 quindi V1/V2 =√ 238/235 = 1,006 ciò significa che le molecole di isotopo 235 viaggiano 1,006 volte più veloci dell’ isotopo 238.
56. L’effetto fotoelettrico è un fenomeno fisico che prevede l’espulsione di elettroni da una superficie, tendenzialmente metallica, in seguito a irraggiamento con onde elettromagnetiche. La spiegazione di questo fenomeno è storicamente importante dal momento eh rappresenta la conferma:
A) della natura ondulatori” dell’elettrone
B) della natura quantistica dell’atomo
C) della natura corpuscolare della radiazione
D) della natura ondulatoria della radiazione
soluzione
la fisica classica attribuiva alla radiazione luminosa (elettromagnetica) un comportamento esclusivamente ondulatorio e si sapeva inoltre che la luce era in grado di far emettere elettroni ad una superficie metallica, producendo una debole corrente (effetto fotoelettrico). La teoria ondulatoria classica prevedeva però che, all’aumentare dell’intensità della luce incidente, aumentasse anche l’energia degli elettroni emessi. Nel 1902, il fisico tedesco Philipp Lenard mostrò invece che l’energia posseduta dai fotoelettroni non dipendeva dall’intensità della radiazione, ma unicamente dalla frequenza (dalla lunghezza d’onda) della radiazione incidente. L’intensità della radiazione, al contrario, determinava l’intensità della corrente, ovvero il numero di elettroni strappati alla superficie metallica. Il risultato sperimentale era inspiegabile ammettendo che la natura della luce fosse unicamente ondulatoria. Nel 1905 Albert Einstein spiegò l’effetto fotoelettrico con l’ipotesi che i raggi luminosi trasportassero particelle, chiamate fotoni, la cui energia è direttamente proporzionale alla frequenza dell’onda corrispondente E= hν dove h è la costante di plank, v è la frequenza della radiazione associata al fotone ed E è l’energia. Quando i fotoni colpiscono la superficie del metallo cedono parte della propria energia agli elettroni liberi del metallo e ne provocano l’emissione quindi l’energia dell’elettrone emesso dall’energia del fotone, mentre l’intensità della radiazione incidente influisce sul numero di elettroni che vengono emessi non sulla loro energia.La risposta corretta è la C
57. Quale dei seguenti metalli presenta una configurazione elettronica con l’orbitale d completo?
A) Fe
B) Cu
C) Ni
D) Co
soluzione

dalla distribuzione elettronica di questi elementi di transizione, si evince che solo il rame ha i 5 orbitali d occupati da 10 elettroni.
58. Un’onda elettromagnetica con lunghezza d’onda di 242 nm è in grado di dissociare l’ossigeno molecolare rompendo il legame covalente. Calcolare l’energia di dissociazione molare di O2
(h =6,63 x 10-34 J/s c=3 x 108 m/s)
A) 495 kJ/mol
B) 8x 10-19 J
C) 8x 10-19 J/mol
D) 257 kJ/mol
soluzione
E=hc/λ trasformiamo c ed h nelle unità di misura opportune
c= (3x 108 m/s) (1,0 x109 nm/m ) = 3,0 x 1017 nm/s
h = 6.63 x 10-34 Js cioè h = 6.63 x 1-37 kJs
poiché abbiamo una molecola di O2 si ha :
E = (hc/ mole)(6.02 x 1023 molecole/mole)
mole)(6.02 x 1023 molecole/mole)
E = (6.63 x 10-37 kJ s)(3.0 x 1017 nm/s)(6.02 x 1023 mol-1)/ 
da cui si ottiene
E= 1,2 x 105 kj nm/ mol / 
E= 1,2 x 105 /242 nm =495,86 kJ
59. Quante moli di Ca(OH)2 bisogna aggiungere a 250,0 mL di una soluzione acquosa di HCl 0,010 M per ottenere una soluzione a pH = 3, se il volume della soluzione, dopo l’aggiunta dell’idrossido, non cambia?
A) 1,13 mmol
B) 2,25 mmol
C) o,23 mmol
D) 4,50 mmoì
soluzione
SITUAZIONE INIZIALE
la soluzione contiene [H+] = 0,01 moli in 1 litro (essendo 0,01 M) quindi in 250 ml vi sono 0,0025 moli cioè 2,5 millimoli .
SITUAZIONE FINALE
dovendo ottenere un PH =3 significa che la soluzione deve avere [H+] = 10-³ moli/l =o,001 moli /litro
noi abbiamo però 250 ml di soluzione quindi per avere un PH=3 in 250ml vi devono essere 0,00025 moli cioè 0,25millimoli
poiché inizialmente abbiamo 250 ml di soluzione di HCl contenenti 2,5 mmoli di H+ affinché alla fine si abbiano 0,25 mmoli di acido corrispondenti a PH=3, dei 2,5 millimoli di acido dobbiamo neutralizzare 2,5- 0,25 = 2,25 mmoli di acido iniziale che sono equivalenti a 2,25 /2 equivalenti di Ca(OH)2.
Occorrono quindi 2,25/2 = 1,125 mmoli di Ca(OH)2 in modo che rimangano 0,25 mmoli di acido in 250 ml di soluzione per avere una concentrazione finale di [H+] = 0,001moli/litro.
60. Quale delle seguenti sostanze ha il punto di ebollizione più elevato?
A) F2
By Cl2
Cì Br2
D) I2
soluzione
sappiamo che il punto di ebollizione è la temperatura alla quale la tensione di vapore del liquido uguaglia la pressione ambiente. Per raggiungere la temperatura di ebollizione è necessario fornire calore che aumenta l’energia cinetica delle molecole ed allenta i legami intermolecolari. Poiché maggiore è la massa della molecola maggiore sarà l’energia da usare per indebolire i legami intermolecolari si evince che tra le molecole indicate nel quesito è lo iodio il più pesante e quindi è lo Iodio che ha un punto di ebollizione maggiore.
Lascia un commento