GIOCHI DELLA CHIMICA 2015 FASE REGIONALE CLASSI A E B
ESERCIZIO 1
QUANTI GRAMMI DI ACQUA OCCORRE AGGIUNGERE AD UNA SOLUZIONE DI KNO3 AL 53% PER OTTENERE 170,0 GRAMMI DI UNA SOLUZIONE DI KNO3 AL 15%
SOLUZIONE
Questo esercizio riguarda una diluizione di una soluzione con acqua.Applichiamo il sistema a croce ponendo in alto a sinistra la % più alta cioè 53 ed al centro quella che vogliamo ottenere cioè 15 mentre in basso a sinistra scriviamo 0% in quanto si tratta di acqua quale seconda soluzion
53 15
15
0 38
_____________________
totale 53
questo ci indica che per ottenere 53 grammi di soluzione al 15% occorre mescolare 38 parti di acqua e 15 di soluzione al 53%.
pertanto dubbiamo effettuare la proporzione :
se per ottenere 53 grammi devo usare 38 gr di acqua, per 170 ne dovrò usare X pertanto
53: 38 = 170:X X= 170×38 / 53 = 121,88 cioè 121,9
ESERCIZIO 2
L’ASPIRINA(ACIDO ACETILSALICILICO) POSSIEDE UN Ka =3,2 x 10– 4 .
Calcolare il rapporto [HA]/[A] nello stomaco (PH=2).
SOLUZIONE
Nello stomaco, essendo il PH = 2 significa che [H+] = 10-2 moli/l . Essendo l”acido salicilico un acido debole si può scrivere l’ espressione della costante di equilibrio
essendo HA === H+ + A- si ha Ka = [H+] [A-]/ [HA]
da cui [HA] Ka = [H+] [A-] ed [HA]/[A] = [H+]/ Ka e passando ai dati numerici
[HA]/[A] = 10-2/3,2 x 10-4 = 0,3125x 102 = 31,2
ESERCIZIO 3
IN CIMA DA UNA MONTAGNA LA TEMPERATURA E’ DI 10° CENTIGRADI E LA PRESSIONE 933,1x102
Pa . AI PIEDI DELLA MONTAGNA SI REGISTRA UNA TEMPERATURA DI 30° C ED UNA PRESSIONE DI 1013,1 x 102 Pa. Calcolare il rapporto tra la densità dell’aria alla cima ed alla base della montagna.
SOLUZIONE
Calcolare la densità significa calcolare il rapporto gr/Volume per cui sapendo che per un gas si ha
PV=n RT (dove n=grammi / PM, P = pressione e T la temperatura assoluta 273+C)
abbiamo, per la parte alta della montagna,
P1V1=g1/PM RT1 e per la base della montagna P2V2 = g2/PM RT2 da cui
P1 PM / RT1 = g1/V1 =D1 (densità nelle parte alta della montagna)
P2PM / RT2 = g2/v2=D2 (densità dell’aria nella parte bassa della montagna)
dividendo le due espressioni si ha:
P1/RT1/P2/RT2 = D1/D2
(933,1 x102/ 273+10) / (1013,1 x 102 x 273+ 30) =D1/D2 = 3,297 / 334 = 0,98
ESERCIZIO 3
A 20° LA SOLUBILITA’IN ACQUA DEL NITRATO DI SODIO è 88% (m/m) MENTRE A 0° è 8,7 M.
RAFFREDDANDO A 0° 75,0 ml DI UNA SOLUZIONE SATURA A 20° QUANTI GRAMMI DI SOLIDO PRECIPITANO?( SI CONSIDERI LA DENSITA’ DELLA SOLUZIONE PARI A 1,00 g/ml).
SOLUZIONE
A 20°C S = 88% cioè in 75 ml sono sciolti 75 x 0,88 = 66 grammi
a 0° C S = 8,7Molare cioè in 1 litro si sciolgono 8,7 x 85 = 739,5 grammi quindi in 75 ml si ha 75 x 0,739,5= 55,46 grammi
Si deduce che precipitano 66 – 55,46= 10,6 grammi
ESERCIZIO 6
MESCOLANDO 50 GRAMMI DI UNA SOLUZIONE AL 3 %(m/m) CON 121 GRAMMI DI UNA SOLUZIONE AL 19% ENTRAMBE DI FRUTTOSIO, DETERMINARE LA CONCENTRAZIONE DELLA SOLUZIONE RISULTANTE.
SOLUZIONE
50 g di soluzione al 3 % corrispondono a 0,03 x 50 = 1,5 g
121 g di soluzione al 19% corrispondono a 0,19 x 121 = 23 g
in totale nella soluzione che otteniamo vi sono 23+1,5 g = 24,5 g
essi derivano da 50 + 121 g = 171 g quindi
se in 171 ve ne sono 24,5, in 100 ve ne saranno x
171:24,5 = 100;x da cui X= 2450/171 = 14,3 %
ESERCIZIO 7
Determinare quanti grammi di alcool etilico sono contenuti in 30,0 ml di una grappa al 38%(v/v). La densità dell’alcool etilico è 0,789 Kg/dm³.
SOLUZIONE
se in 100ml ve ne sono 38ml in 30,0 ml ve ne saranno x x= 30×38/100 = 11,4 ml
Essendo la densità 0,789 Kg /1000 litri (1 metro cubo =1000 litri) allora sarà 789 g /1000 litri pertanto
d= 0, 789g/l
pertamto se in 1000ml vi sono 0,789 g in 11,4 ml ve ne saranno x
quindi la quantità di alcool è 11,4 x 0,789 =9,0 grammi
ESERCIZIO 8
UNA BOMBOLA CONTENENTE 40 LITRI DI CO MISURATI ALLA PRESSIONE DI 60,78 x 105 Pa ED ALLA TEMPERATURA DI 20°C VIENE SVUOTATA IN UN LOCALE DI DIMENSIONI 10,0m x 6,0m x 3,0 m. CALCOLARE LA CONCENTRAZIONE DI CO NELLA STANZA IN g/m³.
SOLUZIONE
Dall’equazione generale di stato dei gas PV = n RT si calcolano le moli di CO . R è espresso in J/mK
n= PV/RT n= 60,78 x 105 x 40 / 8,31 x (273+20) n= 2431,2/ 2434,8 = 0,998 moli di CO
0,998 moli di CO corrispondono a 0,998 x PM = 0,998 x 28 = 27,94 g
questa quantità viene liberata in un volume pari a 1,8 m³ per cui
se in 1,8 m³ vi sono 27,94 g in 1 m³ ve ne saranno x
x= 27,94 /1,8 = 15,5
ESERCIZIO 9
UNA LEGA VIENE PREPARATA FONDENDO 10,6 Kg DI Bi 6,4 Kg DI Pb 3 Kg DI Sn.
QUANTI GRAMMI DI BI OCCORRONO PER PREPARARE 70 g DI LEGA ?
SOLUZIONE
La quantità totale è 10,6 + 6,4 + 3 kg = 20 Kg
la % di Bi contenuta nella lega è 20Kg : 10,6Kg =100 Kg : X X= 1060/20 = 53 %
pertanto 100: 53 =70 😡 X= 37,1 %
ESERCIZIO 10
LA CONCENTRAZIONE DI EMOGLOBINA NEL SANGUE E’ 0,00250 M. CONSIDERANDO CHE OGNI MOLECOLA DI EMOGLOBINA, SATURA DI OSSIGENO, TRASPORTA 4 MOLECOLE DI OSSIGENO. CALCOLARE QUANTE MOLI/LITRO DI OSSIGENO SONO TRASPORTATE NEL SANGUE ASSUMENDO UNA % DI SATURAZIONE DI 75,0%
SOLUZIONE
Le moli di ossigeno trasportate da 0,00250 moli di emoglobina sono
1 mole trasporta 4 moli allora 0,00250 ne trasportano X
X = 0,00250 x 4 =1 = 0,01 moli
essendo la saturazione massima del 75% allora la quantità trasportata è
100 : 75 = 0,01 😡
X=75 x 0,01 /100 =0,0075
ESERCIZIO 11
CALCOLARE LA MASSA MOLARE DI UN GAS, LA CUI DENSITA’ MISURATA A t= 273,15 KELVIN ED ALLA PRESSIONE DI 1,01 x 105 Pa è d = 1,75 g/L
SOLUZIONE
Dall’equazione di stato dei gas sappiamo che
PV =n RT dove
n = g /PM V= 1000 ml T= 273,15 R =8,31 pertanto
PM = (g/1000) 8,31 x 273,15/ 1,01 x 105
PM = 1,75 x 8,31 x 273,15 / 1,01 x 105
PM = 39,2 g/mole
ESERCIZIO 12
QUANTI GRAMMI DI OSSIGENO SI OTTENGONO DECOMPONENDO IN MODO QUANTITATIVO 90 g DI GLUCOSIO ( C6H12O6 ).
SOLUZIONE
Poichè la molecola di glucosio( PM = 180,15 g) contiene 6 atomi di ossigeno ( 96 g) è chiaro che da 180,15 g di glucosio si otterranno 96 g di ossigeno , pertanto da 90 g se ne otterranno X
180,15 : 96 = 90 : X X= 90 x 96 / 180,15 = 47,96
ESERCIZIO 13
MESCOLANDO IN AMBIENTE BASICO UNA SOLUZIONE ACQUOSA DI PERMANGANATO CON UNA DI SOLFURO SI OTTIENE ZOLFO SECONDO LA REAZIONE (DA BILANCIARE)
MnO4– + S-2 +H2O→ MnO2 + + S8 + OH– CALCOLARE QUANTI GRAMMI DI ZOLFO SI OTTENGONO FACENDO REAGIRE 15,00 ml DI UNA SOLUZIONE ACQUOSA DI KMnO4 0,1 M CON UNA SOLUZIONE ACQUOSA CONTENENTE ABBASTANZA SOLFURO DA FAR REAGIRE TUTTO IL PERMANGANATO.
SOLUZIONE
BILANCIAMO LA REAZIONE
+7 +4
16 [MnO4– +3e + 4 OH- → MnO2 + 2H2O
3 [8S-2 → S°8 + 16 e
_____________________________________________________________
16 MnO4– + 24 S-2 + 64 OH- → 16 MnO2 + 3 S8 +32 H2O
da questa reazione si deduce che da 16 moli di permanganato si ottengono 24 atomi di zolfo.
La quantità di permanganato iniziale è 15 ml x o,1 = 1,5 millimoli ( 0,0015 moli ) quindi
0,0015 x 158 =0,237 g pertanto se da (16 x 158 )g di permanganato si ottengono (24 x 32)g di Zolfo, da 0,237 g se ne otterranno X
X= 768 x 0,237/ 2528 = 0,072
ESERCIZIO 14
IL COMPOSTO Pb(N3)2 SI UTILIZZA PER GONFIARE GLI AIRBAG. lA REAZIONE CHE AVVIENE E’: Pb(N3)2 → Pb + 3N2
SE IL CUSCINO HA UN VOLUME V = 35,00 LITRI QUANTI GRAMMI DI Pb(N3)2 SONO NECESSARI PER OTTENERE UNA PRESSIONE DI 2,026 X 10² Pa A 20°C ?
SOLUZIONE
Dall’equazione generale di stato dei gas si ha
PV =n RT dove
n = g /PM V= 35,00 l T= 293 R =8,31 P= 2,026 X 10²
quindi (2,026 x 10² x 35,00) = n x (8,31 x 293)
n = (2,026 x 10² x 35,00) / (8,31 x 293) =7091000 / 2434,8= 2,912 moli
291:3 = X :2,912
X = 291×2,912/3 =282,46 g
ESERCIZIO 15
UN’ARGILLA CONTIENE IL 45 % IN MASSA DI SiO2 ED IL 10% DI H2O.CALCOLARE LA % DI SiO2 NELLA MASSA SECCA.
SOLUZIONE
se si elimina il 10% di H2O rimane il 90% quindi in 90 vi sono 45 di SiO2 perciò in 100 ve ne sono x
X= 45 x 100/90 = 4500/90 X=50%
ESERCIZIO 16
UN’INDUSTRIA SCARICA IN UN FIUME LE ACQUE DI LAVAGGIO CON UNA CONCENTRAZIONE IN FOSFORO DI 10 mg/L . SE IL FOSFORO E’ SOLO COME FOSFATO CALCOLARE LA CONCENTRAZIONE DI PO4-3 IN mg/l.
SOLUZIONE
PO4-3 : P = x :0,001 g
94,9 : 30,9 = x: 0,010
X= 0,0307 g/l X= 30,7 mg/l
ESERCIZIO 17
UNA MOLE DI H2O ED UNA MOLE DI NH3 HANNO LO STESSO NUMERO DI MOLECOLE?
SOLUZIONE
Sì! PERCHE’ IN UNA MOLE DI QUALSIASI SOSTANZA SONO CONTENUTE SEMPRE 6,02X 10 ²³ MOLECOLE (NUMERO DI AVOGADRO).
ESERCIZIO 19
INDICARE QUALI TRA LE SEGUENTI TERNE DI NUMERI QUANTICI NON PUO’ DESCRIVERE LO STATO DI UN ELETTRONE
1 n=3 l=1 3m=0
2 n= 2 l=1 m=1
3 n= 1 l= 0 m= 0
4 n = 1 l=1 m= 0
SOLUZIONE
La N° 4 perchè l può assumere valori compresi tra o ed n-1 quindi per n=1 l può assumere solo il valore 0 e non 1
ESERCIZIO 20
INDICARE I VALORI POSSIBILI DEL NUMERO QUANTICO MAGNETICO m QUANDO l=2.
SOLUZIONE
PER L= 2 I VALORI DI m DEVONO ESSERE COMPRESI TRA +2 E -2 COMPRESO LO ZERO PERCIO’
per l=2
m= +2, +1, 0, -1, -2
ESERCIZIO N. 26
ZOLFO ED ARSENICO FORMANO UN COMPOSTO BINARIO COSTITUITO DAL 51,7 % IN MASSA DI ZOLFO. INDICARE LA FORMULA.
SOLUZIONE
% DI S = 51,7 % As = 100-51,7= 48,3
51,7/ 32 =1,6 MOLI ZOLFO 48,3 /75= 0,64
0,64/0,64=1 As
1,6/ 0,64 =2,5 S PERTANTO LA FORMULA E’ : As 2 S5
ESERCIZIO 27
TROVARE I COEFFICIENTI PER LA REAZIONE
Cu + Cr2O7-2 + H+ → Cu+2 + 2Cr+3 + H2O
SOLUZIONE
2 [Cr2O7-2 + 6 e +14 H+ → 2Cr+3 + 7H2O
6[Cu° → Cu+2 +2e
_________________________________
6 Cu +2 Cr2O7-2 +28 H+→ 6Cu+2 + 4Cr+3 + 14 H2O
e dividendo per 2
3Cu + Cr2O7-2 + 14H+ → 3Cu+2 + 2 Cr+3 + 7 H2O
ESAERCIZIO 29
ESTRAENDO IL CROMO DA UNA MISCELA COSTITUITA UNICAMENTE DA CrO e Cr2O3, si trova che il Cromo rappresenta il 71 % della massa della miscela.Calcolare la composizione percentuale della miscela.
SOLUZIONE
CHIAMIAMO CO X LA SOMMA DI CrO + Cr2O3 e CONSIDERIAMO LA PROPORZIONE
( CrO + Cr2O3 ) : 3Cr = 100 : 71
X= 155,98 X100 /71 = 219,9 g
219,9x 1/3=73,3
219,9 x 2/3 =146,6
219,9: 73,33=100:x x=33,3%CrO
219,9:146,6 = 100 😡 X= 66,7 % Cr2O3
ESERCIZIO 30
INDICARE LA QUANTITA’ STECHIOMETRICA DI O2 CHE REAGISCE CON 1,6 MOLI DI NH3 SECONDO LA REAZIONE
4NH3 + 5O2 → 4NO + 6 H2O
SOLUZIONE
4 MOLI: 5 MOLI= 1,6 :X X= 2 MOLI
ESERCIZIO 31
SE BCl3 ED NaH SI TRASFORMANO SECONDO LA REAZIONE
BCl3 + 4 NaH → NaBH4 + 3NaCl
IN PRESENZA DI UNA OPPORTUNA QUANTITA’ DI BCl3 E’ VALIDA L’AFFERMAZIONE
1 SE REAGISCONO 2 g DI NaH SI OTTENGONO 1,5 GRAMMI DI NaCl
2 SE REAGISCONO 2 MOLI DI NaH SI OTTENGONO 1,5 MOLI DI NaCl
3 SE REAGISCONO 4 g DI NaH SI OTTENGONO 3 MOLI DI NaCl
4 SE REAGISCONO 4 moli DI NaH SI OTTENGONO 3 g DI NaCl
SOLUZIONE
dalla reazione si vede che da 4 MOLI di NaH si ottengono 3 MOLI di NaCl ed è ovvio che occorre ragionare in moli per cui la risposta esatta è la n.2 infatti
se da 4 moli di NaH si ottengono 3 moli di NaCl allora da 2 moli se ne ottengono 1,5 moli
ESERCIZIO 32
INDICARE QUALI SOLIDI CRISTALLINI SONO CAPACI DI CONDURRE LA CORRENTE ELETTRICA
METALLICI IONICI MOLECOLARI TUTTI E TRE
SOLUZIONE
OVVIAMENTE I SOLIDI METALLICI PERCHE’ GLI IONI CONDUCONO LA CORRENTE SOLO SE IN SOLUZIONE
ESERCIZIO 33
INDICARE IN QUALE MOLECOLA IL LEGAME COVALENTE E’ PIU’ POLARE
HF HBr HCl HI
SOLUZIONE
NATURALMENTE ESSENDO IL FLUORO L’ELEMENTO CON MAGGIORE ELETTRONEGATIVITA’ ATTIRA VERSO DI SE’ GLI ELETTRONI DEL LEGAME COVALENTE PIU’ DI TUTTI GLI ALTRI PER CUI è HF LA MOLECOLA PIU’ POLARE
ESECIZIO 34
IL BRONZO E’ UNALE GA DI RAME E STAGNO. INDICARE CHE TIPO DI LEGAME ESISTE TRA GLI ATOMI DEI DUE ELEMENTI.
1 IONICO 2 COVALENTE 3 METALLICO 4 A IDROGENO
SOLUZIONE
IL LEGAME E’ CERTAMENTE METALLICO ESSENDO I DUE ELEMENTI METALLICI
ESERCIZIO 35
LO IODIO E’ SOLUBILE I CCl4
1 perché entrambi i composti sono polari
2 perché entrambi sono apolari
3 perché il primo composto è polare il secondo no
4 non è vero che lo iodio è solubile in CCl4
SOLUZIONE
LA MOLECOLA DI IODIO E’ APOLARE COSI’ COME CCl4 PERTANTO SICCOME “SIMLES SIMILIA DISSOLVUNT” LA RISPOSTA ESATTA E’ LA N.2
ESERCIZIO 36
INDICARE QUALE TRA LE SEGUENTI MOLECOLE E’ LINEARE
H2O SO2 CO2 NH3
SOLUZIONE
L’acqua è TETRAEDRICA come NH3 mentre SO2 e’ planare ma con angolo diverso da 180°
la molecola lineare è CO2
esercizio 37
A TEMPERATURA E NUMERO DI MOLI COSTANTI, UN AUMENTO DI PRESSIONE DI UN GAS DETERMINA:
1 UN AUMENTO DELLA MASSA DEL SISTEMA
2 UNA DIMINUIZIONE DEL VOLUME
3 UN AUMENTO DEL VOLUME
NESSUNA DELLE PRECEDENTI RISPOSTE
SOLUZIONE
A P=K SAPPIAMO CHE P1K T1 E P2 = K T2 DA CUI P1/T1=P2/T2 PERTANTO SE LA PRESSIONE AUMENTA SI HA UNA DIMINUIZIONE DEL VOLUME (LEGGE DI BOYLE)
P =K/V (LA PRESSIONE E’ INVERSAMENTE PROPORZIONALE AL VOLUME)
ESERCIZIO 38
CALCOLARE LA QUANTITA’ DI CALORE CHE OCCORRE FORNIRE AD 1 MOLE DI H2O PER RISCALDARLA DA 25° C A 35°C TRASCURANDO LE DISPERSIONI DI CALORE E LA CAPACITA’ TERMICA DEL CONTENITORE. (CALORE SPECIFICO DI H2O = 4,184 J/K x grado)
SOLUZIONE
SAPPIAMO CHE Q = Massa x Calore specifico x differenza di temperatura
pertanto Q = 0,018 g x 4,184 x 10 = 0,753 kJ
Essendo il Calore specifico in J per Kg l’unita’ di misura della Massa M deve esse espressa in Kg quindi 1 mole di H2O è 18 g cioè 0,018Kg
ESERCIZIO 39
DIRE QUALE GEOMETRIA SPAZIALE POSSIEDE L’AMMONIACA NH3
SOLUZIONE
L’ ammoniaca ha una distribuzione spaziale tetraedrica (l’azoto è ibrido SP3) in cui una direzione è occupata da un orbitale contenente un doppietto elettronico libero e ciò comporta una diminuzione dell’angolo tetraedrico che da 109° come si osserva nel CH4 diviene 107° . Per lo stesso motivo l’H2O con i due doppietti che si respingono ha un angolo di 104°
ESERCIZIO 40
I GAS DI PETROLIO LIQUEFATTI (GPL) SONO COSTITUITI DA PROPANO E BUTANO TENUTI SOTTO PRESSIONE.ALLO STATO GASSOSO HANNO UNA DENSITA’ SUPERIORE A QUELLA DELL’ARIA. COSA AVVIENE SE I GPL SI DIFFONDONO NELL’ARIA?
SOLUZIONE
Il GPL allo stato gassoso ha una densità superiore a quella dell’aria e ciò gli impedisce di diffondersi nell’atmosfera; in caso di fuoriuscite accidentali tende a concentrarsi ristagnando al suolo e nelle cavità, causando situazioni di accumulo molto pericolose, a rischio di incendio. Per questo, in passato, agli autoveicoli con bombole di GPL era vietato (in Italia) il parcheggio sotterraneo o al chiuso (nelle navi, per esempio), e tuttora è in genere vietato il parcheggio su piani inferiori al primo interrato. La risposta esatta è la n. 1
ESERCIZIO 41
CALCOLARE LA MASSA MOLARE DELL’ACIDO H2A SAPENDO CHE 2,730 g REAGISCONO COMPLETAMENTE CON 135,0 ml DI UNA SOLUZIONE ACQUOSA DI NaOH 0,221 M SECONDO LA REAZIONE
H2A + 2 NaOH → Na2A + 2 H2O
SOLUZIONE
135,0 x 0,221 = 29,8 millimoli di NaOH
poiché dalla reazione si evince che 1 mole di acido reagisce con 2 moli di NaOH allora avranno reagito 29,8 /2 millimoli (14,9 mmoli)con 29,8 millimoli di NaOH
perciò sapendo che 0,0149 moli = g /PM allora 2,730 /PM = 0,0149
da cui PM = 2,730/0,0149 = 183,2
ESERCIZIO 42
UN MINERALEDI ZnS CONTIENE 42% DI Zn. CALCOLARE LA % DI ZnS NEL CAMPIONE
SOLUZIONE
ZnS : Zn = 100 : 42 x :65,38 = 100: 42
155,66 g ZnS da cui deriva il 42% dello Zn . Però il minerale contiene anche il 58 % di altro materiale diverso da Zns per cui il totale di minerale è costituito da 155,66 + 0,58 x 155,66 cioè 155,66+ 90,20= 245,9 g
per ottenere la % di ZnS nel campione
155,6 : 245,9 = x : 100 X= % ZnS =63,2
ESERCIZIO 43
CALCOLARE IL PH DI UNA SOLUZIONE ACQUOSA DI Ca(NO3)2 di concentrazione 0,05 M
SOLUZIONE
IN SOLUZIONE SI FORMANO
Ca(NO3)2 + 2H2O → Ca(OH)2 + 2HNO3
in pratica il sale deriva da un acido forte ed una base forte per cui il PH della soluzione deve essere neutro.PH=7
ESERCIZIO 44
DARE IL NOME AL COMPOSTO MgHPO4
soluzione
FOSFATO ACIDO DI MAGNESIO ( si legge da destra verso sinistra)
ESERCIZIO 45
INDICARE LE FORMULE CORRETTE DEI COMPOSTI IONICI CHE SI FORMANO QUANDO Al+³ SI LEGA AGLI IONI CLORURO,SOLFATO, FOSFATO.
SOLUZIONE
AlCl3 Al2(SO4)3 AlPO4
ESERCIZIO 46
DIRE SE H2S ED H2SO4 SONO ACIDI BINARI
SOLUZIONE
NO! H2S E’ACIDO BINARIO PERCHE’ FORMATO DA DUE ELEMENTI MENTRE H2SO4 E’ TERNARIO PERCHE’ FORMATO DA 3 ELEMENTI
ESERCIZIO 47
DIRE QUALE DI QUESTI CAMBIAMENTI NEL NUMERO DI OSSIDAZIONE E’ UNA RIDUZIONE
-4 A -2
-1 A 0
0 A -1
+2 A +3
SOLUZIONE
IL PASSAGGIO DA 0 A -1 INDICA UNA RIDUZIONE CIOE’ UN ACQUISTO DI 1 ELETTRONE
ESERCIZIO 49
COME VIENE DEFINITA L’ENERGIA NECESSARIA PER RIMUOVERE 1 ELETTRONE DA UN ATOMO NEUTRO IN FASE GASSOSA?
SOLUZIONE
ENERGIA DI PRIMA IONIZZAZIONE O ENERGIA DI IONIZZAZIONE
ESERCIZIO 50
COME SI RAPPRESENTANO GLI ATOMI NELLA TAVOLA PERIODICA?
SOLUZIONE
SECONDO IL NUMERO ATOMICO CRESCENTE
ESERCIZIO N.51
QUANTI SONO GLI ELETTRONI SPAIATI NELL’AZOTO?
SOLUZIONE
3 INFATTI LA STRUTTURA ATOMICA è 1S² 2S² 2Px¹ 2Py¹2Pz¹
ESERCIZIO 52
PER COSA DIFFERISCONO GLI ISOTOPI?
SOLUZIONE
PER IL NUMERO DI NEUTRONI
ESERCIZIO 53
QUALI DI QUESTI COMPOSTI E’ PIU’ SOLUBILE IN ACQUA?
AgCl, AgSCN, Ag2CrO4, Ag2S
SOLUZIONE
IL SOLFOCIANURO DI Ag. Infatti SCN è anche detto pseudoalogenuro ma ha anche una carica negativa sull’azoto e può anche unirsi ad un acido hard dalla parte dell’azoto e contemporaneamente ad un acido soft dalla parte dello zolfo.
ESERCIZIO 54
SE SI MESCOLANO VOLUMI UGUALI DI UNA SOLUZIONE ACQUOSA 0,02 M DI BaBr2 E DI UNA SOLUZIONE ACQUOSA 0,05 M DI AgF . QUALE COMPOSTO PRECIPITA?
AgBr BaF2 AgBr e BaF2 o non si forma alcun solido?
SOLUZIONE
Ag Br rimane in soluzione mentre precipita BaF2 composto meno solubile e con un Kps più piccolo
ESERCIZIO 55
UN ACIDO DEBOLE HX IN SOLUZIONE ACQUOSA REAGISCE CON NaOH SECONDO LA REAZIONE
HX + OH- → X¯ + H2O Keq = 10 9,5
Calcolare Ka dell’acido HX
SOLUZIONE
Ka = [X-] [H+] / [HX] da cui [X-]/[HX] = Ka/[H+]
dalla reazione si ottiene Keq = 10 9,5 = [X-]/ [HX] [OH-] cioè [X-]/[HX] = [OH-] x 10 9,5
pertanto Ka/[H+] = [OH-] x 10 9,5
Ka=[H+] [OH-] x 10 9,5
Ka= 10-14 x 10 9,5 = 10-4,5
ESERCIZIO 56
CALCOLARE LA [Ba+2] IN UNA SOLUZIONE SATURA DI Ba3(PO4)2 (kPS= 1,3 x 10-29)
TRASCURANDO TUTTI GLI ALTRI EQUILIBRI IN SOLUZIONE.
SOLUZIONE
Ba3 (PO4)2 ↔3 Ba+2 + 2 PO4-3
Il Kps = [Ba+2]³[ PO4-3]² = (3S)³ x (2S)² = 3³ + 2² x S³+² = 1,3 x 10-29
La concentrazione di Ba+2 è quindi 3S
pertanto dobbiamo calcolare S
1,3 x 10-29 = 108 S5
da cui S5 = 13 x 10-30/108 = 0,12 x 10-30
S= 0,655 x 10-6
quindi [Ba+2]= 3 S = 3 x 0,655 x 10-6
= 19, 6 5 x 10-6
ESERCIZIO 57
QUANTI GRAMMI DI Mg OCCORRE OSSIDARE PER OTTENERE 30,0 g DI MgO ASSUMENDO UNA RESA DELL’80%?
SOLUZIOME
DA UN ATOMO DI Mg SI OTTIENE UNA MOLECOLA DI MgO QUINDI DA X SE NE OTTEENGONO 30 g
24,31 g : 40,3 g = X : 30 g
X= 24,31 x 30 / 40 = 18,23 g
POICHè LA RESA è DELL’80 %
100: 80 = X : 18,23 X = 22,78
ESERCIZIO 58
CALCOLARE IL Kps DEL Bi2S3 SAPENDO CHE A 25° C LA SOLUBILITA’ E’ 10-15 M.
SOLUZIONE
Kps = [2S]²[3S]³
Kps = 4S² x 27 S³
Kps = (4×10-³º) ( 27 x 10–45) = 108 x 10–75
KpS= 1,08 x 10–73
ESERCIZIO 59
INDICARE TRA QUESTE LA RISPOSTA ERRATA:
1 NELLE FORME MESO E’ PRESENTE UNO STEREOCENTRO
2 NELLE FORME MESO ESISTE UN PIANO DI SIMMETRIA
3 LE FORME MESO SONO MOLECOLE ACHIRALI
4 ENANTIOMERI E DIASTEREOISOMERI COESISTONO CON LA FORMA MESO
SOLUZIONE
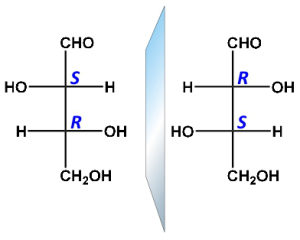
La risposta errata è la numero 4 in quanto non possono coesistere con la forma meso nè gli enantiomeri nè gli stereoisomeri.
Stereoisomeri sono molecole che differiscono tra loro per la diversa disposizione spaziale di atomi o gruppiatomici. Si possono distinguere due tipi di stereoisomeri:
- ENANTIOMERI
- DIASTEREOISOMERI
Sono detti ENANTIOMERI le coppie di molecole che sono immagini speculari l’una dell’altra (come le due mani) e non sono sovrapponibili. Sono conosciuti anche come isomeri ottici in quanto fanno deviare un raggio di luce polarizzata a destra(+) o sinistra(-). Sono molecole chirali dalla parola greca chiralos che significa mano ed hanno un atomo chirale cioè legato a 4 atomi o gruppi atomici diversi..Gli enantiomeri non posseggono né piani di simmetria né centri di inversione né assi Sn superiori .Quì mostriamo l’acido lattico
DIASTEREOISOMERI sono molecole che differiscono tra loro per la diversa disposizione spaziale di atomi o gruppi atomici ( isomeria geometrica).
due stereoisomeri hanno spesso proprietà diverse quali ad esempio la solubilità (utile per la separazione mediante la cristallizazione frazionata), la densità ed il punto di ebollizione.
Nei DIASTEREOISOMERI è presente almeno un atomo legato a 4 atomi o gruppi atomici diversi. Si distinguono in Stereoisomeri R o S
si segue la regola ideata da CAHN, INGOLD, PRELOG
Esempio di applicazione della regola Cahn-Ingold-PreloG
1- si ordinano i quattro gruppi legati all’atomo di carbonio CHIRALE dando priorità maggiore al gruppo ch è legato a questo con un atomo che ha il numero atomico maggiore (il peso atomico, nel caso di ISOTOPI); se due gruppi sono legati all’atomo di carbonio chirale con atomi di uno stesso elemento si considerano i due successivi legati a questo elemento, se anche questi sono uguali si continua lungo le catene fino a quando viene individuata una differenza. A parità di atomi legati, legami tripli e doppi hanno priorità su quelli semplici.
- Prendendo ad esempio l’acido lattico (vedi figura sopra) gli atomi rappresentati in nero sono quelli di C, quelli in rosso sono di O , quelli in bianco di H . Quì i quattro gruppi sono, in ordine di priorità decrescente
- -OH, -COOH, -CH3,
- (infatti l’ossigeno ha n.atomico maggiore di C e siccome i due gruppi COOH e CH3 sono legati all’atomo di C chirale con lo stesso atomo (il C ) allora per stabilire la priorità si passa all’atomo successivo che è l’ O per COOH e l’H per CH3, quindi la priorità è di COOH rispetto a CH3)
- 2- si pone dietro il carbonio chirale il gruppo a priorità più bassa e si osserva quindi se la sequenza delle priorità degli altri tre, in ordine decrescente, segue una rotazione oraria o antioraria : se la rotazione è oraria si assegna il prefisso (R) se la rotazione è antioraria si assegna il prefisso (S) ( vedi sopra la figura che rappresenta l’acido lattico).
ESERCIZIO 60
LA REAZIONE DI SAPONIFICAZIONE COMPORTA
1 L’IDROLISI DI UN EPOSSIDO
2 L’IDROLISI DI UN ESTERE CON NaOH ACQUOSO
3 LA SINTESI DI UN’AMMINA AROMATICA
4 L’IDROLISI DI UN ESTERE IN HCl
SOLUZIONE
La risposta esatta è la N. 2 in quanto la saponificazione viene utilizzata per produrre i cosiddetti saponi, usando come materiale di partenza i grassi (trigliceridi) facendoli reagire con idrossidi di metalli alcalini . La saponificazione è quindi un’idrolisi basica (con NaOH) di un trigliceride di un acido grasso, (composto da glicerolo ed acidi grassi). Il risultato della saponificazione produce il sale sodico dell’acido grasso con il sodio legato al carbossile.
ESERCIZI GIOCHI DELLA CHIMICA FASE REGIONALE CLASSE C
ESERCIZIO 1
DEFINIRE LA REAZIONE STEREOCHIMICA TRA LE SEGUENTI STRUTTURE
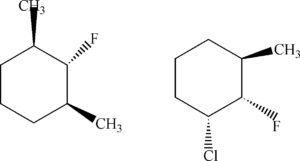
A) SONO COMPOSTI MESO
B) SONO DIASTEREOISOMERI
C) SONO ENANTIOMERI
D) SONO STRUTTURE IDENTICHE
SOLUZIONE
Sono diastereoisomeri in quanto differiscono tra loro per la diversa disposizione dei gruppi nello spazio.Non possono essere enantiomeri perchè non esiste un centro chirale (cioè un atomo legato a 4 atomi o gruppi atomici diversi) né può essere una formameso in quanto non esiste un piano di simmetria. Un composto meso un composto chimico la cui molecola contiene più centri chirali ma nel suo complesso, a causa dell’esistenza di un piano di simmetria interno, risulta otticamente inattivo.
ESERCIZIO 2
INDICARE QUALI DI QUESTI COMPOSTI E’AROMATICO
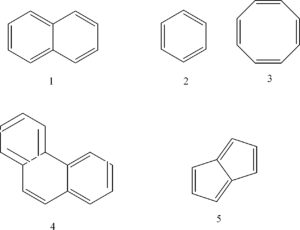
SOLUZIONE
Si definisce AROMATICO un composto che possiede una struttura molecolare con un anello in cui vi sono sei elettroni p delocalizzati.
Un anello aromatico è un sistema ciclico a struttura planare in cui tutti gli atomi coinvolti condividono tramite i loro orbitali p un totale di 4n+2 elettroni, dove n è un intero positivo (regola di Huchel).
Da quanto detto si deduce che le molecole 1, 2, 4 sono aromatiche mentre non lo sono la molecola 3 (che ha 8 elettroni P) e la 5 perchè ne ha solo 4.
ESERCIZIO 3
INDICARE QUALE SEQUENZA DI REATTIVI E’ UTILIZZATA PER TRASFORMARE IL TOLUENE (1-METILBENZENE) I ACIDO ORTOBENZOICO.
A) HBr POI KMnO4
B) KMnO4 POI HBr
C) Br2/FeBr3 poi KMnO4
D) KMnO4 POI Br2/FeBr3
SOLUZIONE
La sequenza di reazione è C , cioè prima la bromurazione in orto al metile e poi l’ossidazione del metile col permanganato. Il metile orienta il sostituente in ORTO, META E PARA ed in questo caso la bromurazione avviene principalmente in orto para.
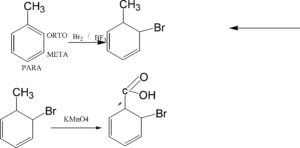
SI TRATTA DI UNA SOSTITUZIONE NUCLEOFILA AL CARBONIO IN ORTO E DI UNA OSSIDAZIONE DEL GRUPPO METILICO.
ESERCIZIO 4
INDICARE IL NOME DEL TRIPEPTIDE
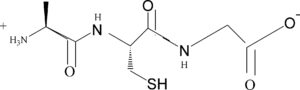
A ) L-VALIL-L-CISTEINIL- L-ALANINA
B) D-ALANIL-L-CISTEINIL-GLICINA
C) GLICIL-L-CISTEINIL-L-ALANINA
D) L-ALANIL-L-CISTEINIL-GLICINA
SOLUZIONE
I peptidi sono composti con PM inferiore ai 5.000 dalton, e sono costituiti da una catena di amminoacidi (così chiamati perchè possiedono sia un gruppo amminico NH2 sia un gruppo acido COOH). Un atomo di idrogeno del gruppo amminico NH2 di un amminoacido reagisce con l’ossidrile OH del gruppo acido di un altro amminoacido per formare un legame detto PEPTIDICO O CARBOAMMIDICO.

I peptidi CON DUE AMMINOACIDI SI CHIAMANO DIPEPTIDI, CON TRE TRIPEPTIDI ECC questi peptidi, costituiti da pochi amminoacidi sono in genere chiamati oligopeptidi.In questo caso il primo amminoacido a sinistra è la L-alanina, il secondo la cisteina il terzo la glicina:
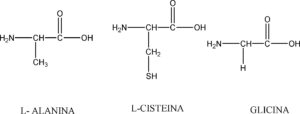
quindi la risposta corretta è la D.
ESERCIZIO 5
INDICARE L’ORDINE CRESCENTE DI ACIDITA’ TRA :
ETANO CLOROFORMIO ETANOLO ACIDO ACETICO ACIDO SOLFORICO
SOLUZIONE
ACIDO SOLFORICO FORTE
ACIDO ACETICO DEBOLE
CLOROFORMIO
ETANO (IDROCARBURO)
ESERCIZIO 6
INDICARE IL PRODOTTO DELLA SERIE SEGUENTE DI REAZIONI:
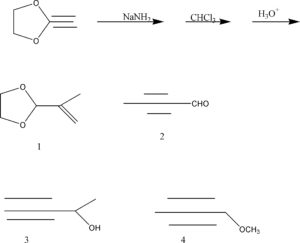
SOLUZIONE
IL PRODOTTO DI REAZIONE E’ IL N. 2
INDICARE IL PRODOTTO DI ADDIZIONE ALDOLICA INTRAMOLECOLARE DEL 2,7 OTTANDIONE .
SOLUZIONE
La reazione di uno dei carbonili con EtONa determina la ciclizzazione del C in alfa al carbonile e la successiva idrolisi porta al composto
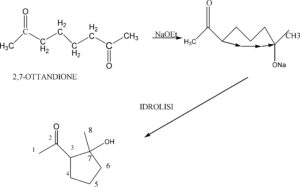
se invece la reazione viene effettuata con la base lito diisopropil amide LDA e successiva idrolisi la reazione procede formando metil idrossi eptanone :
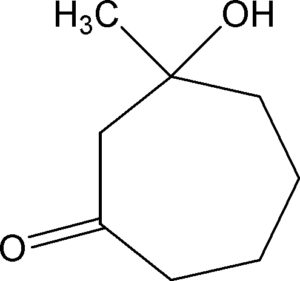
ESERCIZIO 8
L’alogenazione del furano genera spesso miscele di prodotti alogenati. Quali delle seguenti condizioni può favorire la formazione del derivato monoalgenato?
A la presenza di un sostituente alchilico
B la presenza di un sostituente acilico sull’anello a causa dell’effetto elettronattrattore
C l’aggiunta di un blando ossidante nell’ambiente di reazione
D l’utilizzo di un solvente polare aprotico
SOLUZIONE
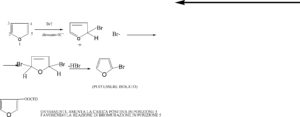
La reazione di monoalogenazione generalmente avviene con Br2 e diossano come solvente. Si ha una prima bromurazione al C5 e si ha uno ione bromo libero, e siccome gli elettroni del doppio legame in posizione 2 vengono attratti dall’ossigeno che aveva momentaneamente una carica positiva, lo ione Br- attacca la posizione 2 a questo punto positiva creando un dibromuro. Viene pero’ eliminato HBr e si forma il monoalogenato in posizione 5 che può essere isolato. Ovviamente il gruppo acilico attraendo gli elettroni verso di sè crea sulla posizione 5 l’ambiente favorevole per l’ingresso di un atomo di Br favorendo la monoalogenazione.
ESERCIZIO 9
Un esempio di sostituzione elettrofila aromatica è la reazione di diazocopulazione del fenolo. tale reazione procede con cinetica più favorevole ad un PH =9.A cosa è dovuto questo comportamento?
a) attivazione del sale di arendiazonio ad opera dell’ambiente basico
b) attivazione del fenolo ad opera dell’ambiente basico
c) maggior solubilità dei reagenti in ambiente basico
d) minore solubilità dei reagenti in ambiente basico
SOLUZIONE
La risposta corretta è la b) in quanto avendo il fenolo caratteristiche acide, in ambiente basico cede i protone e l’anello si stabilizza ulteriormente per la delocalizzazione in quanto si forma lo ione fenato che produce un aumento di densità elettronica in posizione para che viene attaccata dal diazocloruro e forma un colorantre diazoico .
Il fenolo ha una energia di risonanza di 40Kcal/mole, 38 delle quali dovute all’anello benzenico e 2 Kcal/mole dovute alla delocalizzazione di uno dei due doppietti esterni dell’ossigeno che viene condiviso con l’anello benzenico
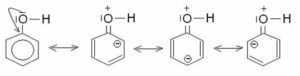
per effetto dell’ambiente basico si stacca l’H acido del fenolo
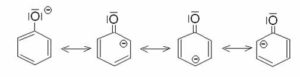
formando lo ione fenato che reagisce più facilmente con il cloruro di benzen diazonio

ESERCIZIO 10
L’acidopentanoico ed il butanoato di metile sono entrambi leggermente solubili in acqua.Quale dei due composti ha maggiore solubilità ?
1 l’acido pentanoico
2 il butanoato
3 nessuno dei due perchè hanno uguale solubilità
SOLUZIONE
Se osserviamo la struttura dei due composti
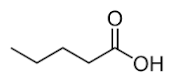
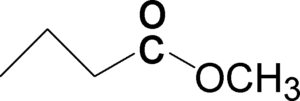
notiamo che si tratta di due isomeri di struttura perché hanno lo stesso numero di atomi ma differiscono nella struttura della molecola, pertanto devono avere la stessa solubilità.
ESERCIZIO 11
La sostituzione nucleofila al carbonio acilico è una reazione tipica dei derivati degli acidi carbossilici. I cloruri acilici reagiscono molto più velocemente delle ammidi.A cosa è dovuto questo comportamento?
1- la diversa reattività dipende dalla scelta del nucleofilo
2- dipende dal fatto che Cl- (base debole) è miglior gruppo uscente dell’NH2- (base forte)
3- maggior carattere elettrofilo del carbonile dei cloruri acilici rispetto a quello delle ammidi
4- dipende dalla scelta del solvente di reazione
SOLUZIONE
Le reazioni al carbonile sia in ambiente acido che in quello basico dei cloruri acilici sono favorite dal fatto che il doppio legame del co si apre permettendo l’attacco al carboni da parte del nucleofilo e l’alogenuro favorisce l’apertura
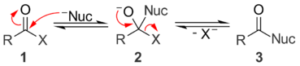

per le ammidi il discorso è diverso in quanto in questo caso l’ammide presenta due tipi di risonanza che rallentano la reazione nucleofila . il Carbonio carbonilico e l’azoto ammidico ha un forte carattere di doppio legame infatti la barriera energetica alla rotazione del legame è di 18-20 Kcal valore molto più grande di quello osservato per un legame singolo che è solitamente di 12 Kcal /mole . solo quando il nucleofilo riesce ad attaccare il carbonio la risonanza si perde perchè si forma un intermedio con maggior carattere Sp3 e ciò spiega perchè l’ammide è meno reattiva degli alogenuri acilici.
La risposta corretta è quindi la 3
ESERCIZIO 12
il reattivo di Tollens reagisce col glucosio per dare lo specchio d’argento sulle pareti della provetta in cui avviene la reazione. Il reattivo di Tollens ossida anche il fruttosio?
SOLUZIONE
LE REAZIONI SONO
2 [Ag(NH3)2 + + e ———-> Ag° + 2 NH3
1 [RCHO + 3 OH- – ———–> RCO2- + 2H2O+ 2 e
__________________________________________
2 Ag(NH3)2+ + RCHO + 3 OH- ———> Ag° + 4NH3 + RCO2-
Il carbonile è ossidato ed Ag è ridotto. L’aldeide ossidata reagisce con OH- per formare un intermedio tetraedrico. Si forma un gem diolo per spostamento di un idrogeno sino a portare all’anione carbossilato
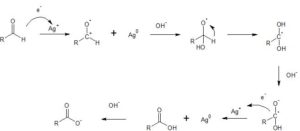
Il fruttosio pur essendo un chetone, reagisce col reattivo di Tollens tipico delle aldeidi perchè in ambiente basico si forma un intermedio diolico e quindi un’aldeide. Si instaura così un equilibrio dinamico tra queste forme per cui il fruttosio che altrimenti non potrebbe reagire essendo un chetone, può invece reagire col reattivo di tollens.
ESERCIZIO 13
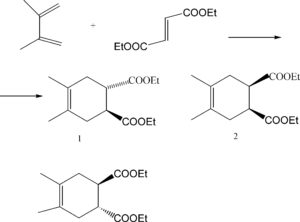
SCRIVERE QUALE PRODOTTO SI OTTIENE PER LA SEGUENTE REAZIONE DI DIELS-ALDER
- ENTRAMBE VENGONO IDROLIZZATE CON VELOCITA’ SIMILI
- SONO ENTRAMBE IDROLIZZABILI MA 2 REAGISCE PIU’ VELOCEMENTE
- SOLO LA MOLECOLA 1 UO’ ESSERE IDROLIZZATA
- ENTRAMBE SONO IDROLIZZABILI MA 1 REAGISCE PIU’ VELOCEMENTE DI 2
SOLUZIONE
L’eteroatomo contribuisce all’aromaticità del sistema con uno dei doppietti di elettroni non condivisi. Il secondo doppietto è perpendicolare al sistema Π. L’energia di stabilizzazione del sistema aromatico per il furano è di 11 kcal/mol (benzene: 36 kcal/mol). Per cui il furano subisce reazioni di addizione piuttosto che sostituzione. Il furano viene facilmente idrolizzato in condizioni acide. La protonazione dell’ossigeno è seguita da attacco nucleofilo dell’acqua.
L’anello pirrolico ha un carattere aromatico maggiore che l’anello furanosico per cui la velocità di idrolisi è pù bassa rispetto all’anello furanosico.
ESERCIZIO 15
QUALE DI QUESTI COMPOSTI REAGISCE CON2 MOLECOLE DI H IN PRESENZA DI Nikel COME CATALIZZATORE E PRODUCE PER COMBUSTIONE 5 CO2 E 4H2O ?

SOLUZIONE
La molecola n. 1 pur potendo sommare 2 molecole di H per combustione darebbe 5 di CO2 ma solo 3 di H2O perchè possiede 6 atomi di H.
La molecola n. 2 può sommare 2 molecole di H ma per combustione darebbe 4 CO2 e 2 H2O
la molecola 3 invece somma 2 molecole di idrogeno al triplo legame e forma 5 molecole di CO2 e 4 di H2O perchè possiede 8 atomi di H
la molecola 4 fornisce 5 molecole di CO2 e 4 di H2O ma possiede un solo doppio legame e quindi non può sommare 2 molecole di H ma solo una
ESERCIZIO 16
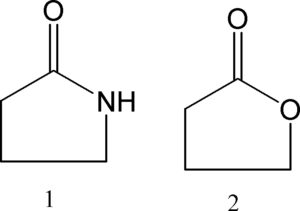
INDICARE L’AFFERMAZIONE ERRATA
- NELLE FORME MESO E’ SEMPRE PRESENTE SOLO UNO STEREOCENTRO
- NELLE FORME MESO ESISTE UN PIANO DI SIMMETRIA
- LE FORME MESO SONO ACHIRALI
- ENANTIOMERI E DIASTEREOISOMERI COESISTONO NELLA FORMA MESO
SOLUZIONE
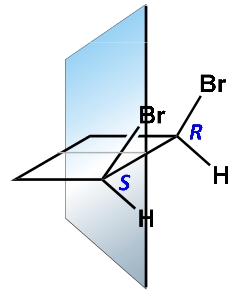
Da queste figure si evince che le forme meso sono otticamente inattive ma possiedono atomi chirali (che si legano 4 atomi o gruppi atomici diversi) e quindi enantiomeri(+ e -) e diastereoisomeri(R-S) coesistono e possiedono inoltre un centro di simmetria quindi la risposta ERRATA è la n. 1
ESERCIZIO 18
IL NEON CHE APPARTIENE AL GRUPPO VIII DELLA TAVOLA PERIODICA HA UNA MOLECOLA:
- MONOATOMICA CON L’OTTETTO ESTERNO COMPLETO
- MONOATOMICA CON ESPANSIONE DELL’OTTETTO
- BIATOMICA ED E’ POCO REATTIVO IN ASSENZA DI FIAMME O FILAMENTI INCANDESCENTI
- TETRATOMICA COME QUELLA DEL FOSFORO
SOLUZIONE
Essendo un gas nobile possiede tutti gli elettroni esterni accoppiati ed è quindi stabile ed inoltre la sua molecola è monoatomica
la struttura del Neon è: 1S² 2S ² 2Px² 2Py² 2Pz²
Desidero mettere in evidenza che le molecole biatomiche, tetratomiche ecc . sono dovute agli elettroni non accoppiati degli atomi che però tendono sempre ad accoppiarli.
Per esempio, l’IDROGENO ha molecola H2 perchè la sua struttura è 1S¹ quindi per essere stabile la molecola deve accoppiare due elettroni ognuno dei quali proviene da un atomo.
H2 = 1S1 1S1 = H–H
L’OSSIGENO che ha la seguente struttura : 1 S² 2S² 2Px² 2Py¹ 2Pz¹ tende ad accoppiare i 2 elettroni spaiati e cio’ può avvenire con un altro atomo di ossigeno
1 S² 2S² 2Px² 2Py¹ ↓2Pz¹
↓ ↓ la molecola è O2 1S² 2S² 2P²y 2Pz¹ 2S² 1S
2Py¹ 2Pz¹ 2S² 1S²
ESERCIZIO 19
DETERMINARE LA FORMULA MINIMA DEL COMPOSTO COSTITUITO DAL 47,97 % DI Zn E DAL 52,03 % DI Cl
SOLUZIONE
Si divide la % per il corrispondente peso atomico e si ottengono i grammoatomi
47,97/ 65,38 = 0,7337 grammoatomi di Zn
52,03/35,5= 1,46 grammoatomi di Cl
si divide per il numero più piccolo di g atomi cioè 0,7337 e si ottiene
0,7337/0,7337 = 1 Zn
1,46 /0,7337 = 1,99 Cl
si deduce che la formula minima è ZnCl2
ESERCIZIO 20
secondo la teoria VESPR ( valence shell electron pair repulsion) una geometria lineare può derivare dalla presenza sullò’atomo centrale:
- due coppie di legame
- due coppie di legame e due di non legame
- due coppie di legame di legame ed una di non legame
- nessuna delle risposte è corretta
SOLUZIONE
La teoria VSEPR (Valence Shell Electron Pair Repulsion) , cioè repulsione delle coppie elettroniche nel guscio di valenza, è utilizzata per prevedere la disposizione spaziale degli atomi in una molecola, cioè serve a prevedere la geometria molecolare.La disposizione geometrica dei legami attorno ad un atomo dipende dalle coppie di elettroni che lo circondano, sia quelli impegnati che quelli non impegnati nei legami con gli altri atomi. Infatti,gli elettroni si dispongono nello spazio in modo da minimizzare le forze di repulsione reciproca. Le forze di repulsione tra due coppie di non legame sono più forti rispetto alle forze di repulsione tra una coppia di non legame e coppia di legame, che sono a loro volta più forti delle forze di repulsione tra due coppie di legame.
Ad esempio,la molecola di CO2 sipUO’ FORMARE UN LEGAME T disporrà nello spazio in modo lineare con gli ossigeni alle estremità, ( non assumerà una conformazione a triangolo perché vi sarebbe una forte repulsione tra le coppie solitarie elettroniche dell’ossigeno). La CO2 tende quindi ad assumere la maggior distanza possibile tra i due doppi legami C=O (e quindi la minor repulsione tra essi) con un angolo di 180°.
Nella molecola di CH4 metano, gli atomi di H si disporranno secondo i vertici di un tetraedro con al centro l’atomo di carbonio. Gli angoli di legame risultano di 109,5° essendoci infatti quattro coppie di elettroni di legame, le repulsioni sono le stesse per tutti i legami e si ha un tetraedro regolare. Ciò non avviene invece per l’ammoniaca dove abbiamo tre coppie di elettroni di legame ed una coppia di elettroni non impegnata sull’azoto, infatti la repulsione della coppia elettronica solitaria con le coppie del legame N–H è maggiore di quella tra le coppie di legame N–H ed N–H, a causa della repulsione gli angoli di legame diminuiscono rispetto al tetraedro regolare e pertanto l’angolo H-N-H diventa di 107,3°. Nell’H2O si hanno 2 coppie elettroniche sull’ossigeno non impegnate in legami per cui le repulsioni rispetto all’ammoniaca sno più forti così come la repulsione doppietto di non legame con il doppietto di legame, ciò comporta una diminuizione ulteriore dell’angolo di legame tetraedrico che risulta essere 104°.
In conseguenza la risposta corretta è la 1 perché la geometria lineare risulta dalla repulsione tra due coppie di legame e tre di non legame.
ESERCIZIO 21
UTILIZZANDO LA TEORIA VESPR PREVEDERE QUALE TRA LE SEGUENTI COPPIE DI MOLECOLE E’ APOLARE.
1 -SO2 XeF2 2- H2O XeF2 3- CO2 H2O 4- CO2 XEF2
SOLUZIONE
IN QUESTO CASO SAPIAMO CHE XeF2 è APOLARE MA SO2 COSì COME H2O è POLARE.
lA CO2 è SICURAMENTE APOLARE E QUINDI LA COPPIA APOLARE è CO2 XeF2
ESERCIZIO 22
L’ALLUMINIO IN UN MINERALE GREZZO E’ ISOLATO COME Al2(SO4)3. DA 25 Kg DI MINERALE SI OTTENGONO 15,5 Kg DI Al2(SO4)3 . CALCOLARE LA % IN MASSA DI Al NEL MINERALE.
SOLUZIONE
se in Al2(SO4)3 : 2 Al = 15500g :X trasformando tutto in Kg si ha
ESERCIZIO 24
UN AUTOMOBILE A METANO EMETTE 29,00 Kg DI CO2 PER ANDARE DA NAPOLI A ROMA (250 Km). DETERMINARE IL CONSUMO MEDIO.
SOLUZIONE
Il metano CH4 viene bruciato nel motore e forma CO2 + H2O
CH4→ CO2+H2O
Per conoscere la quantità di Metano che ha prodotto 29,00 Kg di CO2 basta effettuare la proporzione
CH4 : CO2 = X : 29000 g
16 : 44 = X :29000 X= 1o,545 kg
per conoscere il consumo per ogni Km si ha
250 Km : 10,545= 1 Km : X X = 0,042 kg per Km
ESERCIZIO 25
SIANO X ED Y DUE ATOMI LEGATI TRA LORO. INDICARE L’AFFERMAZIONE ERRATA
- LA SOVRAPPOSIZIONE DI UN ORBITALE p DI UN ATOMO E P DI UN ALTRO PUO’ FORMARE UN LEGAME
- TRA X ED Y NON SI PUO’ FORMARE PIU’ DI UN LEGAME
- SI PUO’ FORMARE UN LEGAME TRA UN ORBITALE S DI UN ATOMO ED UNO p DELL’ALTRO.
la risposta errata è la 2 perchè è sempre possibile la formazione di un doppio legame
ESERCIZIO 26
INDICARE I COEFFICIENTI DELLA SEGUENTE REAZIONE REDOX KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 +K2SO4 +H2O
SOLUZIONE
1 [ MnO4- + 8H+ + 5e → Mn+2 + 4H2O
5 [Fe+2 → Fe+3 + e
__________________________________________
MNO4- + 5Fe+2 + 8 H+ → Mn+2 + 5Fe+3 + 4H2O
ovviamente, il ferro eve essere raddoppiato perchè si deve ottenere Fe2(SO4)3 pertanto
2MnO4- + 10 Fe+2 + 16H+ → 2Mn+2 + 10 Fe+3 + 8H2O
2KMnO4 + 10FeSO4 + 8 H2SO4 → 2 MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8 H2O
ESECIZIO 27
LA REAZIONE DI SINTESI DI SO2 DALLA PIRITE E’OTERMICA
4FeS +11 O2 → 2 Fe2O3 +8 SO2
QUALE DELLE SEGUENTI CONDIZIONI NON DETERMINA UN AUMENTO AUMENTO DELLA VELOCITA’ DI REAZIONE?
- INNALZAMENTO DELLA TEMPERATURA DEL SISTEMA
- ABBASSAMENTO DELLA TEMPERATURA DEL SISTEMA
- INNALZAMENTO DELLA PRESSIONE
- INTRODUZIONE DI UN CATALIZZATORE
La temperatura di un gas è legata all’energia cinetica media degli atomi o molecole che lo compongono, ed ovviamente anche la pressione di un gas è in relazione alla temperatura poichè dipende dal numero di urti degli atomi o molecole sulle pareti del recipiente che li contiene (e dell’impulso da loro trasferito).
In un gas, le particelle non hanno tutte la stessa velocità, dato che le velocità molecolari cambiano in seguito agli urti reciproci (gli urti tra due particelle comportano il reciproco scambio delle velocità, ma gli urti fra tre particelle comportano variazioni delle singole velocità). La legge di distribuzione delle velocità di un gas costituito da un gran numero di particelle è stata trovata da James C. Maxwell, ed ha la formula seguente:
![]()
dove f(v) esprime la probabilità che una particella di massa m abbia una velocità compresa nell’intervallo infinitesimo v e v + dv. In questa formula, T è la temperatura e KB è la costante di Boltzmann. La velocità di una reazione non è generalmente determinata unicamente dal numero di urti fra le molecole in un certo tempo. Ciò è dimostrato dall’evidenza che certe reazioni sono molto rapide ed altre, apparentemente simili, sono lente. E questo benché il numero degli urti sia quasi identico. Pertanto, si deve concludere che solo una frazione degli urti fra le molecole dà luogo ad una reazione.
Il chimico Svante Arrhenius (1859-1927) avanzò l’ipotesi che le molecole collidenti (o che si decompongono), per reagire devono possedere un’energia superiore alla media. Questo eccesso di energia è detto energia di attivazione della reazione e può essere costituito da energia cinetica (le molecole si urtano con un’energia maggiore della media) o da energia interna delle molecole, come nel caso della loro decomposizione.
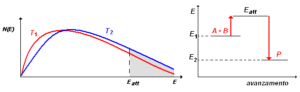
si consideri, per esempio, la reazione A + B ![]() P. Come mostra il diagramma a destra, perché A reagisca con B è necessario che il loro urto reciproco avvenga con un’energia almeno paria a Eatt , dando luogo ad un prodotto P con energia minore di quella dei reagenti. La velocità di una reazione chimica può essere aumentata per effetto di un aumento di temperatura o per la presenza di un adatto catalizzatore. Sebbene il risultato finale sia comunque un aumento dei velocità della reazione, la spiegazione è del tutto diversa. Consideriamo, per esempio, la reazione A + B
P. Come mostra il diagramma a destra, perché A reagisca con B è necessario che il loro urto reciproco avvenga con un’energia almeno paria a Eatt , dando luogo ad un prodotto P con energia minore di quella dei reagenti. La velocità di una reazione chimica può essere aumentata per effetto di un aumento di temperatura o per la presenza di un adatto catalizzatore. Sebbene il risultato finale sia comunque un aumento dei velocità della reazione, la spiegazione è del tutto diversa. Consideriamo, per esempio, la reazione A + B ![]() P
P

Supponiamo che la presenza di un catalizzatore faciliti lo stadio lento, rendendolo più veloce dello stadio successivo. In tal caso, il meccanismo di reazione diventa:

come si vede la temperatura ed i catalizzatori aumentano la velocità delle reazioni e la risposta al quesito è che la diminuizione della temperatura non determina alcun aumento della velocità di reazione.
ESERCIZIO 28
UNA MISCELA GASSOSA COSTITUITA DA QUATTRO GAS ALLA TEMPERATURA DI 25° E 1,01 X 10³ Pa HA LA SEGUENTE COMPOSIZIONE IN VOLUME:
H2O 35% NH3 30% O2 25% CH4 10%
CALCOLARE LA COMPOSIZIONE IN MASSA
SOLUZIONE
0,35 X PM H2O = 0,35 X 18 = 6,3
0,30 X PM NH3 = 0,30 X 17= 5,1
0,25 X PM O2 = 0,25 X 32 = 8,0
0,10 X PM CH4 = 0,10 X 16= 1,6
_________________________
TOTALE grammi 21,0
% massa di H2O = 63:21 = x :100 = 30 %
% in massa di NH3 = 5,1 : 21 = x :100 = 24,3 %
% in massa di O2 = 8 :21 =x :100 = 38,1 %
% in massa di CH4 = 1,6 :21 = X :100 = 7,6
ESERCIZIO 29
LA CONCENTRAZIONE IN UNA CANDEGGINA è 0,405 M. SE L’IPOCLORITO SI TRASFORMASSE COMPLETAMENTE IN Cl2 SECONDO LA REAZIONE
NaOCl + 2HCl → NaCl + Cl2 +H2O
DETERMINARE LA % ( m/m) DI Cl2 NELLA CANDEGGINA CONSIDERANDO LA SUA DENSITA’ PARIA 1,0 g/ml
SOLUZIONE
quantità in grammi di candeggina in 1 litro (1000 ml) = 0,405 x PM NaClO = 0,405 x 74,4 = 30,13 g
quindi se da NaClO si ottiene Cl2 da 30,13 se ne ottengono
74,4 : 71 =30,13 😡 X = 28,7 g
quindi da 1 litro [o meglio da 1000ml x 1,o (densità)] si ottengono 28,7 g di Cl2 e da 100 😡
X = 28,7 x 100 / 1000 = 2,87 %
ESERCIZIO 30
UN UOMO INSPIRA 9,00 m³ DI ARIA AL GIORNO MISURATI A 20° C ED 1 ATMOSFERA.
SE LA CONCENTRAZIONE DI NO2 NELL’ARIA è DI 12 ppm CALCOLARE LA LA QUANTITA’ DI NO2 RESPIRATA IN UNA SETTIMANA.
SOLUZIONE
in 106 ml di aria vi sono 12 ml di N2O sapendo che PV=g/PM x R x T si ha :
1 x 12 x 46/ 293 x 0,0821 =grammi = 23,00 x 10-6 g perciò in 9 000 vi sono 2,07 x 10–¹ g al giorno
ed in 7 giorni vi sono 0,207 x 7 = 1,44 g
ESERCIZIO N.31
INDICARE QUALE SOLIDO SI FORMA MESCOLANDO VOLUMI UGUALI DI UNA SOLUZIONE DI
H2SO4 0,03 M ED UNA SOLUZIONE DI CaCl2 0,002M ED UNA DI Na2CO3 0,005M.
- CaCO3
- CaSO4.2H2O + CaCO3
- CaSO4.2H2O
- NESSUN SOLIDO
SOLUZIONE
Le reazioni possibili sono
CaCl2 + H2SO4 → CaSO4 + 2HCl in questo caso HCl solubilizza il sale che quindi non si deposita
CaCl2 + Na2CO3 → CaCO3 + 2NaCl ma essendovi H2SO4 in eccesso, impedisce la formazione di CaCO3
pertanto non si può formare alcun solido
ESERCIZIO 32
IL METANOLO VIENE OSSIDATO SECONDO LA REAZIONE (DA BILANCIARE)
CH3OH + MnO4- +OH- → MnO4-2 + CO3-2 +H2O
CALCOLARE LE MOLI NECESSARIE PER OSSIDARE 10 g DI CH3OH
SOLUZIONE
IL C nel metanolo è legato ad un atomo più elettronegatico con un solo legame quindi per questo legame si attribuisce +1 poichè è legato ad altri 3 atomi di H che sono meno elettronegativi del C allore si ha per questo -3 perciò il n.o. del C nel metanolo è -2.
n.o. -2 n.o +4
CH3OH + 8 OH- → CO3-2 + 6 e + 6H2O
questa reazione avviene in due fasi
CH3OH + 6OH→ CO2 + 5H2O + 6e
CO2 + 2OH → CO3 -2 + H2O
e globalmente si ha
1 [CH3OH +8 OH- → CO3-2 + 6H2O +6 e
6 [MNO4- + e → MnO4-2
_________________________________→
CH3OH + 6 MnO4- + 8OH- → CO3-2 + 6 MnO4-2 +6H2O
dalla reazione si evince che per 1 mole di metanolo sono necessarie 6 moli di MnO4-
10 g di CH3OH corrispondono a 10 / 32 = 0,3125 moli mentre 6 moli di MnO4- sono pari a 6 x 118,9 g
1 : 713,4 g = 0,3125 : X X = 222,9 g cioè 222,9/118,9 =1,9 moli
ESERCIZIO 33
INDICARE LE SPECIE STABILI IN UNA SOLUZIONE 1M IN Tl+ ED 1 M IN H+ SAPENDO CHE I POTENZIALI STANDARD PER LE DUE SEMIREAZIONI SONO
E° =- 0,34 Tl+ +e → Tl
E° = +1,22 Tl+3 +2e → Tl+
- Tl+³ E Tls
- Tl+ E H+
- H2 e Tl+³
- TL+ E Tls
SOLUZIONE
Dai dati di E° il tallio non può ossidarsi a Tl+³ né ridursi a Tls e l’idrogeno rimane sotto forma di H+ . Pertanto le specie stabili in soluzione devono essere Tl+ ed H+ e la risposta corretta è la n.2
ESERCIZIO 34
UN RECIPIENTE CONTENENTE UN CUBETTO DI GHIACCIO ED ACQUA LIQUIDA E’ TERMOSTATATO A 273,15 K .VIENE AGGIUNTO DEL CLORURO DI SODIO ED IL CONTENITORE VIENE AGITATO DELICATAMENTE SEMPRE A TERMOSTATAZIONE. COSA ACCADE?
- LA MASSA DEL CUBETTO DI GHIACCIO AUMENTA
- IL CUBETTO DI GHIACCIO FONDE
- IL CLORURO VIENE INGLOBATO NEL GHIACCIO
- PARTE DELL’ACQUA EVAPORA
SOLUZIONE
essendo LA DISSOLUZIONE dell’ NaCl un processo endotermico, assorbe calore dall’esterno ed il cubetto di ghiaccio fonde. La risposta corretta è la 2
ESERCIZIO 35
UN SISTEMA CHIUSO VIENE PORTATO DALLO STATO 1 ALLO STATO 2 CON UN PROCESSO SENZA SVOLGIMENTO DI LAVORO. QUALE DI QUESTE AFFERMAZIONI E’ VERA?
- IL CALORE SCAMBIATO NON DIPENDE DAL PERCORSO SEGUITO
- IL CALORE SCAMBIATO DIPENDE DAL PERCORSO SEGUITO
- IL CALORE SCAMBIATO E’ NULLO
- NESSUNA DELLE RISPOSTE PRECEDENTI
SOLUZIONE
Dal primo principio della termodinamica si ha che la variazione di energia
E2-E1 = Q + P(V2-V1)
ΔE =Q + PΔV
ΔE = Q + Lavoro
e siccome nel nostro caso il sistema è chiuso senza possibilità di lavoro, (quindi è a volume costante) e poiché non può svolgere lavoro (rappresentato da P (v2-v1)), si deduce che
ΔE= Q.
Il calore scambiato e’ legato alla temperatura dalla relazione:
Q =M C v(T2 –T1) dalla quale ricaviamo che Δ E =M C v(T2-T1)
dove M = massa del gas Cv= calore specifico a Volume costante e T la temperatura nei due stati 1 e 2.
In questo caso il calore non dipende dal cammino percorso cioè dalle modalità con cui si scambia il calore, per cui il calore che viene fornito al sistema serve solo ad aumentare l’ Energia interna del gas e l’energia è quindi una funzione di stato.
ESERCIZIO 36
A,B,C SONO TRE SOLUZIONI ACQUOSE 1O-³ M D I UREA, CLORURO DI SODIO, E GLUCOSIO. QUALE DELLE SEGUENTI AFFERMAZIONI E’ VERA?
- A,B,C HANNO ALL’INCIRCA LA STESSA TEMPERATURA DI CONGELAMENTO
- A,B,C HANNO TEMPERATURE DI CONGELAMENTO DIVERSE
- A E B HANNO CIRCA LA STESSA TEMPERATURA DI CONGELAMENTO
- A E C HANNO LA STESSA TEMPERATURA DI CONGELAMENTO
SOLUZIONE
le soluzioni presentano un punto di congelamento più basso del solvente puro in cui il soluto è sciolto, e la differenza di temperatura di congelamento del solvente puro e quella della soluzione è definita ABBASSAMENTO CRIOSCOPICO (CRIO deriva dal greco e significa Freddo). Quando si congela una soluzione, il solvente che congela viene ostacolato dalle forze attrattive del soluto che così ne rallentano il congelamento ed il suo punto di congelamento o meglio la temperatura di congelamento si abbassa. L’abbassamento della temperatura di congelamento è direttamente dipendente dalla concentrazione del soluto espressa in grammi per Kg di solvente (MOLALITA’ da non confondere con la Molarità che è invece espressa in grammi per litro)
Δt = Tcsp – Tcsper = i x Kcr x m
In relazione a quanto sopra, A,B,C non possono avere circa la stessa temperatura di congelamento in quanto il glucosio e l’urea non si dissociano in soluzione, quindi nella formula sopra scritta i=1 mentre per NaCl in soluzione si hanno 2 ioni per cui i=2. Per questo motivo solo glucosio ed urea posseggono circa la stessa temperatura di congelamento e la risposta esatta è la D.
ESERCIZIO 37
SE IL ΔG° DI UNA REAZIONE E’ + 110 KJ /mole SI PUO’ AFFERMARE CHE :
- LA COSTANTE DI EQUILIBRIO E’ > 1
- LA COSTANTE DI EQUILIBRIO E < 1
- LA COSTANTE DI EQUILIBRIO HA VALOREA NEGATIVO
- LA COSTANTE DI EQUILIBRIO =0
SOLUZIONE
Tra ΔG°e la costante di equilibrio Ke di una reazione, vi è la seguente relazione,
- AUMENTARE LA TEMPERATURA
- DIMINUIRE LA TEMPERATURA
- AUMENTARE LA PRESSIONE
- NESSUNA DELLE RISPOSTE
SOLUZIONE
abbiamo già trattato l’argomento nell’ esercizio 27 a cui rimandiamo per la spiegazione.
In questo caso la risposta esatta è la n. 2 cioè diminuire la temperatura.



Lascia un commento