GIOCHI DELLA CHIMICA 2014 FASE REGIONALE CLASSI A-B
I primi 40 quesiti sono comuni alle classi A e B
1. Gli isotopi di un elemento hanno: A) ugual numero di protoni e diverso numero di neutroni B) ugual numero di neutroni e diverso numero di protoni C) ugual numero di protoni e diverso numero di elettroni D) ugual numero di neutroni e diverso numero di elettroni
soluzione
un isotopo di un elemento chimico [ ἴσος (ìsos, “stesso”) e τόπος (tòpos, “posto”)], è un atomo che possiede lo stesso numero atomico Z dell’elemento ma ha un differente numero di massa A, e quindi diversa massa atomica M. La differenza dei numeri di massa, a parità di numero atomico, è dovuta alla presenza di un differente numero di neutroni presenti nel nucleo dell’atomo che ne modifica la massa e non la carica.
Ad esempio l’H idrogeno possiede solo un protone ed ha 2 isotopi :il Deuterio con 1 protone ed un neutrone (massa 2 ) ed il Tritio (T) che possiede un protone e 2 neutroni (massa 3).
2. I vecchi libri di testo parlavano in modo non corretto di “numero di Avogadro”. Nei testi recenti si riporta correttamente la definizione di “costante di Avogadro”. Infatti un numero è adimensionale, mentre la definizione stessa di mole impone una dimensionalità alla “costante di Avogadro”. Indicare il simbolo attuale e le dimensioni della costante di Avogadro:
A) N = 6,0221 ·1023 mol–1
B) NA = 6,0221 ·1023 mol–1
C) NA = 6,0221 ·10–23 mol–1
D) NA = 6,0221 ·1023 mol
soluzione
In realtà la costante di Avogadro rappresenta la quantità di molecole contenute in una mole di una qualsiasi sostanza. Questa quantità è 6,02 x 10²³ molecole. Per esempio in 1 mole di idrogeno 2,016 g vi sono 6,02 x 10²³ molecole ma la stessa quantità la ritroviamo in una mole di Ossigeno 32 g oppure in una mole di acqua 18 g.
Pertanto la costante di avogadro è 6,02 x 10²³ per mole cioè 6,02 x 10²³ mole-¹
risposta corretta B
3. A 323,15 K, il prodotto ionico dell’acqua è 5,47 ·10–14. Calcolare il pH di una soluzione di NaOH 0,01 M a questa temperatura:
A) 12,7 B) 11,3 C) 14,0 D) 10,8
soluzione
sappiamo che il prodotto ionico dell’acqua è
Kw = [H+][OH-] perciò essendo [OH-]= 0,01 si ha 5,47 x 10-14 = [H+] x 0,01
da cui 5,47 x 10-14/ 0,01 = [H+] quindi [H+]= 5,47 x 10-¹²
ed il PH= -log 5,47 x 10-¹² PH = 12 -log 5,47 = 12- 0,73 =11,26 =11,3
risposta corretta B
4. 10 mL di un acido forte HX 0,1 M reagiscono con 1 mL di NaOH 1 M. Calcolare il pH della soluzione:
A) 7 B) compreso tra 6 e 7 C) compreso tra 7 e 8 D) 8,4
soluzione
le millimoli di HX sono date dal prodotto Volume in ml x Molarità quindi mmoli HX = 0,1 x 10 =1 mmole
le millimoli di NaOH sono volume x molarità ed in questo caso millimoli di NaOH = 1 x 1 =1 mmole
ne consegue che tutto l’acido HX è neutralizzato dalla base NaOH per cui nè H+ nè OH- sono in eccesso e la soluzione è neutra cioè ha un PH=7
risposta corretta A
5. Il bromo, avente massa atomica 79,904 u, esiste in natura come miscela di due isotopi. Uno dei due, 79Br, ha una massa di 78,918 u e abbondanza naturale del 50,690%. Quale deve essere la massa dell’altro isotopo, 81Br?
A) 76,769 u B) 81,126 u C) 80,918 u D) 79,997 u
soluzione
Per ogni elemento chimico della tavola periodica la massa indicata rappresenta la media ponderale della massa dei vari isotopi dell’elemento presenti in natura che tiene conto dell’abbondanza (in %) di ogni isotopo.
La media ponderale è calcolata dalla somma dei prodotti tra la Massa x % di ogni isotopo diviso per 100
Massa media dell’Isotopo=
= Massa isotopo 1 x % in natura + Massa isotopo 2 x % in natura / 100
uno degli isotopi 79Br ha una massa M = 78,918 ed una abbondanza in natura 50,69 %
la massa dell’ isotopo 81Br si calcola ricordando che
79,904 = Massa isotopo 79Br x % + Massa isptopo 81Br x % / 100
7990,4 =Massa isotopo 79Br x % + X
7990,4 = 4000,35 +Massa isptopo 81Br x % in natura
X= 7990,4 – 4000,35 = Massa isptopo 81Br x % in natura
X= 3990,05 = Massa isptopo 81Br x % in natura
dividendo per la % in natura si ha la massa dell’isotopo
3990,05 / 100-50,69 = 3990,05 /49,31 = 80,918 u
risposta corretta C
6- Indicare quanti atomi sono presenti in una mole di molecole di fosforo bianco. Il fosforo bianco è un allotropo del fosforo costituito da molecole tetraedriche di formula P4.
A) 6,022 ·1023 atomi
B) 2,409 ·1024 atomi
C) 4,818 ·1024 atomi
D) 1,505 ·1028 atomi
soluzione
poiché una mole di atomi è costituita da 6,02 x 10²³ atomi, e poiché una molecola di P è costituita da 4 atomi, è evidente che
numero di atomi di P in una mole = 6,02 x 10²³ x 4 = 24,08 x 1023 atomi = 2,4 x 1024 atomi
risposta corretta B
7. Un aumento di pressione di un gas produce:
A) un aumento della velocità quadratica media delle particelle gassose
B) un aumento del cammino libero medio
C) un aumento della frequenza di urto sulle pareti del recipiente
D) nessun aumento
soluzione
un gas, secondo la teoria cinetica, è costituito da particelle in movimento che così si urtano tra loro ed urtano le pareti del recipiente che le contiene. La pressione è dovuta al numero di urti che avvengono tra le molecole e le pareti del contenitore ed ovviamente è legata all’energia cinetica delle molecole e quindi in stretta correlazione con la temperatura.
Se si considera il moto delle particelle lungo l’asse X dove si trovano due pareti con distanza L si trova che, essendo la pressione P una forza che si esercita su una superficie S, la pressione è:
P= F /S e P= m/L³ x N x V² dove N è il numero di particelle e m la massa delle particelle e V² è la loro velocità quadratica media L³ il volume del recipiente.
N= numero di moli x Costante di avogadro=nNA
ma m x Na =Massa molecolare quindi P=(n M /volume) V²
teniamo presente che la velocità quadratica V² =1/3V² perchè la direzione può essere lungo l’asse x,y oppure z .
Da questa espressione P=(n M /volume) V² si comprende meglio la relazione diretta tra la pressione e la velocità delle molecole.
Risposta corretta C
8. Indicare l’affermazione ERRATA relativa al calcio:
A) il simbolo del calcio è Ca
B) il calcio appartiene allo stesso gruppo della tavola periodica del bario
C) il calcio è un elemento del gruppo IIA della tavola periodica
D) il calcio è un metallo alcalino
soluzione
le risposte A,B,C sono corrette ma la risposta D è ERRATA.
Infatti, il Ca è un metallo ALCALINO TERROSO
9. L’energia di ionizzazione:
A) aumenta lungo il gruppo
B) è l’energia minima in gioco quando un atomo gassoso acquista un elettrone
C) è l’energia minima necessaria a rimuovere un elettrone da un atomo gassoso
D) diminuisce lungo il periodo
soluzione
L’energia di prima ionizzazione è l’energia espressa in ev (elettronivolts) necessaria per allontanare da un atomo un elettrone esterno e portarlo a distanza infinita. Per misurarla si fa avvenire il processo di ionizzazione dell’atomo
X(g) → X+(g) + e− I1
L’energia di ionizzazione è una proprietà periodica nel senso che il suo valore aumenta lungo un periodo ma diminuisce lungo un gruppo. Pertanto
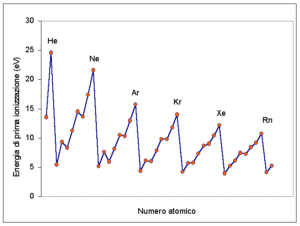
da questa figura si evince chiaramente che l’E.I. aumenta nei vari periodi ma diminuisce nei gruppi.
Risposta corretta C
10. Calcolare il pH di una soluzione ottenuta mescolando 50 mL di NaOH 0,0100 M con 25 mL di HCl 0,0400 M:
A) 4,20 B) 7,00 C) 2,18 D) 10,2
soluzione
le millimoli di NaOH adoperate sono calcolate moltiplicando il volume(in ml) x la Molarità
50 x 0,01 = 0,5 mmoli NaOH e per l’acido sono 25 x 0,04 = 1 mmole
dopo il mescolamento, rimane in soluzione 1-0,5=0,5 mmoli di Acido in eccesso perchè 0,5 mmoli di NaOH sono stati neutralizzati da 0,5 mmoli di Acido.
si deduce che 0,5 moli di acido in eccesso si trovano adesso in un volume in ml pari a
50 + 25 =75 ml.
La nuova concentrazione molare di acido è calcolata da:
se in 75 ml vi sono 0,5 mmoli di acido in 1000 ml ve ne saranno X
X = 1000 x 0,5 /75 = 6,6 millimoli in 1 litro
ma la Molarità è il numero di Moli /Litro non di millimoli perciò
M= 6,6 x10-3 Moli/L quindi
PH =- log 6,6 x 10 -3 = 3-log 6,6 = 2,18
risposta corretta C
11. Calcolare la massa molecolare di un composto XY, sapendo che una soluzione ottenuta sciogliendo 10,20 g in 0,5 L risulta 0,159 M:
A) 110,4 B) 128,3 C) 144,6 D) 201,5
soluzione
per calcolare il PM sappiamo che la concentrazione è espressa in Moli/litro quindi dove Moli= g/ PM perciò
se in 0,5 L (500 ml) vi sono 10,20 g di XY in 1 litro (1000 ml) vene saranno X
X = 10,20 x 1000/500
X= 2040 g e poichè 2040/PM = Molarità allora 2040/PM = 0,159 da cui
PM = 20,40 /0,159 =128,3
risposta corretta B
12. Le benzine sono costituite da miscele di:
A) carboidrati B) polimeri C) idrocarburi D) bitumi
soluzione
le benzine sono prodotti della distillazione del petrolio greggio. La distillazione lascia un residuo che può ancora essere utilizzato per la produzione di benzine con un metodo detto cracking catalitico e con questo stesso metodo si possono ottenere benzine dal gasolio pesante.
13. Indicare, tra i seguenti gruppi della tavola periodica, quello che contiene esclusivamente elementi gassosi a temperatura ambiente e a pressione atmosferica: A) IA B) VIIA C) VA D) VIIIA
soluzione
Esistono tre diverse convenzioni di numerazione per i gruppi chimic i.La più recente, dal 1990 raccomandata dalla IUPAC utilizza i numeri arabi (1,2,3,4….) mentre la vecchia numerazione IUPAC e la numerazione CAS (chemical Abstract Service) utilizzano i numeri romani (I II III IV V….) e le lettere A e B.
-
IUPAC IUPAC
precedenteCAS Nome Gruppo 1 IAIAmetalli alcalini Gruppo 2 IIAIIAmetalli alcalino terrosi Gruppo 3 IIIAIIIBgruppo dello scandio Gruppo 4 IVAIVBgruppo del titanio Gruppo 5 VAVBgruppo del vanadio Gruppo 6 VIAVIBgruppo del cromo Gruppo 7 VIIAVIIBgruppo del manganese Gruppo 8 VIIIAVIIIBgruppo del ferro Gruppo 9 VIIIAVIIIBgruppo del cobalto Gruppo 10 VIIIAVIIIBgruppo del nichel Gruppo 11 IBIBgruppo del rame (metalli nobili) Gruppo 12 IIBIIBgruppo dello zinco Gruppo 13 IIIBIIIAgruppo del boro, anche detti terrosi Gruppo 14 IVBIVAgruppo del carbonio o cristallogeni Gruppo 15 VBVAgruppo dell’azoto Gruppo 16 VIBVIAgruppo dei calcogeni Gruppo 17 VIIBVIIAgruppo degli alogeni Gruppo 18 VIIIBVIIIAgruppo dei gas nobili
Dalla tabella si evince che il gruppo 18 è quello cui appartengono i GAS NOBILI cioè Elio He, Neon Ne, Argo Ar,Kripto Kr, Xeno Xe che nella vecchia nomenclatura corrisponde al gruppo VIII A( 0 VIII B).
La risposta corretta è D
14. Indicare la massa di carbonato di calcio, CaCO3, noto come calcare, che si può ottenere dalla reazione quantitativa di 560,0 g di ossido di calcio con 660,0 g di anidride carbonica secondo la reazione:
CaO + CO2 → CaCO3
A) 999,0 g di CaCO3 B) 1222 g di CaCO3 C) 1488 g di CaCO3 D) 665,0 g di CaCO3
soluzione
la reazione ci indica che 1 mole di CaO reagisce con 1 mole di CO2 per dare 1 mole di CaCO3 e poichè abbiamo per CaO 560,0/ 56,08 moli e per CO2 660 / 44 moli cioè abbiamo:
9,99 moli di CaO e 15 moli di CO2 è evidente che le moli di CaCO3 ottenute saranno 9,99
quindi i grammi di CaCO3 sono g = moli x PM = 9,99 x 100 =999 g
risposta corretta A
15. Indicare i coefficienti che permettono di bilanciare la seguente reazione (i coefficienti sono riportati in maniera disordinata):
Cu + NO3– + H+ → NO + Cu2+ + H2O
A) 3, 3, 2, 2, 4, 6
B) 8, 2, 3, 2, 4, 3
C) 4, 2, 8, 3, 8, 3
D) 4, 2, 2, 3, 4, 8
soluzione
la reazione redox è la seguente
3[Cu° → Cu+2 + 2 e
2[NO3- + 4 H+ + 3 e → NO + 2H2O
_____________________________
3Cu° + 2 NO3- + 8H+ → 3Cu+² + 2NO + 4 H2O
risposta corretta B
16. Il sale MgCl2 è solubile in acqua. Sciogliendo 3 mol di MgCl2 in un litro di acqua, si ottengono:
A) 1 mol di Mg2+ e 2 mol di Cl–
B) 3 mol di Mg2+ e 3 mol di Cl–
C) 3 mol di Mg2+ e 6 mol di Cl–
D) 3 mol di Mg2– e 6 mol di Cl+
soluzione
l’acqua solubilizza l’ MgCl2 solvatando lo ione Mg+2 e lo ione Cl-.
MgCl2 → Mg+2 + 2 Cl-
pertanto da 1 mole di MgCl2 si ottengono
1 mole di mg+2 e 2 moli di Cl-
si evince quindi che da 3 moli di MgCl2 si ottengono 3 moli di Mg+2 e 6 moli di Cl-
risposta corretta C
17. Quanta acqua occorre aggiungere a 50 g di una soluzione al 50% (p/p) di NaCl per avere una soluzione al 14%?
A) 128,6 B) 212,4 C) 115,8 D) 98,40
soluzione
applicando il sistema semplificato a croce
50% 14 parti di soluzione al 50%
14%
0%(H2O) 36 parti di H2O necessari
__________________________________
50 parti in totale
da questo si deduce che per 14 grammi di soluzione al 50% occorrono 36 g di H2O quindi per 50 g iniziali saranno necessari X g di H2O cioè
14 :36 =50 :X da cui X= 50 x 36/14 =128,57 = 128,6
risposta corretta A
18- La percentuale volumetrica dell’argon (Ar) nell’aria è 0,93% (uguale anche alla % in moli). Calcolare la massa di Ar in 2 m3 di aria alle vecchie condizioni normali (273,15 K, 1,013 ·105 Pa):
A) 25,7 g B) 33,2 g C) 7,41 g D) 66,4 g
2 m³ = 2000 litri
calcoliamo il volume dell’argo in 2000 l di aria
100:0,93 in 2000 😡 X=18,6 litri di argo
ma sappiamo che 1 mole di un gas a c.n. occupa sempre un volume di 22,4 litri perciò
1: 22,4 =x :18,6 l x =0,830 moli di argo
grammi di argo = 0,830 x 39,94 = 33,16 = 33,2 g
risposta corretta B
19. Indicare la massa di SF4 che si può ottenere dalla reazione quantitativa di 256 g di S8 con 532 g di F2, secondo la reazione da bilanciare:
S8 + F2 → SF4
A) 575 g B) 756 g C) 342 g D) 222 g
soluzione
la reazione bilanciata è :
S8 + 16 F2 → 8 SF4 da cui si evince che 1 mole di S reagisce con 16 moli di F
Il quesito ci dice che reagiscono 256 g di S con 532 di F perciò abbiamo
256 g /256 (PM) = 1 mole di S (essendo la molecola ottoatomica quindi pesa 32 x 8=256 g)
532 / 38 (PM)= 14 moli di F2 (19 x 2)
quindi, alla reazione possono partecipare al massimo 14 moli di F2 e non 16 quindi la quantità di zolfo che reagisce è inferiore ad 1 mole e la quantità di S che reagisce si calcola dalla proporzione:
se 1 mole di S secondo la reazione, reagisce con 16 moli di F2 quante moli reagiscono con 14 di F2 ?
1 : 16 =X : 14 X=0,875 moli di S che reagiscono effettivamente con 14 moli di F2
a questo punto, per ottenere quante moli di SF4 si ottengono da 0,875 moli di S ricorriamo alla proporzione:
se 1 mole di S produce 8 moli di SF4 (come da reazione vista sopra) allora 0,875 moli produrranno X moli di SF4
1 : 8 x SF4 = 0,875 :X
1: 8 x 108 (PMSF4) = 0,875 : X X= 756 g di SF4 che si ottengono dalla reazione tra 256 g di S e 532 g di F2
risposta corretta B
20. Indicare in modo inequivocabile la quantità di ossigeno che bisogna far reagire con 4,0 mol di atomi di ferro, perché la seguente reazione sia completa:
4 Fe + 3 O2 → 2 Fe2O3
A) 3,0 mol di atomi di ossigeno
B) 3,0 mol di molecole di ossigeno
C) 6,0 mol di molecole di ossigeno
D) 12,0 mol di molecole di ossigeno
soluzione
la reazione data sopra indica che 4 moli di Fe reagiscono con 3 moli di O2 ( la molecola di ossigeno è costituita da 2 atomi) per formare 2 moli di Fe2O3. Pertanto
la risposta corretta è B
21. Calcolare la quantità di calore che occorre fornire a una tazza di tè (200 mL) per riscaldarla da 25 °C a 90 °C. Si assuma che il tè abbia la stessa densità e la stessa capacità termica specifica dell’acqua (4,184 J K–1 g–1) e si trascuri il contributo delle dispersioni e della capacità termica della tazza:
A) 16 kJ B) 54 kJ C) 74 kJ D) 90 kJ
soluzione
la quantità di calore dipende sia dalla massa del campione in esame sia dalla differenza di temperatura cui è sottoposto, e dal suo calore specifico cioè :
Q = C m ΔT
dove C è il calore specifico di una sostanza rappresenta la quantità di calore che la massa di 1 kg di tale sostanza deve scambiare perché la sua temperatura vari di un 1°C (o di 1 K) Q si misura in Joule, m è la massa espressa in kg e ΔT la variazione di temperatura.
Siccome il Thè ha una densità uguale a quella dell’acqua che a 25° è 1 (quindi in questo caso m= 200 x 1 = 200 g ) ed ha una capacità termica come quella dell’acqua C= 4,184 J/ K ed essendo ΔT= 90 -25 = 65
Q= 4,184 x200 x 65
Q= 5,44 x 10-4 J o meglio 54,4 KJ
risposta corretta B
22. 0,12 mol di un acido incognito HNNX reagiscono completamente con 0,36 mol di NaOH, formando NaNNX. Stabilire il numero di protoni N rilasciati dall’acido:
A) 1 B) 4 C) 3 D) 2
soluzione
dai dati forniti si evince che la quantità di NaOH è 3 volte quella dell’acido incognito (0,12 di acido e 0,36 di base) per cui la reazione deve essere :
H3X + 3 NaOH → Na3X + 3H2O con rilascio di 3 H+ dell’acido.
a risposta corretta è C
23. Calcolare la molarità di una soluzione di H2O2 a 12 volumi [1 volume = 1 litro di O2 che si sviluppa da 1 L di soluzione alle vecchie condizioni normali (273,15 K, 1,013 ·105 Pa)]:
A) 1,680 B) 1,070 C) 0,546 D) 1,200
soluzione
poichè H2O2 sviluppa 1 di O 2H2O2 sviluppano O2 quindi il volume sviluppato è 24 litri
ricordando che a c.n. 1 mole di sostanza occupa un volume di 22,4154 Litri per conoscere il numero di moli si ricorre alla proporzione
22,414 litri : 1 mole = 24 litri : X X= 1,070 moli pertanto la molarità è M= 1,070 M
risposta corretta B
24. Nella reazione:
Na2SiF6 + 4 Na → 6 NaF + Si
A) se reagisce 1 mol di Na2SiF6, si formano 3 mol di NaF
B) se reagisce 1 mol di Na2SiF6, si forma 1 atomo di Si
C) se reagisce 1 g di Na2SiF6, si formano 6 g di NaF
D) se reagisce 1 mol di Na, si formano 0,25 mol di Si
soluzione
la reazione indica che da 4 moli di Na si ottiene 1 mole di Si quindi da 1 mole si ottiene 1/4 di moli di Si
infatti 4 : 1 = 1 :X X= 1/4 = 0,25 moli
la risposta corretta è D
25. Un ossido acido è un composto:
A) binario formato da un non metallo e ossigeno
B) ternario formato da un non metallo, idrogeno e ossigeno
C) binario formato da un metallo e ossigeno
D) ternario formato da un metallo, idrogeno e ossigeno
soluzione
Gli ossidi acidi sono costituiti da un non metallo, unito con un legame covalente ad una o più molecole d’ossigeno (es CO2,SO2 NO2 ecc) . Gli ossidi acidi reagendo con l’acqua formano un acido ossigenato (es SO2+H2O forma H2SO4).Il comportamento acido è tanto più forte quanto più è alto il numero di ossidazione del non metallo.
risposta corretta A
26. Il legame a idrogeno nell’acqua ha luogo:
A) tra due atomi di idrogeno appartenenti a due molecole diverse
B) tra due atomi di idrogeno appartenenti alla stessa molecola
C) tra un atomo di idrogeno e uno di ossigeno appartenenti a molecole diverse
D) tra un atomo di idrogeno e uno di ossigeno appartenenti alla stessa molecola
soluzione
Quando un atomo di idrogeno forma una molecola con un atomo elettronegativo, a causa dell’affinità di quest’ultimo verso il doppietto elettronico del legame, l’atomo elettronegativo assume una carica parziale δ- e l’atomo di idrogeno assume una caria parziale δ+ e si viene quindi a formare un dipolo elettrico permanente.Per es.
+ H-Cl –

Ciò significa che se la molecola polare contenente l’idrogeno si trova vicino ad un’altra molecola che ha anch’essa un momento di dipolo, viene attratta dal polo negativo di quest’ultimo proprio dalla parte dell’idrogeno. Un tipico esempio è fornito dall’acqua,
27. Indicare quale dei seguenti composti dà in soluzione un pH inferiore alla neutralità:
A) KClO4 B) NaNO3 C) NH4Br D) NH3
soluzione
in questo caso il PH è il risultato dell’idrolisi di un sale. Esso dipende dal tipo di sale, infatti:
1 – per i sali di acido forte e base forte il PH che risulta è neutro
KClO4 + H2O forma KOH base forte+ HClO4 acido forte
NaNO3 +H2O forma NaOH base forte + HNO3 acido forte
2 – per i sali di acido debole e base forte il PH è basico [OH-]² = (Kw/ka ) x [sale]
3 – per i sali di acido forte e base debole il PH è acido [H+]² = (Kw/Kb) x [sale]
NH4Br + H2O forma NH4OH base debole + HBr acido forte
l’NH3 è una base che in soluzione acquosa forma NH4OH quindi una base debole ed il PH è basico
[OH-]² =Ka Cbase
quindi tra le molecole indicate, la molecola che in soluzione produce un PH acido è NH4Br
la risposta corretta quindi è C
28. Calcolare il pH di una soluzione satura di acido colico (solubilità 2,70 ·10–4 M, Ka = 2,51 · 10–5):
A) 4,08 B) 7,81 C) 9,23 D) 8,40
soluzione
essendo l’acido colico un acido debole si ha : HA<=> H+ + A- Ka= [H+] [A-] / [HA]
Ka = [H+]² /[HA]
la conc Ca=[HA] è pari alla solubilità molare perché la solubilità non è altroche il numero massimo di moli che si trovano in soluzione quindi Ca= 2,7 x 10-4
[H+]= √ Ka Ca =√ 2,51 x 10-5 x 2,7 x 10-4 = √67,7 x 10-10 = 8,22 x 10-5
PH = -log [H+] = 5 -log 8,22 = 4,08
risposta corretta A
29- Mescolando 50 g di una soluzione al 13% (p/p) di KNO3 con 25 g di una soluzione al 38% (p/p) di KNO3, qual è la percentuale della soluzione finale?
A) 27,0 B) 18,4 C) 16,9 D) 21,3
soluzione
50 g al 13 % significa che vi sono 0,13 x 50 = 6,5 g di KNO3
25 g al 38 % significa che vi sono 0,38 x 25 = 9,5 g di KNO3
quando vengono mescolati avremo 6,5+ 9,5 g = 16 g in 75
quindi se in 75 vi sono 16 in 100 ve ne sono X X = 1600/75=21,33 %
risposta corretta D
30. Per formare legami chimici gli atomi utilizzano:
A) i protoni B) i neutroni C) gli elettroni D) i protoni e i neutroni
soluzione
un legame chimico è una forza che tiene uniti gli atomi in una molecola. In ogni legame si verifica la condivisione o il trasferimento di elettroni tra i due atomi. Ogni legame è costituito da due elettroni. In alcuni casi si verifica il trasferimento di elettroni tra due atomi generando due cariche opposte che si attraggono con legame elettrostatico.Quando si ha la condivisione di due elettroni il legame si dice covalente, se invece si ha trasferimento di elettroni il legame è ionico perché si formano due ioni di cui uno è positivo e l’altro negativo che si attraggono.
31. Nella molecola HCl è presente:
A) un legame covalente polare
B) un legame a idrogeno
C) un legame ionico
D) un legame doppio
soluzione
quando si parla di molecola nel caso di HCl si intende la molecola gassosa perchè questa in soluzione non esiste. In soluzione si ha sempre H+Cl-.
Pertanto la molecola di HCl è una molecola con legame covalente polare in quanto l’affinità elettronica del Cl- è elevata ed il doppietto elettronico è più spostato verso il cloro generando un dipolo
H Cl HCl
risposta corretta A
32. Indicare quale tra le seguenti affermazioni è ERRATA:
A) gli elementi del gruppo IIA formano composti ionici
B) gli elementi del gruppo IA formano composti ionici
C) gli elementi del gruppo VII A formano soltanto composti ionici
D) gli elementi del gruppo VIIA formano sia composti ionici che molecolari
soluzione
| UPAC | IUPAC precedente |
CAS | Nome |
|---|---|---|---|
| Gruppo 1 |
IA
|
IA
|
metalli alcalini |
| Gruppo 2 |
IIA
|
IIA
|
metalli alcalino terrosi |
| Gruppo 3 |
IIIA
|
IIIB
|
gruppo dello scandio |
| Gruppo 4 |
IVA
|
IVB
|
gruppo del titanio |
| Gruppo 5 |
VA
|
VB
|
gruppo del vanadio |
| Gruppo 6 |
VIA
|
VIB
|
gruppo del cromo |
| Gruppo 7 |
VIIA
|
VIIB
|
gruppo del manganese |
| Gruppo 8 |
VIIIA
|
VIIIB
|
gruppo del ferro |
| Gruppo 9 |
VIIIA
|
VIIIB
|
gruppo del cobalto |
| Gruppo 10 |
VIIIA
|
VIIIB
|
gruppo del nichel |
| Gruppo 11 |
IB
|
IB
|
gruppo del rame (metalli nobili) |
| Gruppo 12 |
IIB
|
IIB
|
gruppo dello zinco |
| Gruppo 13 |
IIIB
|
IIIA
|
gruppo del boro, anche detti terrosi |
| Gruppo 14 |
IVB
|
IVA
|
gruppo del carbonio o cristallogeni |
| Gruppo 15 |
VB
|
VA
|
gruppo dell’azoto |
| Gruppo 16 |
VIB
|
VIA
|
gruppo dei calcogeni |
| Gruppo 17 |
VIIB
|
VIIA
|
gruppo degli alogeni |
| Gruppo 18 |
VIIIB
|
VIIIA
|
gruppo dei gas nobili |
Gli elementi del gruppo IIA e I A sono metalli alcalino terrosi ed alcalini e formano composti ionici quindi le risposte A e B sono corrette.
La tabella indica inoltre che gli elementi del gruppo VII A (secondo la vecchia nomenclatura e 17 secondo la nomenclatura del 1999) sono alogeni che formano molecole ioniche ma formano anche molecole covalenti polari vedi per es HCl nell’esercizio precedente.
si deduce che la risposta errata è C
33. L’anidride carbonica ha una geometria (posizione media relativa degli atomi):
A) triangolare (triangolo equilatero)
B) lineare
C) triangolare (triangolo isoscele)
D) non si può dare una risposta a questa domanda in mancanza di informazioni aggiuntive
soluzione
![]()
secondo la teoria VESPR possiamo utilizzare il cosiddetto Numero Sterico (SN) per valutare l’ibridizzazione del C ed individuare la geometria della molecola.
SN = numbero di coppie solitarie + numero di atomi legati direttamente all’atomo in esame
se SN = 2 si ha un’ ibridizzazione SP
se SN=3 si ha un’ibridizzazione SP2
Dalla struttura di Lewis vediamo che il C ha SN=2 infatti non ha coppie solitarie ma è legato a 2 atomi quindi il C è Ibrido SP
L’ossigeno a sua volta ha SN=3 infatti ha 2 coppie solitarie ed è legato ad un solo atomo (il C)
la configurazione elettronica dell’ossigeno è [He]2S22P4
per sistemare le due coppie solitarie e la coppia di legame forma 3 orbitali ibridi equivalenti SP2
due orbitali SP2 contengono le due coppie solitarie e rimangono un orbitale SP2 ed un orbitale P non ibrido nei quali vi è 1 elettrone ciascuno. La figura mostra la sovrapposizione degli orbitali
il Carbonio è ibrido SP e l’ossigeno è ibrido SP2
La molecola pertanto è lineare.
risposta corretta B
34. Calcolare il pH di una soluzione contenente 1,10 g/L di HgO e 5,8 g/L di KI (eccesso), considerando la reazione:
HgO + 4 I– + H2O → HgI42– + 2 OH–
A) 11,2 B) 13,6 C) 13,7 D) 12,0
soluzione
le moli di HgO sono 1,10/ 216,6 = 5,078 x 10 -³
le moli di KI sono 5,8 / 166 = 0,0349
dalla reazione si evince che da 1 mole di HgO si ottengono 2 moli di OH- pertanto
da 0,005078 moli si ottengono 0,01 moli di OH-
POH = – log 0,01 =2 PH = 14-2 =12
risposta corretta D
35. La concentrazione massima ammissibile di butilammina in un ambiente di lavoro è 15 mg/m3. Quanti grammi di sostanza devono evaporare in una stanza di 5 m di larghezza, 4 m di lunghezza e 3 m di altezza per raggiungere tale valore limite?
A) 0,90 B) 0,65 C) 1,20 D) 2,30
soluzione
i metri cubi della stanza in esame sono 4 x 3 x 5 = 60 m³
quindi se in 1 m³ la massima quantità ammissibile è 15 mg, in 60 m³ la quantità sarà X
1 : 15 = 60 : X X= 900 mg cioè 0,90 g
risposta corretta A
36. Un’aliquota del sale Na2SO4 ·10 H2O viene riscaldata a 160 °C per 2 ore. L’acqua evaporata occupa un volume di 7,80 L alle vecchie condizioni normali (273,15 K e 1,013 · 105 Pa). Calcolare il peso iniziale del sale:
A) 24,74 g B) 32,92 g C) 11,21 g D) 18,33 g
soluzione
calcoliamo i grammi di acqua provenienti da Na2SO4. 10H2O
PV=nRT n= 1 x 7,8 = n 0,0821 x 273
n= 7,8 / 0,0821 x 273 = 0,348 moli di H2O
0,348 moli x 18 = 6,27 g H2O
se 1 mole di Na2SO4. 10H2O contiene 10 moli di acqua, allora in X moli ne contenevano 6,27
322,19 : 180 = X : 6,27 da cui X = 322,19 x 6,27 / 180 = 11,21 g
risposta corretta C
37. Indicare la molecola apolare:
A) SO2 B) H2O C) CO2 D) NH3
soluzione
38. Indicare l’affermazione corretta:
A) l’angolo di legame nella molecola di H2O è 109°30’, come in un perfetto tetraedro B) l’angolo di legame nella molecola di H2O è 104°30’
C) l’angolo di legame nella molecola di H2O è 107°30’, come nella molecola di NH3
D) l’angolo di legame nella molecola di H2O è 120°
soluzione
l’ossigeno nell’H2O ha una ibridizzazione SP3 e quindi l’angolo di legame dovrebbe essere 109° 28′ Tuttavia, la presenza di due doppietti elettronici liberi sull’ossigeno determinano una loro repulsione con conseguente diminuzione dell’angolo HOH che diviene 104°45′.
la risposta corretta è B
39. Calcolare il volume di un vino di 12° che contiene la stessa quantità di alcol etìlico di 30 mL di una vodka di 41°:
A) 0,076 L B) 0,102 L C) 0,056 L D) 0,201 L
soluzione
E’ importante ricordare che il grado alcolico si basa su volumi e non su grammi; infatti il vino considerato nell’esempio non contiene 12 grammi di alcol per 100 ml, bensì 12 ml di alcol per 100 ml. Quindi i 41 gradi alcolici della vodka corrispondono a 41 ml di alcool per 100 ml.
Pertanto se in 100 ml di vodka vi sono 41 ml di alcool etilico in 30 ml di vodka vi sono X ml
100 :41 =30 :X X= 12,3 ml di alcool etilico in 30 ml di vodka
per conoscere il volume di vino che contiene 12,3 ml di alcool
se in 100 ml di vino vi sono 12 ml di alcool in X ve ne saranno 12,3 ml
100:12 =X : 12,3 X= 102,5 ml di vino cioè 0,1025 Litri di vino a 12° che corrispondono a 30 ml di vodka 41°
risposta corretta B
40. Calcolare il rapporto di combinazione moli di nitrato /moli di etano nella reazione:
C2H6 + NO3– + H+ + H2O → HCO3– + NH4+
A) 3,50 B) 1,75 C) 0,75 D) 2,85
soluzione
il n.o. di N in NO3- è +5 ed in NH4+ è -3
il n.o. del C in C2H6 è +3 ed in HCO3- è 4
la reazione redox è:
14[NO3- + 8e + 10H+ → NH4+ +3H2O
8 [C2H6 +6H2O → 2 HCO3- +14e + 16 H+
___________________________________
14 NO3- + 8C2H6 +140 H+ + 48 H2O → 14 NH4+ + 16 HCO3- + 128 H+ + 42 H2O
cioè semplificando opportunamente
14 NO3- + 8C2H6 +6H2O +12 H+→ 14 NH4+ + 16HCO3-
come si vede il rapporto moli NO3-/ moli C2H6 = 14 /8 = 1,75
risposta corretta B
SEGUONO GLI ULTIMI 20 QUESITI DELLA CLASSE A QUELLI DELLA CLASSE B RIPRENDONO IN CODA.
41. Indicare il nome del composto NaHSO3 secondo la nomenclatura internazionale:
A) bisolfito di sodio
B) bisolfato di sodio
C) idrogenosolfato di sodio
D) idrogenosolfito di sodio
soluzione
il gruppo SO2-2 è il solfito quindi essendo presente anche l’idrogeno il composto è
idrogenosolfito di sodio
42. Indicare le formule corrette dei composti ionici che si formano quando il catione Ca2+ si lega agli anioni cloruro, solfato e fosfato:
A) CaCl2 CaSO4 Ca3(PO4)2
B) CaCl2 CaSO4 Ca2(PO4)3
C) CaCl CaSO4 Ca3(PO4)2
D) CaCl2 Ca2SO4 Ca3(PO4)2
soluzione
Ca+2 + 2 Cl- → CaCl2
Ca+2 + SO4-2 → CaSO4
3 Ca+2 + 2 PO4-3 → Ca3(PO4)2
la risposta corretta è A
43. Si dà il nome di idrossido a un composto che contiene:
A) un metallo e ossigeno
B) un non metallo, idrogeno e ossigeno
C) un metallo e idrogeno
D) un metallo, idrogeno e ossigeno
soluzione
consideriamo NaOH esso è chiamato idrossido di sodio
il gruppo idrossido è il gruppo OH- ed il sodio è un metallo alcalino
pertanto in idrossido contiene un metallo,l’ossigeno e l’idrogeno
risposta corretta D
44. Indicare l’affermazione ERRATA a proposito dei numeri di ossidazione:
A) la somma algebrica dei numeri di ossidazione degli atomi in un composto neutro è uguale a zero
B) una diminuzione del n° di ossidazione di un elemento corrisponde a un acquisto di elettroni da parte dell’elemento stesso
C) il n° di ossidazione del fluoro è sempre -1
D) per qualsiasi elemento allo stato di ione monoatomico il n° di ossidazione è uguale alla carica dello ione
soluzione
In un composto neutro ad es HCl il n.o del cloro è -1 (è legato all’H meno elettronegativo) ed H ha n.o. +1 (legato al cloro più elettronegativo) e in totale la somma è pari a zero.
Il n.o. diminuisce per acquisto di elettroni ( esempio Al+3 + 3 e diviene Al° quindi il n.o. da +3 diminuisce a zero)
Il fluoro ha sempre (o quasi) nox -1. In teoria dovrebbe avere anche n.ox +1,+3,+5 ma non conosciamo se non l‘acido ipofluoroso (nox F= +1) che esiste, ma è stabile solo allo stato solido, quindi a bassissime temperature. Se diventa liquido esplode formando l’acido fluoridrico, molecola in cui il fluoro è più stabile..
quindi la risposta corretta è C
45. Una bombola contiene 40 L di Ar alla pressione di 120 atm e a 25°C. Indicare la massa del gas:
A) 7,800 kg B) 15,60 kg C) 784,1 kg D) 0,1560 g
soluzione
poiché PV = nRT avremo 120 x 40 = n (273+25) X 0,0821
da cui n= 4800 / 24,4 = 196,72 moli quindi 196,23 x 39,9= 7849 g cioè 7,849 Kg
risposta corretta A
46. Calcolare le moli di ossigeno necessarie per ossidare 450 g di FeS2, secondo la reazione:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
A) 8,00 mol B) 6,40 mol C) 10,3 mol D) 22,2 mol
soluzione
4 moli di FeS2 reagiscono con 11 moli di ossigeno quindi 450 g/120 moli reagiscono con X g di O2
4: 11 = 3,75 :X X= 3,75 x 11 / 4 =
X= 10,3 moli di ossigeno
risposta corretta C
47. Indicare quale tra le seguenti quaterne di numeri quantici NON descrive correttamente lo stato di un elettrone in un atomo:
A) n = 3 l = 4 ml = -2 ms = – l/2
B) n = 3 l = 2 ml = +l ms = + l/2
C) n = 4 l = 3 ml = +3 ms = + l/2
D) n = 2 l = 1 ml = +l ms = – 1/2
soluzione
ricordiamo che i numeri quantici sono quei numeri che compaiono nella funzione d’onda che descrive un elettrone e che sostituita nell’ equazione di Shrodinger fornisce l’energia di un elettrone caratterizzata da quella funzione d’onda . Affinchè la funzione d’onda sia soluzione dell’equazione è necessario che i numeri quantici assumano valori ben determinati e cioè
numero quantico principale n può assumere valori da 1 ad infinito
numero quantico l dipende dal valore di n infatti i valori sono solo quelli che vanno da 0 ad n-1
il numero quantico m (magnetico) dipende dal valore di l infatti per ogni valore di l, m ha i valori compresi tra +l e -l compreso lo zero
il numero quantico S detto di spin assume solo 2 valori possibili +1/2 o – 1/2
da quanto detto, quando
n=1
l=n-1 cioè assume solo il valore 0 ( si ha uno stato S 1S)
se n=2 i valori di l possono essere 0 oppure 1 (è compreso tra 0 ed n-1)
quando l=0 m=0 S=± 1/2 ( si ha uno stato S ed essendo n=2 allora lo stato è 2S)
quando l=1 i valori di m possono essere 3 infatti +l,0,-l cioè +1,0,-1 ( si ha uno stato P i 3 orbitali 2p) ed S=±1/2
se n=3 i valori possibili di l sono l=0 l=1 l=2, ( l assume valori compresi tra 0 ed l-1)
quando l=0 m=0 S=± 1/2 ( si ha lo stato 3S)
quando l=1 si hanno i tre stati +1,0,-1 ( tre stati P cioè 3P)
quando l=2 si hanno 5 stati +2,+1,0,-1,-2 (si hanno i 5 stati d cinque orbitali d 3d)
da quanto esposto la risposta errata è A in quanto quando n=3 allora l non può assumere il valore 4 ma può assumere solo i valori +2,+1,0,-1,-2
48. La perdita di un neutrone da parte del nucleo di un atomo comporta:
A) l’aumento di una unità del numero atomico
B) la diminuzione di una unità del numero di massa
C) l’aumento della carica positiva del nucleo
D) la ionizzazione dell’atomo
soluzione
I neutroni sono particelle atomiche dotate di una massa uguale a quella di un protone ma senza carica.
I protoni così come i neutroni sono a loro volta costituiti da particelle ancora più piccole dette Quarks. esistono 6 tipi di quarks e sono dotati di carica elettrica :
| Nome | Carica | Massa stimata (MeV/c2) |
|---|---|---|
| Su / Salita (u) | +2/3 | da 1,5 a 4 1 |
| Giù / Discesa (d) | -1/3 | da 4 a 8 1 |
| Strano / Sbieco (s) | -1/3 | da 80 a 130 |
| Incanto / Centro (c) | +2/3 | da 1 150 a 1 350 |
| Alto / Vero / Verità (t) | +2/3 | 174 300 ± 5 100 |
| Basso / Bello / Bellezza (b) | -1/3 | da 4 100 a 4 400 |
il protone è costituito da 2 quark Su ed 1 Quark giù quindi la carica del protone è 2 x 2/3 + (-1/3) = 4/3 -1/3 =3/3=1
Il neutrone è costituito da 2 Quark giù ed 1 Quark su quindi la carica del neutrone è 2 x -1/3 + 2/3 = – 2/3+2/3 =0
Ciò comporta che i neutrono influenzano il numero di massa ma non hanno influenza in alcun modo sulla carica del nucleo. La perdita di un neutrone pertanto comporta esclusivamente la diminuzione del numero di massa dell’atomo.
la risposta corretta è B
49. Litio, sodio e potassio:
A) sono alogeni
B) sono metalli di transizione
C) sono metalli alcalini
D) sono metalli alcalino-terrosi
soluzione
i metalli di transizione sono atomi che formano ioni stabili che possiedono orbitali d non completamente occupati e sono detti metalli del gruppo d come ad es. Fe,Co,Ni; i metalli alcalino terrosi sono i metalli che appartengono al gruppo II A come ad es. Ca,Mg; gli alogeni sono elementi che appartengono al gruppo VIIA e sono ad es. F,Cl,Br, I.
I metalli alcalini sono quei metalli che possiedono un elettrone spaiato in un orbitale di tipo S e sono proprio Litio , sodio e potassio
Li 3 elettroni struttura 1S2 2S1 oppure [He]2S1
Na 11 elettroni struttura 1s2 2S2 2P6 3S1 oppure [Ne] 3S1
K 19 elettroni struttura [Ar] 4S1
risposta corretta C
50. Gli elementi di transizione:
A) sono tutti non metalli e in essi gli orbitali d si riempiono progressivamente lungo ciascun periodo
B) sono tutti metalli e in essi gli orbitali p si riempiono progressivamente lungo ciascun periodo
C) sono tutti metalli e in essi gli orbitali d si riempiono progressivamente lungo ciascun periodo
D) sono tutti non metalli e in essi gli orbitali p si riempiono progressivamente lungo ciascun periodo
soluzione
se guardiamo la tavola periodica,
.jpg?revision=1)
è possibile vedere che gli elementi di transizione sono gli elementi che hanno numero atomico dal 21 al 30, dal 39 al 48, dal 72 all’80, e dal 104 al 112.
Sc[Ar] 3d14s2 Ti[Ar] 3d24s2 V[Ar] 3d34s2 Cr[Ar] 3d54s1 Mn[Ar] 3d54s2 Fe[Ar] 3d64s2 Co[Ar] 3d74s2 Ni[Ar] 3d84s2 Cu[Ar] 3d104s1 Zn[Ar] 3d104s2
si può notare che il riempimento progressivo degli orbitali d avviene lungo il periodo ed è anomalo nel cromo e nel rame.
la figura mostra le energie degli orbitali e si vede che l’orbitale 4S ha energia leggermente più bassa degli orbitali d. Ciò significa che nel riempimento progressivo (principio Aufbau) si riempie prima l’ orbitale 4s degli orbitali 3d e dopo si riempiono gli orbitali 4P.
La definizione di metallo di transizione è la seguente:i metalli di transizione sono atomi che formano ioni stabili che possiedono orbitali d non completamente occupati. Secondo questa definizione scandio e zinco non sono metalli di transizione pur appartenendo al blocco d. Infatti lo Zinco ha la struttura [Ar] 3d104s2 e quando forma ioni, perde sempre i 2 elettroni 4S per dare uno ione 2+ la cui struttura è [Ar] 3d10. Lo ione zinco quindi ha i livelli d pienamente occupati e quindi non ricade nella definizione di metallo di transizione. Lo scandio Sc la cui struttura è [Ar] 3d14s2forma ioni 3+ perdendo i 2 elettroni S e l’unico elettrone d rimanendo senza elettroni d occupati, per cui anche lo scandio non rientra nella definizione. Il rame Cu che ha struttura [Ar] 3d104s1 forma Cu+2 ed assume la struttura [Ar] 3d9 e quindi il rame è un metallo di transizione.
Sapresti spiegare perché quando si formano gli ioni dei metalli di transizione si perdono prima gli elettroni S e poi quelli d il che indicherebbe che gli orbitali 4S siano più energetici degli orbitali d, mentre è noto che si riempiono prima gli orbitali 4S e poi i 3d essendo i 4S con energia inferiore a quella dei 3d?
da quanto sopra la risposta corretta è C
51. Indicare quale atomo ha maggiore elettronegatività tra: A) F B) O C) Cl D) N
soluzione
L’elettronegatività è la tendenza di un atomo ad attrarre verso di sé gli elettroni del legame che lo lega ad un altro atomo. La differenza di elettronegatività tra due atomi determina un dipolo permanente nella molecola con una parziale carica negativa sull’atomo più elettronegativo ed una parziale carica positiva sull’altro atomo. Esistono tre scale di elettronegatività :
la scala di Pauling
Se consideriamo due atomi A e B che prendono parte a un legame covalente. Secondo Pauling la differenza di elettronegatività tra questi due atomi è pari a:[1]
dove: e sono le elettronegatività degli atomi A e B.
- Δ è detto “surplus di energia” ed è dato da:
- EAB è l’energia di legame del composto A-B,
il coefficiente 0,102 è dovuto al fatto che originariamente Pauling utilizzò entalpie espresse in eVolt, mentre attualmente l’unità di misura dell’entalpia è KJ/mol. Se espressa invece in kcal/mol il coefficiente assume il valore di 0,208.
la scala di Mulliken
L’elettronegatività è definita semplicemente come la media aritmetica tra energia di ionizzazione ed affinità elettronica
la scala di Allred e Rochow
Questa scala si basa sull’idea che un elettrone venga attratto da un atomo per effetto della forza elettrostatica esercitata dal nucleo:
dove Z* = carica nucleare efficace
L’elettronegatività è proporzionale a questa forza:
dove r è il raggio covalente dell’atomo e le costanti numeriche sono tali da ottenere dei valori compatibili con la scala di Pauling.
Indipendentemente dalla scala prescelta i valori di elettronegatività mostrano un andamento regolare lungo la tavola periodica. I valori di elettronegatività diminuiscono procedendo dall’alto verso il basso lungo un gruppo ed aumentano procedendo da sinistra a destra lungo un periodo:
| Elemento | Allred-Rochow | Pauling | Mulliken |
|---|---|---|---|
| C | 2,50 | 2,55 | 2,63 |
| N | 3,07 | 3,04 | 2,33 |
| O | 3,50 | 3,44 | 3,17 |
| F | 4,10 | 3,98 | 3,91 |
da questa tabella si evince che il Fluoro è l’elemento più elettronegativo.
risposta corretta A
52. Un recipiente rigido ed ermeticamente chiuso contiene 12 L di un gas a comportamento ideale a 27 °C e 0,20 atm. Di quanto bisogna innalzare la temperatura perché la pressione diventi 0,40 atm?
A) 27 °C B) 5,4 °C C) 300 °C D) 12 °C
soluzione
sappiamo che a volume costante
P1/T1=P2/T2
0,20 / 300 = 0,40/T2 T2= P2/P1/T1 T2 = 600°
da 300 K a 600 K perciò ΔT=300°
risposta corretta C
53. Il manganese è presente in natura come pirolusite (MnO2), hausmannite (Mn3O4), braunite (3 Mn2O3 ·1 MnSiO3) e manganite (MnOOH). Indicare il minerale con la maggiore percentuale di Mn:
A) MnO2 B) Mn3O4 C) 3 Mn2O3 ·1 MnSiO3 D) MnOOH
86,9 228,7 471 131 87,9
soluzione
se in 1 mole di MnO2 vi è 1 mole di Mn, in 100 moli di MnO2 ve ne saranno X
e facendo analogo ragionamento per tutti i composti si ha :
86,9 : 54,9 = 100 :X X= 63,1o % A
228,8 :3x 54,9 =100 :X X= 72,23 % B
602 : 384,3=100:X X= 63,8o % C
87,9 :54,9 =100:X X = 62,45 D
dai dati risulta che il composto B contiene la maggior percentuale di Mn
54. Gli isotopi dell’ossigeno 16O e 18O differiscono per:
A) un protone e un neutrone
B) due protoni
C) due neutroni
D) due elettroni
soluzione
dal momento che un neutrone ha una massa pari a quella di un protone, allora l’ 18O differisce dall’ 16O per 2 neutroni
risposta corretta C
55. Indicare qual è l’origine del simbolo del rame, Cu:
A) deriva dal nome della scienziata Maria Curie
B) deriva dal nome latino dell’isola di Cipro
C) deriva dal suo nome in inglese, copper
D) deriva dalle sue proprietà di ottimo conduttore
soluzione
il nome cuprum è stato attribuito all’elemento Rame, il cui simbolo è Cu, in quanto abbondantemente presente nelle miniere dell’isola di Cipro ma non si sa bene se è il nome Cuprum a derivare da Cipro o viceversa.
risposta corretta B
56. Per reazione tra un ossido di un metallo e l’acqua si ottiene:
A) un idracido
B) un sale
C) un acido ossigenato
D) un idrossido
soluzione
gli ossidi dei metalli MeO Me2O formano con l’aqua composti ossidrilici quindi idrossidi.Per es.
Na2O + H2O → 2 NaOH idrossido di sodio
MgO + H2O→ Mg(OH)2
risposta corretta D
57. Il ghiaccio ha minore densità dell’acqua liquida, infatti l’uno galleggia sull’altra. Tuttavia, tale comportamento è atipico, in quanto generalmente i composti hanno maggiore densità allo stato solido che allo stato liquido. A cosa è dovuto tale comportamento insolito dell’acqua?
A) all’ibridazione
B) alla polarità
C) alla presenza del legame a idrogeno
D) alla massa molecolare
soluzione
L’acqua ha un comportamento anomalo rispetto agli altri liquidi che si raffreddano perché nella formazione del ghiaccio ,intorno a 0 °C quando le molecole di acqua iniziano a disporsi secondo geometrie esagonali , a causa dei legami idrogeno che esistono tra le molecole di acqua, (una molecola di acqua è legata a 4 altre molecole di acqua con legame idrogeno), nell’impaccarsi, tra molecola e molecola rimane molto più spazio e questo provoca un aumento di volume rispetto all’acqua originaria generando una minor densità del ghiaccio rispetto al liquido per cui il ghiaccio galleggia sull’acqua.
risposta corretta C
58. Calcolare il volume di soluzione di NaCl 0,5 M che è possibile preparare aggiungendo acqua a 0,8 L di una soluzione di NaCl 1,2 M (si considerino i volumi additivi):
A) 1,2 L B) 2,2 L C) 1,5 L D) 1,9 L
soluzione
sappiamo che se mescoliamo due liquidi di diversa molarità
volume 1 x Molarità 1 = volume 2 x Molarità 2
pertanto si ha:
0,8 x 1,2 = X x 0,5
0,96/ 0,5 = 1,9 L
risposta corretta D
59. Indicare la carica formale degli atomi di fosforo e ossigeno nella formula di Lewis più stabile per H3PO4:
A) P = +1 O = -1
B) P = +5 O = -2
C) P = +3 O = 0
D) P = 0 O = 0
soluzione
60. La molecola di azoto è diatomica. Tra i due atomi esiste:
A) un legame singolo
B) un legame triplo
C) un legame ionico
D) un legame doppio
soluzione
l’ atomo di azoto ha ibridizzazione SP e forma un legame sigma tra i due atomi con l’orbitale ibrido mentre dalla sovrapposizione dei due orbitali P forma due legami π.
SEGUONO GLI ULTIMI 20 QUESITI DELLA CLASSE B
41. Il contenuto di CO2 di un’acqua minerale si determina mediante la reazione:
CO2 + Ba(OH)2 → BaCO3 (s) + H2O
Sapendo che da 0,850 L di acqua si ottengono 44,7 g di BaCO3, calcolare la concentrazione di CO2 in g/L.
A) 23,6 B) 22,3 C) 31,8 D) 11,7
soluzione
se in BaCO3 (197,34 g)è contenuta una mole di CO2 ( 44 g) allora in 44,7 g ve ne sono X
197,34 :44 = 44,7 :X X= 44,7 x 44 /197,34 = 9,96 g provenienti da 0,850 Litri di Acqua
pertanto se da 0,850 litri si ottengono 9,96 g allora da 1 litro se ne ottengono X
X= 9,96/0,850=11,7
risposta corretta D
42. Calcolare il pH di una soluzione ottenuta mescolando volumi uguali di cloridrato di glicina (HOOC-CH2-NH3+Cl–) 0,1 M e di NaOH 0,1 M (pKa1 = 2,35; pKa2 = 9,78).
A) 9,81 B) 8,43 C) 6,06 D) 10,7
soluzione
la glicina è un aminoacido con 2 costanti di dissociazione la cui concentrazione è 0,1M
questa si dissocia H2A⇐⇒ H+ HA- la cui costante di dissociazione è Ka1
HA- ⇐⇒ H+ A-2 la cui costante di dissociazione è Ka2
sostituendo nella espressione [H+] = [A2-] + [OH–] – [H2A] otteniamo
pH = ½ pKa1 + ½ pKa2
Nel caso di questo quesito, applicando l’espressione sopra indicata, si ha :
1/2 pKa1= 2,35/2 = 1,175
1/2 pKa2 = 9,78/2= 4,89 per cui PH = 1,17+ 4,89 =6,06
risposta corretta C
43. Il bario contenuto in un minerale grezzo viene quantitativamente precipitato come BaSO4. Da 85,0 kg di minerale si ottengono 1,80 kg di BaSO4. Indicare la percentuale in massa di Ba contenuta nel minerale grezzo.
A) 18,0% B) 12,5% C) 1,25% D) l,80%
soluzione
calcoliamo prima quanto bario viè in 1800g (1,8 Kg) dalla proporzione:
se in BaSO4 vi è 1 Ba allora in 1800 g :X
233,3 : 137,33 = 1800:X X= 1059 g cioè 1,0569 Kg di Ba che provengono da 85 Kg di BaSO4
per calcolare la % di Bario nel campione iniziale di 85 Kg ricorriamo alla proporzione:
se nel campione iniziale di 85,0 Kg vi sono 1,056 Kg di Ba in 1oo :X X= 1,25 %
risposta corretta C
44. Indicare, sulla base della teoria VSEPR, quale coppia è costituita da specie planari: A) CH3+ e XeF4
B) CH3+ e CH3–
C) CH3– e XeF4
D) CH4 e XeF4
soluzione
La teoria VSEPR (Valence Shell Electron Pair Repulsion, cioè repulsione delle coppie elettroniche nelo strato di valenza) è un metodo per valutare la disposizione geometrica degli atomi in una molecola e si basa sul fatto che le coppie di elettroni tendono a disporsi il più lontano possibile fra loro.La distribuzione dei legami che si trovano intorno ad un atomo dipende dal numero totale di coppie di elettroni che lo circondano, sia quelle che sono coinvolte in legami chimici sia quelle che non sono coinvolte in nessun legame chimico(lone pair). Le coppie di elettroni si dispongono nello spazio in modo da minimizzare le forze di repulsione reciproca. Le forze di repulsione tra due coppie di non legame sono più forti rispetto alle forze di repulsione tra una coppia di non legame e coppia di legame, che sono a loro volta più forti delle forze di repulsione tra due coppie di legame.
Secondo la teoria si considerano tre tipi di repulsione tra gli elettroni:
- La repulsione tracoppia solitaria e coppia solitaria (lone pair-lone pair, lp-lp).
- La repulsione tra coppia solitaria e coppia di elettroni di legame (lone pair-bonding pair, lp-bp).
- La repulsione tra coppia di elettroni di legame e coppia di elettroni di legame (bonding pair-bonding pair, bp-bp).
Per il conteggio degli elettroni si usa l metodo AXE in cui con la lettera A si indica l’atomo centrale e ha sempre valore 1. La X rappresenta quanti legami sigma si formano tra l’atomo centrale e gli atomi ad esso legati. I legami covalenti multipli (doppi, tripli, etc) contano come un X. Infine la E rappresenta il numero di coppiesolitarie di elettroni (lone pair) presenti nello strato di valenza dell’atomo centrale. La somma di X ed E, definita come Numero Sterico (SN) è associata anche al numero totale di orbitali ibridi considerati dalla teoria della valenza.
In base a questa teoria una molecola AX2
lo XeF4 ha struttura planare quadrata con due doppietti liberi infatti è del tipo
Pertanto, il metano ha struttura tetraedrica mentre CH3+ ha struttura planare in quanto il C è ibrido SP2 quindi i 3 atomi di H si trovano sullo stesso piano con angoli di 120° ed un orbitale P non ibrido con la carica positiva.
quindi la coppia planare è XF4 e CH3+
risposta corretta A
45. Indicare le strutture che rappresentano un estere e un’aldeide:
A) 1 e 2 B) 2 e 3 C) 3 e 4 D) l e 4
soluzione
un’aldeide è una molecola organica che possiede il gruppo funzionale CHO mentre un estere è un composto derivato da una cido organico in cui l’H su gruppo COOH è sostituito da un gruppo R che può essere ad esempio CH3, oppure CH3-CH2-
Da quanto sopra si evince che la coppia è composta dalla molecola 2 e dalla 3
risposta corretta B
46. Quale dei seguenti sistemi può essere considerato in stato di equilibrio?
A) un bicchiere contenente una soluzione acquosa di glucosio esposto all’aria
B) un matraccio tappato contenente una soluzione acquosa di glucosio e vapore acqueo
C) una soluzione di glucosio in acqua dentro un matraccio tappato, agitata per mezzo di un’ancoretta magnetica
D) una soluzione di glucosio in acqua dentro un matraccio tappato, a contatto con una fonte di calore
soluzione
Un sistema si definisce in equilibrio quando non vi è alcuna variazione di energia libera cioè ΔG =0
E’ evidente che le risposte A,C e D non possono essere corrette in quanto la soluzione di glucosio non può essere in equilibrio poichè ΔG è diverso da 0, e solo la risposta B è corretta in quanto solo in questo caso l’equilibrio non può essere modificato e quindi il ΔG rimane =0.
47. Un sistema viene portato da uno stato iniziale 1 a uno stato finale 2 mediante scambi di calore e lavoro. Quale delle seguenti quantità è indipendente dall’effettivo percorso seguito?
A) w B) q + w C) q + w solo se il lavoro è di volume D) q
soluzione
Dal primo principio della termodinamica sappiamo che
E = Q + lavoro cioè E= Q + w
il lavoro è per convenzione negativo se viene compiuto dal sistema.
E’ noto che una funzione che non dipende dal cammino percorso per raggiungere uno stato finale non è UNA FUNZIONE TERMODINAMICA .
Nè il calore nè il lavoro se considerati singolarmente rispondono al requisito di funzione termodinamica ma l’Energia invece lo è, quindi la somma E= q+w qualunque sia il tipo di lavoro svolto è una funzione termodinamica, ma non lo sono nè q nè w considerati singolarmente.
La risposta corretta è B
48. Secondo la teoria VSEPR, una geometria quadrata planare deriva dalla presenza sull’atomo centrale di:
A) due coppie di legame e quattro coppie di non legame
B) quattro coppie di legame e una coppia di non legame
C) quattro coppie di legame e nessuna coppia di non legame
D) quattro coppie di legame e due coppie di non legame
soluzione
abbiamo visto nel quesito 44 che la geometria planare quadrata secondo la teoria VESPR è quella dovuta a 4 legami e due coppie di non legame
risposta corretta D
49. Il nitrato di piombo(II) si decompone per riscaldamento secondo la seguente reazione da bilanciare:
Pb(NO3)2 → PbO + NO2 + O2
Calcolare la massa di NO2 che si forma dalla decomposizione di un campione di 20,0 g contenente il 73,0% di Pb(NO3)2:
A) 5,40 g B) 78,6 g C) 1,64 g D) 4,06 g
soluzione
la reazione bilanciata è
2Pb(NO3)2 → 2PbO + 4NO2 + O2
I grammi niziali sono 20,0 x 0,73 = 14,6 g
se da 2Pb(NO3)2 si ottengono 4NO2 da 14,6 g se ne ottengono X
2x 331,2 : 4x 46 = 14,6 :X X= 4,06 g
risposta corretta D
50. Partendo da 34,0 g di idrossido di alluminio si ottengono 41,8 g di solfato di alluminio secondo la seguente reazione (da bilanciare):
Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O
Indicare la resa teorica del solfato e la resa percentuale della reazione.
A) 74,6 g; 56,0% B) 74,6 g; 28,0% C) 149 g; 28,0% D) 149 g; 56,0%
soluzione
la reazione bilanciata è
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
156 294 342,14
se 156: 342,2 = 34,0 :X X=74,6 teorici
infatti da questa reazione si dovrebbero ottenere 74,6 g di solfato mentre in realtà si ottengono solo 41,6 g
Quindi se 74,6 rappresenta il 100% teorico, 41,6 che si ottengono in realtà saranno X%
100: 74,6 = X = 41,6
X= 41,6 x 100/74,6 = 56,0%
risposta corretta A
51. Indicare il composto più solubile tra i solidi seguenti:
A) SrSO4 (KPS = 2,8 ·10–7)
B) CaSO4 · H2O (KPS = 2,4 ·10–5)
C) Ag2SO4 (KPS = 1,7 ·10–5)
D) PbSO4 (KPS = 1,8 ·10–8)
soluzione
nel primo caso
SrSO4<=> Sr+2 + SO4-2 Kps=S x S S=√Kps = 7,84 vx 10-14
CaSO4 · H2O <=> Ca+2 + SO4-2 Kps = S x S S= √Kps = 4,89 x 10 -3 moli /l
Ag2SO4 <=> 2 Ag+ + SO4-2 Kps =( 2s)² x S da cui Kps = 4S³
S³ = Kps/4 = 4,24 x 10-6 S= 1,62 x 10-2 g/l
PbSO4 <=> Pb+2 + SO4-2 Kps = SxS S=√Kps = √1,8 x 10-8 = 1,34 x 10-4
dai dati ottenuti il composto più solubile è Ag2SO4
risposta corretta C
52. In un campione di aria il valore della concentrazione di CO risulta 15 mg/m3 (a 273,15 K e 1,013· 105 Pa). Calcolare la concentrazione di CO in ppm (volumi di CO su 106 volumi di aria):
A) 30,0 B) 12,0 C) 7,50 D) 28,0
soluzione
per calcolare il volume corrispondente a 15 mg di CO in 1000 litri (1 m³ ) sappiamo che 1 mole di gas a 273,15 e 1,03 x 105 cioè a condizioni normali, occupa 22,414 litri quindi 0,015 /28 moli di CO occuperanno il volume V
1 :22,4 =0,015/28:V V= 0,012 l
essendo i ppm il volume in litri in 106 litri basta effettuare la proporzione
1000 : 0,012 l = 106 : X X= 0,012 x 10³ = 12,0 ppm
risposta corretta B
53. La durezza di un’acqua si può esprimere in gradi tedeschi (pari ai g di CaO in 100 L di acqua). Esprimere il contenuto di 98,0 mg/L di Ca2+ e 25,0 mg/L di Mg2+ di un campione di acqua in gradi tedeschi:
A) 19,5 B) 21,7 C) 98,3 D) 10,8
soluzione
Per durezza dell’acqua si intende un valore numerico che indica il contenuto totale di ioni Ca ed Mg in essa contenuti espressi come CaO (gradi Tedeschi). Dobbiamo pertanto calcolare quanto Ca e quanto Mg vi sono nell’acqua ed esprimerli come se fossero CaO in 100 litri di acqua.
Per quanto riguarda il Ca sappiamo che il suo contenuto in 1 litro è 9,8 mg cioè 0,098 g perciò in 100 litri vi saranno
1litro :0,098 g =100 litri 😡 X= 9,8/1= 9,8 g di Ca in 100 Litri
questa quantità va espressa come CaO per cui
CaO :Ca = X: 9,8 X quantità di CaO in cui vi sono 9,8 g di Ca
56 : 40 = X :9,8 X = 13,72 g di CaO contenuti in 100 litri
per il Mg si ha si esegue lo stesso ragionamento per cui
1 : 0,025 = 100 😡 X= 2,5 g di Mg in 100 Litri
MgO :Mg = X : 2,5
403:243 =X : 2,5 X= 4,15 g
tuttavia anche questa quantità deve essere espressa come CaO perciò riteniamo
Mg =Ca e quindi
56:40= X 4,15 X= 5,80
in totale la quantità di CaO è
CaO in 100 Litri = 13,72 +5,8 = 19,5 gradi tedeschi
risposta corretta A
54. Indicare quale delle seguenti molecole è un composto chirale:
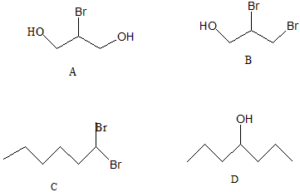
A) a B) b C) c D) d
soluzione
chirale è una molecola non sovrapponibile alla propria immagine speculare. In una molecola organica chirale, vi è almeno un atomo di C chirale cioè un atomo di carbonio cui sono legati 4 atomi o gruppi atomici diversi.
Tra le molecole proposte possiamo vedere che il carbonio chirale è il carbonio della molecola B.
risposta corretta B
55. Aumentando la temperatura, la velocità. di una reazione elementare:
A) aumenta
B) diminuisce
C) resta invariata
D) non si può dire: dipende dalla concentrazione iniziale
soluzione
56. Una reazione che obbedisce alla legge cinetica v = k [A]2 [B] si dice:
A) di ordine 2 rispetto ad A, di ordine 1 rispetto a B e complessivamente di ordine 2
B) di ordine 1 rispetto ad A, di ordine 2 rispetto a B e complessivamente di ordine 3
C) di ordine 2 rispetto ad A, di ordine 1 rispetto a B e complessivamente di ordine 3
D) di ordine 3 rispetto ad A, di ordine 1 rispetto a B e complessivamente di ordine 2
soluzione
57. Due sostanze hanno formula Cu5FeS4 e Cu2S rispettivamente. Indicare quale tra queste affermazioni è corretta:
A) le due sostanze contengono la stessa percentuale in peso di rame
B) la percentuale in peso di rame è maggiore in Cu5FeS4
C) la percentuale in peso di rame è maggiore in Cu2S
D) la percentuale in peso di rame in Cu5FeS4 è 2,5 volte quella di Cu2S
soluzione
la percentuale di rame è per Cu5FeS4
Cu5FeS4 : 5Cu = 100 : X
501,6 : 317,55 = 100 :X x= 63,34 % di Cu in Cu5FeS4
la percentuale di rame in Cu2S
Cu2S :2Cu = 100 :X
159,15 : 63,55 x 2 =100 :X X= 79,86 % in Cu2S
risposta corretta C
58. La solubilità in acqua di SO2 (espressa come frazione molare) è pari a 0,0246. Calcolare la sua concentrazione in molalità (m):
A) 0,0546 B) 1,3997 C) 0,9897 D) 0,0890
soluzione
59. Indicare quale di questi sali non è stabile in soluzione:
A) K4Fe(CN)6 B) (NH4)2Ce(NO3)6 C) NaH2PO3 D) FeI3
soluzione
i potenziali di riduzione standard confermano che
la reazione tra Fe+3 e Iodio 2Fe3+ + 3I- → 2Fe2+ + I3- (lenta)
quindi FeI3 è un composto estremamente instabile, mentre gli altri sali in soluzione semplicemente si sciolgono.
risposta corretta D
60. Per la reazione
2 NO2 (g) → N2O4 (g) ΔH° = -57,2 kJ.
Se ΔH° e ΔS° sono assunti indipendenti dalla temperatura, si può affermare che:
A) quando la temperatura aumenta, la costante dì equilibrio diminuisce
B) quando la temperatura aumenta, la costante di equilibrio aumenta
C) quando la temperatura aumenta, la posizione dell’equilibrio non si sposta
D) nessuna delle precedenti è valida
soluzione
Viceversa, se la reazione è endotermica un aumento di temperatura non può che favorire la reazione e quindi k aumenta.
















 2
2 4
4
Lascia un commento